





鲁科版高中化学选择性必修1第1章化学反应与能量转化第3节第1课时电解的原理课件
展开
这是一份鲁科版高中化学选择性必修1第1章化学反应与能量转化第3节第1课时电解的原理课件,共38页。
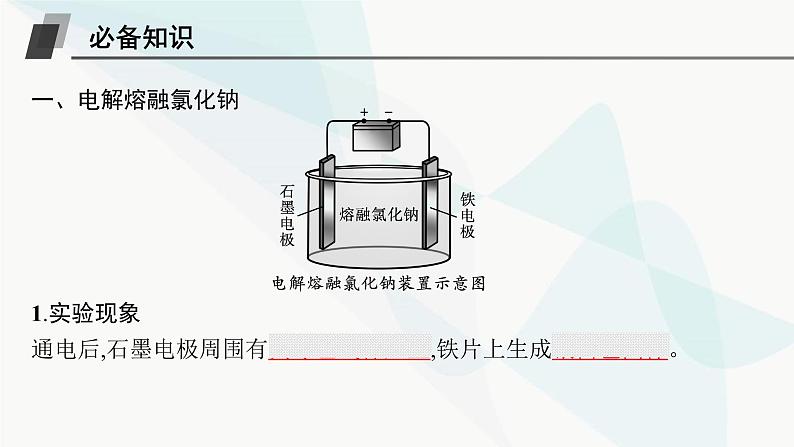
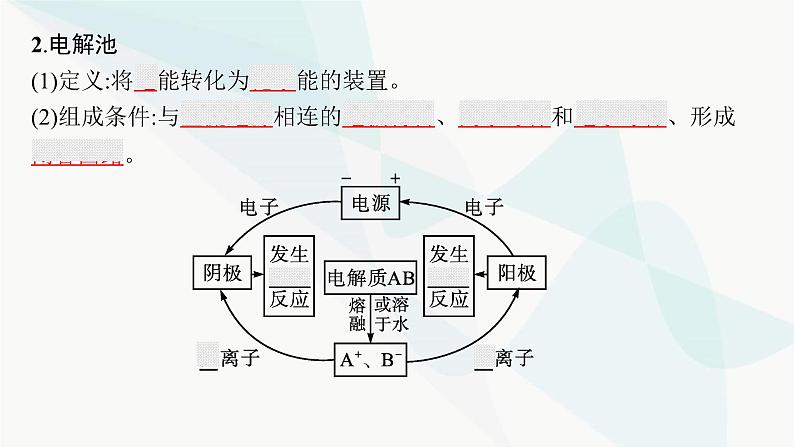
第1章 化学反应与能量转化第3节 第1课时 电解的原理素 养 目 标1.能分析、解释电解池的工作原理,逐步形成证据推理与模型认知的学科核心素养。2.能设计简单的电解池,体现科学探究与创新意识的学科核心素养。基础落实•必备知识全过关重难探究•能力素养全提升目录索引 基础落实•必备知识全过关必备知识一、电解熔融氯化钠 1.实验现象通电后,石墨电极周围有黄绿色气体产生,铁片上生成银白色固体。2.实验分析(1)熔融的氯化钠中存在的微粒有Cl-、Na+。(2)通电后离子移动的方向:Cl-向石墨电极移动,Na+向铁电极移动。(3)电极上的电极反应:铁电极:2Na++2e-==2Na。石墨电极:2Cl--2e-==Cl2↑。3.实验结论熔融的氯化钠在电流作用下发生化学变化,分解生成Na和Cl2。从氧化还原的角度分析:铁电极上发生还原反应,石墨电极上发生氧化反应。【微思考】电解质的导电与金属导电有什么不同?提示电解质的导电过程是被电解的过程,属于化学变化;金属导电过程是电子的定向移动,属于物理变化。二、电解原理1.电解将直流电通过熔融电解质或电解质溶液,在两个电极上分别发生氧化反应和还原反应的过程叫作电解。2.电解池(1)定义:将电能转化为化学能的装置。(2)组成条件:与直流电源相连的电极材料、离子导体和电子导体、形成闭合回路。(3)电极名称与电极反应:阳极:与电源正极相连,溶液中阴离子移向阳极,失去电子,发生氧化反应。阴极:与电源负极相连,溶液中阳离子移向阴极,得到电子,发生还原反应。(4)电子流向:电源负极→导线→电解池的阴极;电解池的阳极→导线→电源的正极。(5)电解熔融NaCl的方程式:2NaCl 2Na+Cl2↑ 。【微思考】电解池中,阴阳两极的材料与电解产物有关系吗? 提示 阳极材料与阳极产物有关,阴极无关。 3.电解池与原电池的区别 自我检测判断下列说法是否正确,正确的打“√”,错误的打“×”。(1)与电源正极相连的是电解池的阴极。( )(2)用惰性电极电解NaCl溶液时可以得到Na和Cl2。( )(3)电解池工作时,阳极发生还原反应,失去电子。( )(4)电解池工作时,阳极上的电子通过电解质溶液移向阴极。( )(5)电解AgNO3溶液时,Ag+移向阳极,N 移向阴极。( )× × × × × 重难探究•能力素养全提升探究一 电解时两电极产物的判断与电极反应的书写问题探究1807年,戴维将表面湿润的氢氧化钾放在铂制器皿里,并用导线将铂制器皿以及插在氢氧化钾里的电极相连,整套装置都曝露在空气中。通电以后,氢氧化钾开始熔化。戴维发现在阴极附近有带金属光泽的酷似水银的颗粒生成,并生成紫色火焰,这是钾元素的发现过程。这其中的奥秘是什么呢?电解时,物质的变化是如何发生的?提示 在通电条件下,氢氧化钾发生了电解,分别在两个电极上生成了不同的物质。归纳拓展1.电解池的工作原理(1)以惰性电极电解CuCl2溶液为例。总反应离子方程式:Cu2++2Cl- Cu+Cl2↑ (2)电子和离子的移动方向(惰性电极)。 【微点拨】①金属活动性顺序中银以前的金属(含银)作为电极时,金属本身可以参与阳极反应,如Zn、Fe、Cu、Ag等,这样的电极也叫活性电极;金属活动性顺序中银以后的金属或能导电的非金属作为电极时,电极本身不参与阳极反应,称为惰性电极,主要有铂(Pt)、石墨等。②电解时,在外电路中有电子通过,而在溶液中是靠离子移动导电,即电子不会通过电解质溶液。2.电解时电极产物的判断 3.电极反应及电解总反应的书写(1)电极反应的书写。①确定电极:与电源正极相连的为阳极,与电源负极相连的为阴极。②确定电极反应:阳极发生氧化反应,若是活性电极,电极材料本身放电;若是惰性电极,溶液中的阴离子放电。阴极发生还原反应,是溶液中阳离子放电。③写电极反应。电极反应的书写可概括为:a.列物质、标得失;b.选离子、配电荷;c.配个数、巧用水。(2)电解总反应的书写。①在确保两极电子转移数目相同的条件下,将两电极反应合并即得电解总反应。②总反应要注明条件:通电。应用体验视角1 根据电源判断电解池的两极和反应1.如图是电解CuCl2溶液的装置,其中c、d均为石墨电极,则下列有关判断正确的是( )A.a为负极,b为正极B.a为阳极,b为阴极C.电解过程中,d电极质量增加D.电解过程中,氯离子浓度不变C解析 电流从电源的正极流出,故a为正极,b为负极,c为阳极,d为阴极。电解时,因Cu2+移向阴极,在阴极放电析出Cu,故阴极(d电极)质量增加;Cl-移向阳极,在阳极(c电极)放电逸出Cl2,导致溶液中Cl-浓度降低。【变式设问】(1)请写出c极的电极反应。提示 2Cl--2e-==Cl2↑(2)请写出电子的流动方向。提示 电子流向:b→d,c→a2.如图所示,下列有关实验现象的描述正确的是( )C解析 a电极为阴极,得到电子,发生还原反应,b电极为阳极,失去电子,发生氧化反应。A项,a电极上有铜生成,质量增加,b电极上有黄绿色的氯气生成,错误;B项,a电极上有氢气生成,质量不变,b电极上有无色的氧气生成,错误; C项,a电极上有铜生成,质量增加,b电极上有无色的氧气生成,正确;D项,a电极上有无色的氢气生成,b电极上有黄绿色的氯气生成,错误。视角2 根据外电路电子移动方向或电流方向判断电解池的两极和反应3.某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在图中,下列有关分析完全正确的是( )B解析 根据电子流向可知,c是负极,d是正极,a是阴极,b是阳极,电解时,电解质溶液中阳离子向阴极移动,阴离子向阳极移动,则Q离子是阳离子,P离子是阴离子,故B正确。视角3 根据离子移动方向判断电解池的两极和反应4.(2023广东深圳高二期末校考)一种新型镁硫二次电池放电时的工作原理如图所示(a为镁电极)。下列说法不正确的是( )A.当石墨烯中的硫均转化为MgS8时,电路中转移的电子数达到最大值B.离子交换膜应为阳离子交换膜C.充电时,阴极电极反应为Mg2++2e-═MgD.放电时,若电路中转移1 mol电子,正极质量增加12 gA解析 由题图可知,放电时,Mg作负极,电极反应为Mg-2e-═Mg2+,S作正极,电极反应分别为8S+Mg2++2e-═MgS8,MgS8+3Mg2++6e-═4MgS2, Mg2++MgS2+2e-═2MgS,故当石墨烯中的S均转化为S2-时,电路中转移的电子数达到最大值,故A错误;放电时,负极生成Mg2+,正极消耗Mg2+,故Mg2+从左侧向右侧迁移,使用的隔膜是阳离子交换膜,故B正确;充电时,Mg作阴极,阴极反应为Mg2++2e-═Mg,故C正确;正极反应包括:Mg2++MgS2+2e-═2MgS,放电时,若电路中转移1 mol电子,则正极质量增加0.5 mol×24 g·mol-1=12 g,故D正确。探究二 利用惰性电极电解电解质溶液的规律问题探究1.电解H2SO4溶液与电解盐酸(惰性电极)的产物相同吗?溶液pH有何变化? 提示阴极产物相同(都是H2),阳极产物不同(H2SO4→O2,HCl→Cl2),电解H2SO4溶液后溶液的pH减小,电解盐酸后溶液的pH增大。2.若以惰性电极电解CuSO4溶液,试分析电极产物并写出电极反应及总反应。 提示在CuSO4溶液中含有Cu2+、H+、OH-、S 四种离子,在阴极上Cu2+放电得到Cu;在阳极上OH-放电得到O2,阴极电极反应为2Cu2++4e-==2Cu,阳极电极反应为2H2O-4e-==O2↑+4H+;总反应为2CuSO4+2H2O 2H2SO4+2Cu+O2↑。归纳拓展用惰性电极电解的一般规律 【微点拨】利用惰性电极电解电解质溶液后要恢复原电解质溶液的浓度,需要加适量的某物质时,遵循“少什么加什么,少多少加多少”的原则,所加物质可以是阴极与阳极产物的化合物。应用体验视角1 用惰性电极电解的分析方法1.如图是利用直流电源电解稀Na2SO4溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是( )A.逸出气体的体积,a电极的小于b电极的B.一电极逸出无味气体,另一电极逸出刺激性气味气体C.a电极附近呈红色,b电极附近呈蓝色D.a电极附近呈蓝色,b电极附近呈红色D解析 电解Na2SO4溶液时,a电极为阴极:4H++4e-==2H2↑,b电极为阳极:4OH--4e-==O2↑+2H2O;a电极周围由于H+放电溶液呈碱性,石蕊遇碱显蓝色,b电极周围由于OH-放电溶液呈酸性,石蕊遇酸显红色。【变式设问】(1)若电解实验停止后,把溶液充分混合,溶液的pH如何变化?提示 溶液的pH不变。(2)请写出电解过程的总反应,并分析a、b两极产生气体的体积之比(相同状况下)是多少?提示 总反应:2H2O 2H2↑+O2↑;a、b两极产生气体的体积之比为2∶1。规律方法 判断电解后溶液中生成酸或碱的方法(1)若电解产物只有H2而无O2,则阴极周围生成碱。(2)若电解产物只有O2而无H2,则阳极周围生成酸。(3)若电解产物既有O2又有H2,且二者物质的量之比为1∶2,则实质是电解水,电解过程中阳极生成酸,阴极生成碱,最终溶液中还是原溶质。2.海水中含有 等离子,pH约为8。有研究提出,用如图所示方法能够从海水中提取CO2。下列说法正确的是( )A.c室出口溶液显酸性B.相同时间内,两个阳离子膜中通过的H+数目相等C.a室中发生的电极反应:2H2O+2e-═H2↑+2OH-D.b室中发生的化学反应:D视角2 用惰性电极电解的规律3.用惰性电极电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是( )A.CuCl2 B.CuSO4 C.Na2SO4 D.NaClC解析 用惰性电极电解CuCl2溶液,阴极产物为Cu,阳极产物为Cl2,A项错误;用惰性电极电解CuSO4溶液,阴极产物为Cu,阳极产物为O2,B项错误;用惰性电极电解Na2SO4溶液,实质是电解水,因此阴极和阳极上的主要产物分别是H2和O2,C项正确;用惰性电极电解NaCl溶液,阴极产物为H2,阳极产物为Cl2,D项错误。4.用石墨电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内物质),能使溶液恢复到原来的成分和浓度的是( )A.AgNO3[AgNO3] B.NaOH[H2O]C.KCl[KCl] D.CuSO4[Cu(NO3)2]B5.按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量。下列叙述正确的是( )A.F表示反应生成Cu的物质的量B.E表示反应实际消耗H2O的物质的量C.E表示反应生成O2的物质的量D.F表示反应生成H2SO4的物质的量B解析 由题意可知电解总反应为2CuSO4+2H2O 2Cu+2H2SO4+O2↑,根据反应中各物质与转移电子的关系:2Cu~2H2O~2H2SO4~O2~4e-可知,E表示反应消耗H2O的物质的量或反应生成Cu、H2SO4的物质的量,F表示反应生成O2的物质的量。






