

江西省清江县2022-2023学年高二下学期期末考试化学试题(Word版含答案)
展开清江县2022-2023学年高二下学期期末考试
化学
注意事项:
1.答题前,考生先将自己的信息填写清楚、准确,将条形码准确粘贴在条形码粘贴处。
2.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效。
3.答题时请按要求用笔,保持卡面清洁,不要折叠,不要弄破、弄皱,不得使用涂改液、修正带、刮纸刀。考试结束后,请将本试题及答题卡交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 K 39
一.单选题(每小题3分,共30分)
1.下列有关物质的性质与用途具有对应关系的是(▲)
A.NH3易液化,可用作制冷剂
B.晶体硅的硬度大,可用于制作光电板
C.FeCl3具有氧化性,可用于自来水的杀菌消毒
D.溴化银具有感光性,可用于人工降雨
2.下列说法错误的是(▲)
A.所有非金属元素都分布在p区
B.同一原子中,2p、3p、4p电子的能量依次增大
C.元素周期表中从第ⅢB族到第ⅡB族的10个纵列的元素都是金属元素
D.N能层中有4s、4p、4d、4f四个能级,共16个轨道,可容纳32种运动状态的电子
3.以下化学用语正确的是(▲)
A.乙烯的结构简式: CH2CH2 B.乙炔的最简式: CH
C.四氯化碳的电子式 D.丁烯的比例模型
4.我国古代四大发明之一黑火药的爆炸反应为:。设为阿伏加德罗常数的值,下列说法正确的是(▲)
A.含键数目为 B.每生成转移电子数目为
C.晶体中含离子数目为 D.溶液中含数目为
5.有机物的名称正确的是(▲)
A.3﹣甲基己烷 B.2﹣乙基戊烷
C.4﹣甲基己烷 D.4﹣乙基戊烷
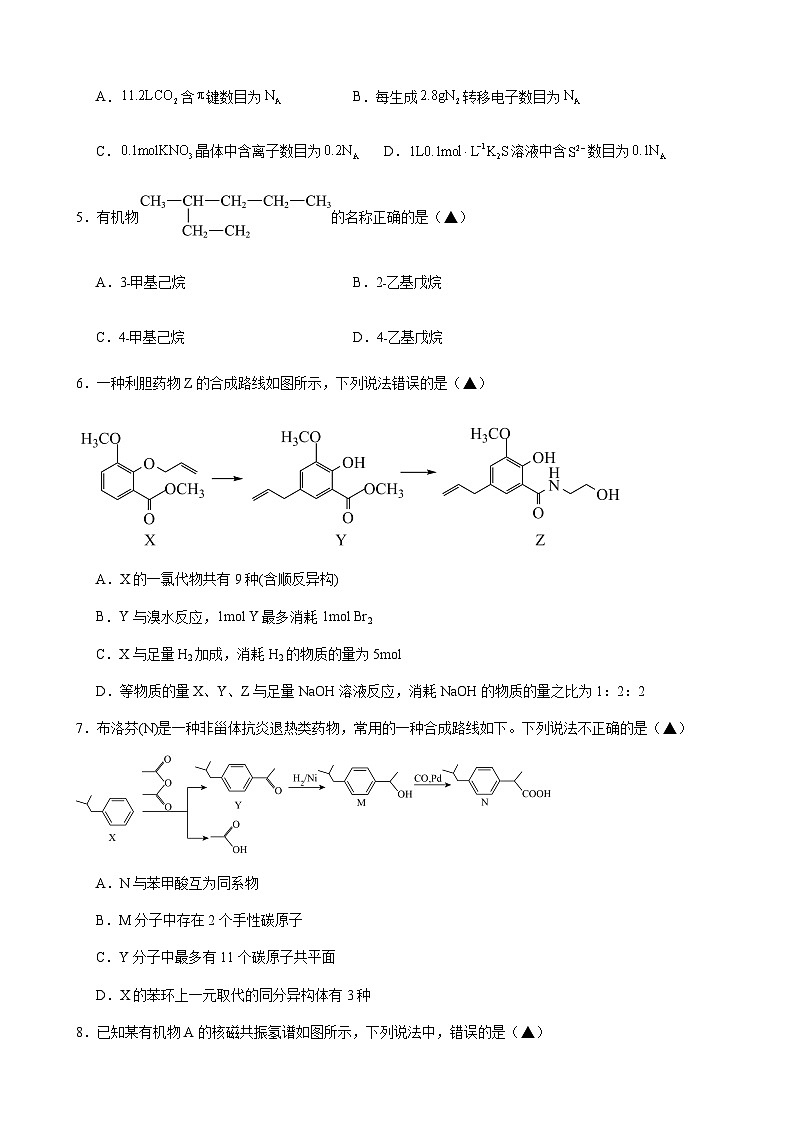
6.一种利胆药物Z的合成路线如图所示,下列说法错误的是(▲)
A.X的一氯代物共有9种(含顺反异构)
B.Y与溴水反应,1mol Y最多消耗1mol Br2
C.X与足量H2加成,消耗H2的物质的量为5mol
D.等物质的量X、Y、Z与足量NaOH溶液反应,消耗NaOH的物质的量之比为1:2:2
7.布洛芬(N)是一种非甾体抗炎退热类药物,常用的一种合成路线如下。下列说法不正确的是(▲)
A.N与苯甲酸互为同系物
B.M分子中存在2个手性碳原子
C.Y分子中最多有11个碳原子共平面
D.X的苯环上一元取代的同分异构体有3种
8.已知某有机物A的核磁共振氢谱如图所示,下列说法中,错误的是(▲)
A.若A的分子式为C3H6O2,则其结构简式可能为CH3COCH2OH
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1:2:3
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C3H6O2,则其可能的结构有2种
9.下列实验操作、现象和结论(或解释),均正确的是(▲)
选项
操作
现象
结论(或解释)
A
向饱和碳酸钠溶液中滴加过量的盐酸
有气泡产生
氯的电负性比碳大
B
一定条件下,向不同浓度、相同体积的硫代硫酸钠溶液中同时滴加等体积相同浓度的过量稀硫酸
均产生沉淀,浓度大的溶液沉淀速率快
当其他条件相同时,硫代硫酸钠溶液浓度越大,反应速率越快
C
将pH试纸置于某无色溶液中,一会取出
未见蓝色
该溶液一定呈酸性
D
将少量溶液滴入过量的氨水中
无沉淀生成
二者不反应
A.A B.B C.C D.D
10.黑矾的结构如图。下列说法错误的是(▲)
A.可表示为
B.和中的S均为杂化
C.中与的作用力类型分别是配位键、氢键、氢键
D.中所有水分子的夹角完全相同
二、不定项选择题(每题有一个或多个选项,每题4分,共20分)
11.下列说法中不正确的是(▲)
A.乙烯与苯都能使溴水褪色,但褪色原理不同
B.乙烯与完全加成,然后与发生取代反应,共消耗氯气
C.溴水遇到乙醛溶液出现褪色现象,是因为它们发生了加成反应
D. 与 互为同分异构体
12.桥环化合物是指化合物中的任意两个环共用两个不直接相连的碳原子的环烃,二环[1.1.0]丁烷()是最简单的一种桥环有机物。下列关于该化合物的说法正确的是(▲)
A.其同分异构体中呈环状的只有环丁烯()
B.构成该化合物的所有原子不可能处于同一平面上
C.二环[1.1.0]丁烷和甲烷互为同系物
D.二环[1.1.0]丁烷的二溴代物有4种(不考虑立体异构)
13.药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4-环己二酮单乙二醇缩酮)为原料合成(如图)。下列说法中正确的是的(▲)
A.可用FeCl3溶液检验此反应中是否有Z生成
B.X和Y生成Z的反应属于加成反应
C.1molZ与NaOH溶液反应,最多消耗3molNaOH
D.X中最多有9个碳原子共面
14.某水性钠离子电池电极材料由、、、组成,其立方晶胞嵌入和嵌出过程中,与含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图所示。
下列说法正确的是(▲)
A.格林绿的化学式为 B.普鲁士蓝的导电能力小于普鲁士白
C.普鲁士蓝中与个数比为1∶2 D.普鲁士白中Fe元素全部以形式存在
15.葫芦脲家族分子是一种具有空腔的桶状大杯、两端开口的超分子主体,可以很好地包结有机分子、阳离子和其他客体分子,在分子识别、药物载体等方面有广泛应用。葫芦脲(结构如图乙)可由A( )和B(CH2O)在一定条件下合成。下列说法不正确的是(▲)
A.A分子中含有两个手性碳原子
B.合成葫芦脲发生的反应是缩合反应
C.B物质可发生氧化反应、还原反应、加成反应
D.葫芦脲中空腔端口的羰基以配位键、氢键与其他客体分子形成超分子
三、填空题(共50分)
16.(10分)回答下列问题:
(1)有下列几组物质,请将序号填入下列空格内:
A.CH2=CH-COOH和油酸(C17H33COOH) B.12C60和石墨 C.乙醇和乙二醇 D.35Cl和37Cl E. 和
①互为同位素的是 ▲ 。
②互为同分异构体的是 ▲ 。
③互为同素异形体的是 ▲ 。
④互为同系物的是 ▲ 。
(2)中含有的官能团的名称为 ▲ 。
(3)的系统命名是 ▲ 。
(4)有机物(CH3)3CCH2CH(C2H5)CH3系统命名为 ▲ 。
(5)写出丙烯一定条件下发生加成聚合的反应方程式 ▲ 。
17.(15分)1,2-二氯乙烷是杀菌剂稻瘟灵和植物生长调节剂矮壮素的中间体。它不溶于水,易溶于有机溶剂,沸点83.6℃。在光照下易分解,碱性条件下易水解。化学家们提出了“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置图如下:
已知:;甘油的沸点为290℃。
请回答以下问题:
(1)仪器A的名称是 ▲ 。
(2)①装置Ⅵ中水的作用是 ▲ 。
②Ⅳ中反应前先加入少量1,2-二氯乙烷液体,其作用是 ▲ (填序号)。
a.溶解和乙烯 b.作催化剂 c.促进气体反应物间的接触
③写出装置Ⅳ中发生的化学反应方程式 ▲ ,反应类型为 ▲ 。
(3)VII装置中采用甘油浴加热,该加热方式的优点是 ▲ (写出两点)。
(4)已知液相直接氯化法可生成1,2-二氯乙烷的同系物。满足分子式的同分异构体有 ▲ 种;写出其中符合以下条件的同分异构体的结构简式 ▲ 。
①核磁共振氢谱图有3组峰
②峰面积之比为1∶3∶4
(5)产品纯度的测定:量取5.0mL逐出和乙烯后的产品,产品密度为1.2g/mL,加足量NaOH稀溶液,加热充分反应:。所得溶液先用稀硝酸中和至酸性,然后加入1.0000mol/L的标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的纯度为 ▲ %。
18.(14分)FeS是一种黑色固体,常用作固体润滑剂、废水处理剂等。可通过高温合成法和均相沉淀法合成纳米FeS。
Ⅰ.高温合成法
称取一定质量还原铁粉和淡黄色硫粉,充分混合后置于真空密闭石英管中。用酒精喷灯加热。加热过程中硫粉升华成硫蒸气。持续加热至反应完全,冷却,得纳米FeS。
已知:S8蒸气为橙色,S6蒸气为红棕色。
(1)若用等质量的S8和S6分别与足量铁粉反应制取FeS,消耗Fe的质量比为 ▲ 。
(2)能说明反应已进行完全的标志是 ▲ 。
Ⅱ.均相沉淀法
实验室以硫酸亚铁铵 []和硫代乙酰胺(CH3CSNH2)为主要原料合成纳米硫化亚铁的装置和流程如图所示。
已知:硫代乙酰胺在酸性和碱性条件下均能水解。水解方程式如下所示:
(3)实验前通N2排尽装置中空气的目的是 ▲ ;装混合液的仪器名称是 ▲ 。
(4)“反应”时,控制混合液pH约为9,温度为70℃。硫酸亚铁铵溶液和硫代乙酰胺溶液恰好反应时总反应的离子方程式为 ▲ 。
(5)该方法得到的产品中常混有少量的沉淀,实验时可向混合液中加入少量某种试剂降低,在反应中再缓慢释放,从而抑制的形成。这种试剂是 ▲ (填序号)。
A.H2O B.柠檬酸钠() C. D.Na2CO3
(6)已知硫酸亚铁铵[]为浅绿色晶体,易溶于水,不溶于乙醇。下表中列出了不同温度下硫酸铵、七水合硫酸亚铁、硫酸亚铁铵在水中的溶解度。
温度/℃
溶解/g
物质
10
20
30
40
50
70
73.0
75.4
78.0
81.0
84.5
91.9
40.0
48.0
60.0
73.3
—
—
18.1
21.2
24.5
27.9
31.3
38.5
请补充完整实验室制取硫酸亚铁铵晶体的实验过程:取4.0g充分洗净的铁屑,加 ▲ ,水浴加热并不断搅拌,至不再产生气体,趁热过滤,洗涤、烘干,得未反应铁屑1.2g。向滤液中加入 ▲ ,加热浓缩至出现晶膜为止,将溶液静置、冷却结晶、过滤,用 ▲ ,低温烘干,得到硫酸亚铁铵晶体。[可选用的实验试剂有:晶体、溶液、蒸馏水、无水乙醇]
19.(11分)某中间体Ⅰ的合成路线如图所示。
回答下列问题:
(1)A属于醛类,根据系统名法其名称为 ▲ ;Ⅰ中含氧官能团的名称为 ▲ ;D→E的反应类型为 ▲ 。
(2)E→F的化学方程式为 ▲ ;H的结构简式为 ▲ 。
(3)G的同分异构体中,符合下列条件的有 ▲ 种(不考虑立体异构);
①含有苯环且苯环上有3个取代基 ②1mol该物质最多能与2molNaOH反应
其中核磁共振氢谱有四组峰,且峰面积之比为的结构简式为 ▲ (任写一种)。
(4)根据上述信息,写出以和为主要原料制备的合成路线 ▲ 。1.A
A. NH3液化需要吸热,所以可用作制冷剂,故A正确;B.因为晶体硅是半导体,可用于制作光电板,故B错;C. FeCl3溶液能发生水解,生成氢氧化铁胶体净水,而不是用于自来水的杀菌消毒。故C错。D. 溴化银具有感光性,可用于照相底片感光材料,AgI用于人工降雨。故D错;本题答案:A。
2.A
A.H元素位于s区,A错误;
B.能级符号相同,能层越大,能量越高,B正确;
C.从ⅢB族到ⅡB族十个纵列的元素为过渡元素,都是金属元素,C正确;
D.N能层中有4s、4p、4d、4f四个能级,s能级1个轨道,p能级3个轨道,d能级5个轨道,f能级7个轨道,共16个轨道,每个轨道最多容纳2个电子,可容纳32种运动状态的电子,D正确;
故答案为:A。
3.B
A、乙烯的结构简式为CH2=CH2,结构式中碳碳双键、碳碳三键等官能团不能省略,故A错误.
B、乙炔的分子式C2H2最简式: CH,故B正确;
C、四氯化碳的电子式为 ,故C错误;
D、丁烯的球棍模型 ,比例模型只有相应大小的球,而没有键,故D错误.
故选B.
4.C
A.分子含有2个π键,题中没有说是标况条件下,气体摩尔体积未知,无法计算π键个数,A项错误;
B.2.8g的物质的量,1mol生成转移的电子数为12,则0.1mol转移的电子数为1.2,B项错误;
C.0.1mol晶体含有离子为、,含有离子数目为0.2,C项正确;
D.因为水解使溶液中的数目小于0.1,D项错误;
答案选C。
5.A
有机物的主链为最长的链,为,因此名称为3﹣甲基己烷,故A正确。
综上所述,答案为A。
6.C
A.根据X的结构简式,该有机物上有8种不同环境的氢原子,氯原子取代碳碳双键中“CH2”上的H原子时存在顺反异构,因此一氯代物共有9种,故A说法正确;
B.根据Y的结构简式,能与溴水反应的官能团是碳碳双键,1molY中含有1mol碳碳双键,最多消耗1molBr2,故B说法正确;
C.X中能与H2发生反应的是苯环和碳碳双键,1molX最多消耗4mol氢气,故C说法错误;
D.X中能与NaOH反应的酯基,Y中能与NaOH反应的酯基和酚羟基,Z中能与NaoH反应的酚羟基和酰胺键,因此等物质的量与NaOH反应,消耗NaOH物质的量之比为1∶2∶2,故D说法正确;
答案为C。
7.B
A.由题干N的结构简式可知,N中含有苯环和羧基,其余烃基均为饱和烃基,故其与苯甲酸结构相似,组成上相差6个CH2,故互为同系物,A正确;
B.同时连有4个互不相同的原子或原子团的碳原子为手性碳原子,结合题干信息M的结构简式可知,M分子中存在1个手性碳原子即连有羟基的碳原子,B错误;
C.由图干图示信息,Y的结构中含有苯环和酮羰基平面结构,根据单键可以任意旋转可知,Y分子中最多有11个碳原子(除同时连有2个甲基的碳原子只能最多一个碳原子与之共面)共平面,C正确;
D.由图干图示信息,X的苯环上一元取代的同分异构体有邻、间、对3种,D正确;
故答案为:B。
8.D
A.若A的分子式为C3H6O2,核磁共振氢谱中有3个峰,且强度比为3∶2∶1,有3种H原子,且H原子数目依次为3、2、1,CH3COCH2OH有3种H原子,且H原子数目依次为3∶2∶1满足题意,故A正确;
B.根据核磁共振氢谱,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1∶2∶3,故B正确;
C.核磁共振氢谱能确定H原子的种类和H原子的数目比,仅由其核磁共振氢谱无法得知其分子中的氢原子总数,故C正确;
D.若A的化学式为C3H6O2,有3种化学环境不同的H原子,且不同化学环境的H原子数目为3、2、1,可能的链状结构有:CH3CH2COOH、HCOOCH2CH3、CH3COCH2OH,故不止2种,故D错误;
故选:D。
9.B
A.元素的非金属性越强,电负性越大,元素的非金属性强弱与氢化物的酸性强弱无关,则盐酸的酸性强于碳酸,不能用于比较氯元素和碳元素的非金属性强弱,不能用于比较电负性的大小,故A错误;
B.一定条件下,向不同浓度、相同体积的硫代硫酸钠溶液中同时滴加等体积相同浓度的过量稀硫酸,均产生沉淀,浓度大的溶液沉淀速率快说明当其他条件相同时,硫代硫酸钠溶液浓度越大,反应速率越快,故B正确;
C.用pH试纸测定溶液pH时,不能将试纸插入溶液中,应将溶液滴在放在表面皿的pH试纸上,且次氯酸钠溶液具有强氧化性,会能使有机色质漂白褪色,不能用pH试纸测定溶液的pH,故C错误;
D.将少量硫酸铜溶液滴入过量的氨水中发生的反应为硫酸铜溶液与过量的氨水反应生成硫酸四氨合铜和水,没有氢氧化铜沉淀生成,故D错误;
故选B。
10.D
A.Fe2+的价层电子对排布式为3d6,可以与6个H2O形成配位键,因此可表示为,A正确;
B.价层电子对数=σ+中心原子孤电子对,:3+1=4,:4+0=4,和中的S均为杂化,B正确;
C.Fe2+的价层电子对排布式为3d6,可以与6个H2O形成配位键,氢原子和F、O、N相连可以形成氢键,H2O和H2O、均可以形成分子间氢键,C正确;
D.结晶水中的为109°28’,而与Fe2+形成配位键的H2O,由于空间结构的影响键角会变小,D错误;
故选D。
11.CD
A.乙烯与溴水发生加成反应使溴水褪色,苯能萃取溴水中的溴使溴水褪色,褪色原理不同,A正确;
B.1mol乙烯与1mol Cl2加成得到1mol1,2-二氯乙烷,含4mol氢原子,完全取代需要消耗4molCl2,共消耗5molCl2,B正确;
C.溴水遇到乙醛溶液出现褪色现象,是因为溴水将乙醛氧化,发生了氧化反应,C错误;
D.甲烷是正四面体结构,故D中所给两个分子是同种物质,D错误;
故选CD。
12.BD
A.该化合物对应的呈环状的同分异构体可为三元环或四元环,呈环状的不只有环丁烯,A项错误;
B.该分子中含有饱和碳原子,具有甲烷的结构特征,则所有原子不可能处于同一平面上,B项正确;
C.二环[1.1.0]丁烷的分子式为,不满足烷烃的通式CnH2n+2,其与甲烷不互为同系物,C项错误;
D.二环[1.1.0]丁烷有2种等效氢,其二溴代物有4种,D项正确。
故选BD。
13.CD
A.X、Z分子中均含酚羟基,不能用FeCl3溶液检验此反应中是否有Z生成,A错误;
B.该反应中不存在碳碳不饱和键的断裂,故该反应不是加成反应,B错误;
C.Z分子中含一个酯基,2个酚羟基,因此1molZ与NaOH溶液反应,最多消耗3molNaOH,C正确;
D.X含有苯环和碳碳双键,为平面形结构,与苯环、碳碳双键直接相连的原子在同一个平面上,则X中最多有9个碳原子共面,如图所示,D正确;
答案选CD。
14.AB
A.普鲁士蓝与格林绿相比,晶胞中多了4个Na+,Fe3+、CN−个数比为8:24=1:3,格林绿的化学式为 Fe(CN)3,故A正确;
B.1个普鲁士白晶胞中含有8个Na+,比普鲁士蓝和格林绿都多,Na+嵌入越多导电性能越好,所以普鲁士蓝的导电能力小于普鲁士白,故B正确;
C.将普鲁士蓝晶胞分为8个小立方体,CN−位于小立方体的棱心上,普鲁士蓝晶胞中CN−个数为3×8=24,Fe2+位于晶胞棱心和体心,个数为4,Fe3+位于顶点和面心,Fe3+个数4,Fe2+与Fe3+个数比为1:1,故C错误;
D.普鲁士白和普鲁士蓝相比,晶胞中多了4个Na+,普鲁士白中Na+、Fe离子、CN−个数比为8:8:24=1:1:3,化学式为 NaFe(CN)3 ,故铁元素不可能为Fe3+ ,故D错误;
故选AB。
15.A
A.已知同时连有四个互不相同的原子或原子团的碳原子为手性碳原子,故A分子中不含手性碳原子,A错误;
B.由题干信息可知,葫芦脲(结构如图乙)可由A( )和B()在一定条件下合成,故合成葫芦脲发生类似与合成酚醛树脂的反应,该反应是缩合反应,B正确;
C.B物质CH2O即HCHO含有醛基,可发生氧化反应,也能和H2发生加成反应(同时也属于还原反应),C正确;
D.葫芦[n]脲中空腔端口的羰基氧含有孤电子对且电负性较大,能形成配位键和氢键,所以葫芦[n]脲中空腔端口的羰基以配位键、氢键与其他客体分子形成超分子,D正确;
故答案为:A。
16.(1)D E B A
(2)羟基、酯基
(3)3-甲基-1-丁炔
(4)2,2,4-三甲基己烷
(5)nCH2=CHCH3
17.(1)分液漏斗
(2)除去乙烯中的乙醇杂质 ac 加成反应
(3)加热温度恒定、受热均匀,加热温度较高(或其他合理解释)
(4)9
(5)82.5%
18.(1)1∶1
(2)石英管中硫蒸气的颜色不变或气体变为无色
(3)防止Fe2+和CH3CSNH2(或S2−)被氧化 三颈烧瓶
(4)FeS↓+CH3COO−+3NH3↑+3H2O
(5)B
(6)适量溶液 6.6g (NH4)2SO4晶体 无水乙醇洗涤晶体
19.(1)2-甲基丙醛 酯基 酮羰基 还原反应
(2)
(3)24 或
(4)
江西省萍乡市安源区2022-2023学年高二下学期期末考试化学试题(Word版含答案): 这是一份江西省萍乡市安源区2022-2023学年高二下学期期末考试化学试题(Word版含答案),共14页。试卷主要包含了下列化学用语表示正确的是,下列离子方程式书写正确的是,能证明反应,氮化碳是一种特殊的材料等内容,欢迎下载使用。
江西省清江县2022-2023学年高一下学期期末考试化学试题(Word版含答案): 这是一份江西省清江县2022-2023学年高一下学期期末考试化学试题(Word版含答案),共14页。试卷主要包含了02 ×1023等内容,欢迎下载使用。
江西省赣州市龙南区2022-2023学年高二下学期期末考试化学试题(Word版含答案): 这是一份江西省赣州市龙南区2022-2023学年高二下学期期末考试化学试题(Word版含答案),共11页。试卷主要包含了下列各项中,表达正确的是,某烷烃的结构为等内容,欢迎下载使用。












