



所属成套资源:中考化学总复习高频考点必刷题(全国通用)
专题 10 溶解曲线-中考化学总复习高频考点必刷题(全国通用)
展开这是一份专题 10 溶解曲线-中考化学总复习高频考点必刷题(全国通用),文件包含专题10溶解曲线解析版docx、专题10溶解曲线原卷版docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
专题10 溶解曲线
一、正确理解溶解度曲线的涵义
溶解度曲线就是在直角坐标系中,用来描述物质的溶解度随温度变化而变化的曲线。根据溶解度曲线可进行溶液的配制,混合物的分离与提纯,以及进行物质结晶或溶解的计算。近年来,以溶解度曲线为切入点的题目已成为中考、竞赛命题的一个热点。下面,我们从溶解度曲线的特点入手,对溶解度作进一步的理解。
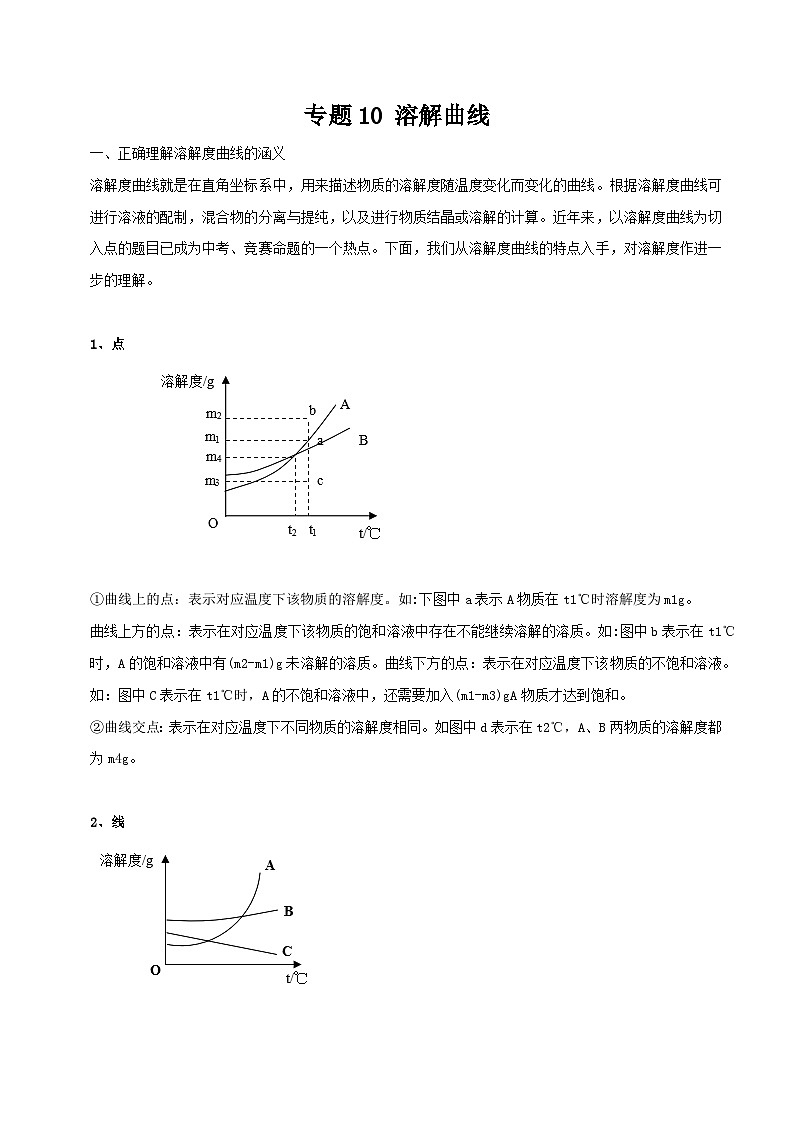
1、点
①曲线上的点:表示对应温度下该物质的溶解度。如:下图中a表示A物质在t1℃时溶解度为m1g。
曲线上方的点:表示在对应温度下该物质的饱和溶液中存在不能继续溶解的溶质。如:图中b表示在t1℃时,A的饱和溶液中有(m2-m1)g未溶解的溶质。曲线下方的点:表示在对应温度下该物质的不饱和溶液。如:图中C表示在t1℃时,A的不饱和溶液中,还需要加入(m1-m3)gA物质才达到饱和。
②曲线交点:表示在对应温度下不同物质的溶解度相同。如图中d表示在t2℃,A、B两物质的溶解度都为m4g。
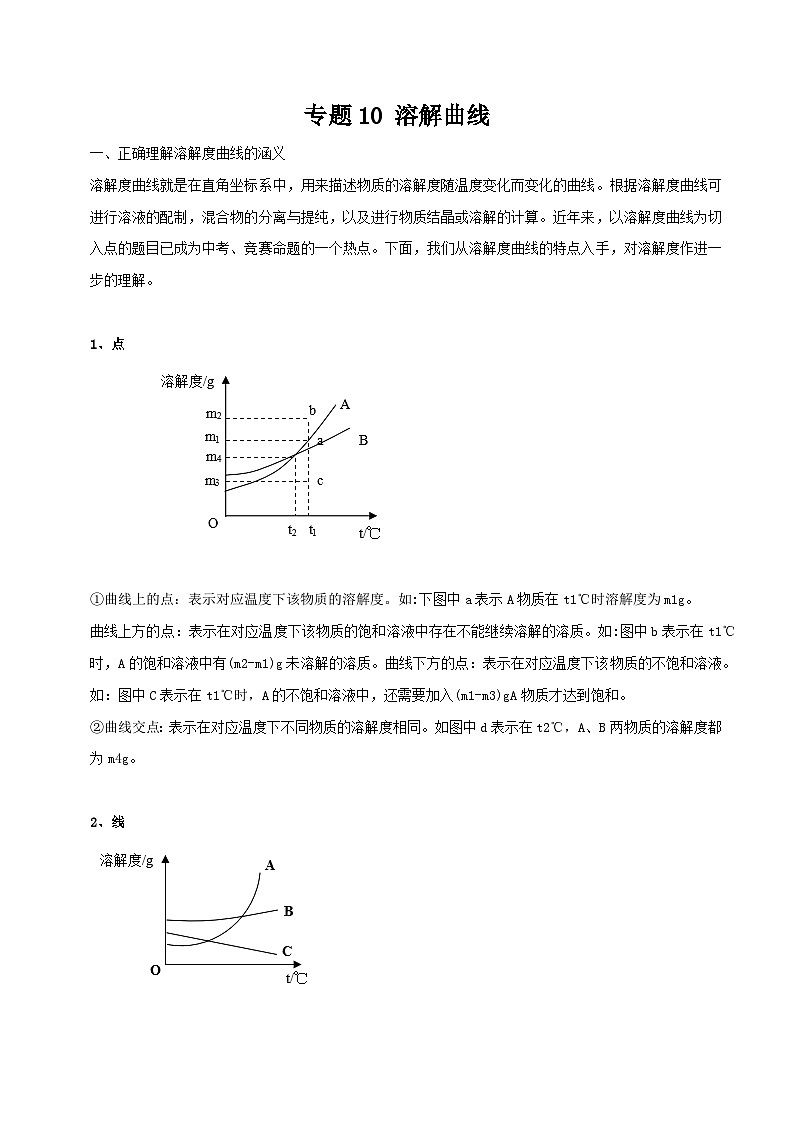
2、线
如图中A物质的溶解度随温度升高而明显增大,A曲线为“陡升型”。如KNO3等大多数固体物质。
图中B物质的溶解度随温度变化不大,B曲线为“缓升型”,如NaCl等少数固体物质。
图中C物质的溶解度随温度升高而减小,C曲线为“下降型”,如气体及Ca(OH)2等极少数固体物质。
二、掌握溶解度曲线的应用
1. 溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。
2. 可以比较在同一温度下不同物质溶解度的相对大小。
3. 根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。例如:某物质的溶解度曲线“陡”,表明该物质溶解度随温度变化明显,提纯或分离该物质时适合采用降温结晶法。某物质溶解度曲线“平缓”,提纯或分离该物质时适合采用蒸发溶剂法。
4. 从溶解度曲线上的交点,可以判断哪些物质在该点所示的温度下具有相同的溶解度。
5. 利用溶解度曲线可以确定一定质量的某物质的饱和溶液降温时析出晶体的质量。
专题训练
一.选择题(共10小题)
1.(2023•安徽模拟)如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线、结合图示判断,下列说法正确的是( )
A.甲物质溶解度大于乙物质溶解度
B.t1℃时20g乙物质投入水中一定能完全溶解
C.t1℃时,甲、乙溶液中溶质的质量分数一定相等
D.t2℃时相同质量的甲、乙饱和溶液,乙溶液中溶剂质量更大
【答案】D
【解析】A、在比较物质的溶解度必须指明温度,温度不能确定,溶解度也不能确定,故A错误;
B、t1°C时,乙物质的溶解度为20g,由于不知道水的质量,所以将20g乙物质投入水中不一定能完全溶解,故B错误;
C、t1°C时,甲、乙物质的溶解度相等,所以该温度下甲、乙的饱和溶液中溶质的质量分数一定相等,由于不知道溶液是否饱和,所以无法比较溶质质量分数,故C错误;
D、t2°C时,甲物质的溶解度大于乙物质,所以该温度下相同质量的甲、乙饱和溶液,乙溶液中溶剂质量更大,故D正确。
综上所述:选择D。
2.(2023•曲江区校级模拟)如图是a、b、c三种物质(不含结晶水)的溶解度曲线,下列错误的是( )
A.P点的含义是t1℃时,a、c两种物质的溶解度相同
B.t2℃时配成等质量a、b、c三种物质的饱和溶液,需水质量最少的物质是a
C.t1℃时25ga物质加入到100g水中,所得溶液中溶质与溶剂的质量比是1:5
D.t1℃时,将a、b、c三种物质的等质量的饱和溶液升温至t2℃,溶质质量分数大小关系是:b>a=c
【答案】D
【解析】A、P点是a、c两种物质的溶解度曲线的交点,所以P点的含义是:t1℃时,a、c两种物质的溶解度相同,故A正确;
B、t2℃时,三种物质溶解度由大到小为a>b>c,溶解度越大,饱和溶液溶质质量分数越大,饱和溶液质量相等,由溶质质量=溶液质量×溶质质量分数可知,溶质质量分数越大的溶液中溶质质量越大,溶解水的质量就越少,所以t2℃时配成等质量a、b、c三种物质的饱和溶液,需水质量最少的物质是a,故B正确;
C、t1℃时,a物质的溶解度为20g,所得溶液中溶质与溶剂的质量比是20g:100g=1:5,故C正确;
D、t1℃时,b物质的溶解度最大,a、c物质的溶解度相等,将a、b、c三种物质的等质量的饱和溶液升温至t2℃,a、b物质的溶解度增大,溶质、溶剂质量不变,c物质的溶解度减小,析出晶体,所以溶质质量分数大小关系是:b>a>c,故D错误。
综上所述:选择D。
3.(2022秋•巴彦县校级期末)如图为甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
A.甲物质的溶解度大于乙物质的溶解度
B.甲中含有少量的乙,可以用蒸发溶剂的方法提纯甲
C.t1℃时,等质量的甲、乙饱和溶液中含有等质量的水
D.t2℃时,将等质量的甲、乙两种物质的溶液分别降温至t1℃,析出晶体的质量甲一定大于乙
【答案】C
【解析】A、比较物质的溶解度,需要在一定的温度下比较,故A错误;
B、由于甲的溶解度随温度的升高而明显增大,而乙的溶解度受温度的影响很小,因此甲中含有少量的乙,可用降温结晶的方法提纯甲,故B错误;
C、t1℃时,甲、乙的溶解度相同,相同质量的甲、乙饱和溶液中溶解的甲、乙的质量相同,甲、乙饱和溶液中含有水的质量相同,故C正确;
D、t2℃时,将等质量的甲、乙两种物质的溶液分别降温至t1℃,溶液状态不能确定,所以析出晶体的质量也不能确定,故D错误。
综上所述:选择C。
4.(2022秋•曲阜市期末)结合KNO3和NH4C1的溶解度曲线判断,下列叙述正确的是(
A.t2℃时,两种物质的溶解度相等
B.两种物质的溶解度都随温度升高而增大
C.升高温度可将接近饱和的KNO3溶液变成饱和溶液
D.将t2℃的饱和NH4C1溶液降温到t1℃,溶液质量不变
【答案】B
【解析】A、t2℃时,硝酸钾的溶解度大于氯化铵的溶解度,故A错;
B、由溶解度曲线可知:两种物质的溶解度都随温度升高而增大,故B正确;
C、降低温度可将接近饱和的KNO3溶液变成饱和溶液,故C错;
D、将t2℃的饱和NH4C1溶液降温到t1℃,溶解度变小,析出晶体,溶液质量减小,故D错。
综上所述:选择B。
5.(2022秋•大城县期末)如图是甲和乙两种物质(不含结晶水)的溶解度曲线。下列说法正确的是( )
A.t1℃时,甲和乙的溶解度相等
B.图中阴影部分表示的甲和乙两溶液都是饱和溶液
C.t2℃时,甲饱和溶液的溶质质量分数为60%
D.将t2℃时乙的饱和溶液降温至t1℃,变为不饱和溶液
【答案】A
【解析】A、t1℃时,两条溶解度曲线相交于一点,故该温度下甲和乙的溶解度相等,正确;
B、图中阴影部分中的点在甲曲线的上部,是甲的饱和溶液,在乙曲线的下部,是乙的不饱和溶液,错误;
C、t2℃时,甲的溶解度为60g,则甲饱和溶液的溶质质量分数为:×100%=37.5%,错误;
D、乙的溶解度随温度的降低而降低,所以将t2℃时乙的饱和溶液降温至t1℃,有晶体析出,依然为饱和溶液,错误;
综上所述:选择A。
6.(2023•市南区校级开学)NaCl、KCl、MgCl2的溶解度曲线如图所示。下列叙述正确的是( )
A.将NaCl、KCl的饱和溶液从80℃降到t℃,析出NaCl的质量大
B.t℃时,NaCl和KCl的溶解度相同
C.t℃时,KCl饱和溶液的质量分数为40%
D.NaCl中含有少量MgCl2,可以采用降温结晶的方法提纯NaCl
【答案】B
【解析】A、氯化钠和氯化钾的溶解度均随温度的降低而降低,降温后其饱和溶液都有晶体析出,但不知道溶液质量的多少,以无法确定析出晶体质量的多少,故选项说法错误。
B、t℃时,NaCl和KCl的溶解度曲线相交于一点,则两物质该温度时溶解度相同,故选项说法正确。
C、t℃时,氯化钾的溶解度为40g,KCl饱和溶液的质量分数为×100%≈28.6%,故选项说法错误。
D、氯化钠和氯化镁的溶解度均随温度的升高而增加,氯化钠的溶解度随温度变化不大,氯化镁的溶解度随温度变化较大,所以氯化钠中混有少量的氯化镁,使用蒸发结晶的方法提纯氯化钠,故选项说法错误。
综上所述:选择B。
7.(2022秋•句容市校级期末)20℃时,将等质量的甲、乙固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2(不考虑水分蒸发),甲、乙固体的溶解度曲线如图3。下列说法正确的是( )
A.图1中乙溶液一定不饱和
B.图2中两溶液中溶质质量分数一定相等
C.图3中M表示乙的溶解度曲线
D.图2中两溶液降温至30℃时溶质质量分数乙>甲
【答案】B
【解析】A、图1中乙溶液中的固体完全溶解,该溶液可能为饱和溶液,也可能为不饱和溶液,故A错误;
B、由于将等质量的甲、乙完全溶解于等质量水中,且固体都完全溶解,则两溶液中溶质质量分数一定相等,故B正确;
C、20℃时,将等质量的甲、乙加入等质量的水中,有部分甲固体没有完全溶解,而该温度下,M的溶解度小于N,则M对应的为甲,故C错误;
D、根据图3可知两种物质的溶解度都随温度升高而增大,因此30℃时,甲、乙的溶解度都比20℃时大,且30℃时两物质的溶解度相等;再根据图1中信息可以知道20℃时乙中没有晶体析出,因此30℃时乙中一定也无晶体析出,因此图2中两溶液降温至30℃一定都不会析出晶体,则它们的溶质质量分数相等,故D错误。
综上所述:选择B。
8.(2022•高邮市校级二模)NH4Cl和Na2SO4的溶解度曲线如下。下列说法不正确的是( )
A.t1℃时NH4Cl与Na2SO4的溶解度相等
B.t2℃的Na2SO4饱和溶液升温至t3℃,有晶体析出
C.NH4Cl饱和溶液从t1℃升温至t3℃,溶质质量分数不变
D.若需将t1℃下NH4Cl和Na2SO4的饱和溶液转变为t3℃时的饱和溶液,可以采取分别向两种溶液中加入等质量溶质的方式
【答案】D
【解析】A、t1℃时NH4Cl与Na2SO4的溶解度相等正确,正确但不符合题意,故选项错误;
B、t2℃的Na2SO4饱和溶液升温至t3℃,有晶体析出正确,因为在该温度的范围中,硫酸钠的溶解度随温度的升高而减小,正确但不符合题意,故选项错误;
C、NH4Cl饱和溶液从t1℃升温至t3℃,溶质质量分数不变正确,正确但不符合题意,故选项错误;
D、若需将t1℃下NH4Cl和Na2SO4的饱和溶液转变为t3℃时的饱和溶液,可以采取分别向两种溶液中加入等质量溶质的方式错误,因为没有指明溶液的质量,错误符合题意,故选项正确;
综上所述:选择D。
9.(2022•镇江)如图为Na2CO3和NH4HCO3的溶解度曲线。下列说法正确的是( )
A.T3℃时,将30gNa2CO3固体加到50g水中,所得溶液的溶质质量分数为37.5%
B.将Na2CO3饱和溶液从T2℃升温到T4℃,溶质质量分数变大
C.将100gNH4HCO3饱和溶液从T4℃降温到T1℃,析出20gNH4HCO3晶体
D.将等质量的两物质饱和溶液从T1℃升温到T4℃,为使溶液恰好饱和,加入两固体质量相等
【答案】D
【解析】A、T3℃时,Na2CO3的溶解度是50g,即T3℃时100g水中最多溶解50gNa2CO3,那么50g水中最多溶解25gNa2CO3,将30gNa2CO3固体加到50g水中,只能溶解25g,所得溶液的溶质质量分数为:×100%=33.3%,故选项错误。
B、将Na2CO3饱和溶液从T2℃升温到T4℃,因为T2℃和T4℃时Na2CO3的溶解度相等,所以T4℃时还是饱和状态,溶质质量分数不变,故选项错误。
C、设T4℃时100gNH4HCO3饱和溶液中NH4HCO3质量为x,则=,解得x=29.6g,则水的质量为100g﹣29.6g=70.4g;T1℃时70.4g水中溶解NH4HCO3的质量为=15.5g,所以将100gNH4HCO3饱和溶液从T4℃降温到T1℃,析出29.6g﹣15.5g=14.1gNH4HCO3晶体,故选项错误。
D、将等质量的两物质饱和溶液从T1℃升温到T4℃,因为T1℃和T4℃是两物质的溶解度相等,所以为使溶液恰好饱和,加入两固体质量相等,故选项正确。
综上所述:选择D。
10.(2022•鼓楼区校级模拟)如图是Ca(OH)2的溶解度曲线,下列说法正确的是( )
A.将b点的溶液从70℃降温到30℃,有固体析出
B.将a点的溶液从30℃升温到70℃时溶质的质量分数变小
C.70℃时,饱和石灰水中溶质和溶液的质量比为0.1:100
D.30℃时,向50g水中加入0.15g Ca(OH)2后充分搅拌,可得到50.15g溶液
【答案】B
【解析】A、将b点的溶液从70℃降温到30℃,有固体析出错误,因为饱和溶液会变成不饱和溶液;故选项错误;
B、将a点的溶液从30℃升温到70℃时溶质的质量分数变小正确,因为有晶体析出;故选项正确;
C、70℃时,饱和石灰水中溶质和溶液的质量比=0.1:100.1,0.1:100错误;故选项错误;
D、30℃时,氢氧化钙的溶解度是0.15g,向50g水中加入0.15gCa(OH)2后充分搅拌,可得到饱和溶液的质量=0.075g+50g=50.075g,可得到50.15g溶液错误;故选项错误;
综上所述:选择B。
二.填空题(共10小题)
11.(2023•曲江区校级模拟)下列是KNO3和NaCl在不同温度时的溶解度表及溶解度曲线。
温度/℃
20
30
40
50
60
70
溶解度/g
KNO3
31.6
45.8
63.9
85.5
110
138
NaCl
36.0
36.3
36.6
37.0
37.3
37.8
(1)图中表示NaCl溶解度曲线的是 (填“A”或“B”)。
(2)20℃时,向盛有40gNaCl的烧杯中加入100g水,搅拌,充分溶解后,溶液的溶质质量分数为 (只列出计算表达式)。
(3)30℃时,向各盛有100g水的两个烧杯中,分别加入50gKNO3和50gNaCl,所得KNO3溶液的质量
(填“>”、“<”或“=”)NaCl溶液的质量。
(4)由表中数据分析可知,在某一温度时NaCl和KNO3具有相同的溶解度mg,则m的取值范围是 。
【答案】(1)B;
(2);
(3)>;
(4)36.0≤m≤36.3。
【解析】(1)根据溶解度表中数据可知,氯化钠的溶解度受温度变化的影响比硝酸钾小,所以图中表示氯化钠溶解度曲线的是B;
(2)20℃时,氯化钠的溶解度为36.0g,所以向盛有40gNaCl的烧杯中加入100g水,搅拌,充分溶解后,最多只能溶解36.0g氯化钠,所以溶液的溶质质量分数为;
(3)30℃时,氯化钠的溶解度为36.3g,硝酸钾的溶解度为45.8g,所以向各盛有100g水的两个烧杯中,分别加入50g KNO3 和50g NaCl,最多只能溶解45.8g硝酸钾,得到饱和硝酸钾溶液的质量为100g+45.8g=145.8g,最多只能溶解36.3g氯化钠,得到饱和氯化钠溶液的质量为100g+36.3g=136.3g,所以所得 KNO3溶液的质量>NaCl溶液的质量;
(4)由表中数据分析可知,当20℃时,硝酸钾的溶解度为31.6g,氯化钠的溶解度为36.0g,30℃时,硝酸钾的溶解度为45.8g,氯化钠的溶解度为36.3g,所以在20℃~30℃之间,二者的溶解度曲线有交点,在某一温度时NaCl和 KNO3 具有相同的溶解度mg,则m的取值范围是36.0≤m≤36.3。
12.(2023•曲江区校级模拟)图1为甲、乙均不含结晶水两种固体物质在水中的溶解度曲线。
(1)t1℃时,甲的溶解度 乙的溶解度(填“大于”或“小于”或“等于”)。
(2)t2℃时,50g水中溶解 g乙物质恰好达到饱和。
(3)某同学在t1℃时开始如图2实验,得到相应的溶液A、B、C。在溶液A、B、C中,属于饱和溶液的是 ;溶质质量分数最大的是 ;在溶液C中再加入25g甲后,充分搅拌,恢复到t2℃,所得溶液溶质质量分数为 。(结果精确到0.1%)
【答案】(1)等于;
(2)7.5;
(3)B;B、C;28.6%。
【解析】(1)由图可知,t1℃时甲、乙的溶解度曲线相交于一点,则t1℃时甲的溶解度等于乙的溶解度。
(2)由图可知,t2℃时乙的溶解度是15g,此时100g水中最多溶解15g乙,则t2℃时50g水中溶解7.5g乙物质恰好达到饱和。
(3)t1℃时甲的溶解度是20g,此时100g水中加入15g甲,在A中形成的是甲的不饱和溶液;向A中再加入5g甲,此时B中溶液恰好饱和;升温到t2℃时,甲的溶解度变成40g,此时溶液中含有甲物质20g,C中形成甲的不饱和溶液,则属于饱和溶液的是B。由上述分析可知,A、B、C中溶剂质量相同,溶质质量:A<B=C,则溶质质量分数最大的是B、C。在溶液C中再加入25g甲后,充分搅拌,恢复到t2℃,此时甲的溶解度为40g,100g水中最多溶解40g甲物质,所得溶液的溶质质量分数为:×100%≈28.6%。
13.(2023•天山区校级一模)溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是 (填序号)。
A.面粉
B.植物油
C.硝酸钾
(2)下列有关溶液的说法中,正确的是 (填序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液一定是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
D.稀溶液一定是不饱和溶液
(3)如图为甲、乙、丙三种固体物质的溶解度曲线。
①图中P点的含义 。
②t2℃时,甲物质的饱和溶液中溶质与溶液的质量比为 (填最简比)。
③现有t1℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t2℃,所得溶液中溶质质量分数大小关系是 (填序号)。
A.甲>乙>丙
B.甲=乙<丙
C.甲=乙>丙
④甲中含有少量丙,应用 的方法提纯甲。
【答案】(1)C;
(2)B;
(3)t1℃时,甲、乙的溶解度相等,都是30g;1:3;C;降温结晶。
【解析】(1)A、面粉不溶于水,将面粉放入水中,充分搅拌不能得到溶液,故选项不符合题意。
B、植物油不溶于水,将植物油放入水中,充分搅拌不能得到溶液,故选项不符合题意。
C、硝酸钾易溶于水,将硝酸钾放入水中,充分搅拌能得到溶液,故选项符合题意。
故选:C。
(2)A、溶液是均一、稳定的混合物,但均一的、稳定的液体不一定是溶液,比如水是均一、稳定的液体,但水不是溶液,故选项说法不正确。
B、溶液是均一、稳定的混合物,故选项说法正确。
C、溶液不一定是无色的,比如硫酸铜溶液呈蓝色,并且溶剂不一定是水,比如汽油、酒精也可以做溶剂,故选项说法不正确。
D、稀溶液是指溶液中含有的溶质少,而不饱和溶液是指在一定温度下,在一定量的溶剂里,还能再溶解某种物质的溶液,稀溶液和不饱和溶液之间没有必然联系,故稀溶液不一定是不饱和溶液,故选项说法不正确。
故选:B。
(3)①P点是曲线甲和乙的交点,则图中P点的含义是:t1℃时,甲、乙的溶解度相等,都是30g。
②t2℃时,甲物质的溶解度是50g,此时100g水中最多能溶解50g甲,则t2℃时甲物质的饱和溶液中溶质与溶液的质量比为50g:(50g+100g)=1:3。
③t1℃时甲、乙、丙三种物质的溶解度大小是:甲=乙>丙,则t1℃时甲、乙、丙三种物质的溶质质量分数的关系是:甲=乙>丙;将这三种溶液分别升温到t2℃,溶解度都增大,都变成不饱和溶液,但溶质和溶剂的质量都不变,所以溶质质量分数不变,则这三种溶液分别升温到t2℃时,溶质质量分数关系为:甲=乙>丙。
故选:C。
④甲的溶解度受温度的影响大,丙的溶解度受温度的影响小,则甲中含有少量丙,应用降温结晶方法提纯甲。
14.(2023•灞桥区校级二模)溶液在生活、生产、科研中具有广泛的用途。如图1是A、B、C三种固体物质的溶解度曲线。请回答下列问题:
(1)t1℃时,将A、B、C固体各ag分别加入100g水中,得到两种饱和溶液,则a的取值范围是 。
(2)为使图2试管中饱和C溶液变浑浊,可向烧杯中加入物质 (填字母)。
a.生石灰
b.冰块
c.氯化钠
d.浓硫酸
(3)t2℃时,向50g水中加入25g物质B配成溶液,将该溶液降温至t1℃时,其属于 (填“饱和”或“不饱和”)溶液。
(4)根据A、B、C三种物质溶解度曲线,分析下列说法正确的是 (填序号)。
①将C物质不饱和溶液变为饱和溶液,溶质的质量分数一定变大
②t2℃时,取等质量的A、B两种物质的饱和溶液分别蒸发等质量的水后,恢复到t2℃,析出晶体的质量A<B
③t3℃时,A、B、C三种物质溶解度的大小关系是A=B>C
【答案】(1)30≤a<70;
(2)ad;
(3)饱和;
(4)②③。
【解析】(1)由溶解度曲线可知,t1℃时,A、B、C三种物质的溶解度大小关系为B>A=C,则t1℃时,将A、B、C固体各ag分别加入100g水中,得到两种饱和溶液的是A和C,B是不饱和溶液,a的取值范围是:30≤a<70。
(2)图2试管中饱和C溶液变浑浊,即饱和C溶液中析出溶质晶体,由C物质的溶解度随温度升高而减小可知,溶液的温度升高。
a.生石灰是氧化钙,氧化钙和水反应放出大量热,烧杯中的水温度升高,C的溶解度减小,试管中析出晶体,故选项符合题意;
b.冰块加入水中后,冰融化吸热,导致烧杯中的水温度降低,C的溶解度增大,故选项不符合题意;
c.氯化钠溶于水温度不变,C的溶解度不变,故选项不符合题意;
d.浓硫酸遇水会放出大量热,烧杯中的水温度升高,C的溶解度减小,试管中析出晶体,故选项符合题意。
故选:ad。
(3)t1℃时,B物质的溶解度为70g,所以50g水中最多可溶解B的质量是35g,则向50g水中加入25g物质B配成的溶液属于不饱和溶液。
(4)①将C物质不饱和溶液变为饱和溶液,可采用升温的方法,升温后C的溶解度减小,若溶液中有溶质析出,则溶液中溶质质量分数会减小,故选项说法不正确;
②t2℃时,A、B两物质的溶解度大小关系为A<B,则该温度下,等质量的A、B两种物质的饱和溶液分别蒸发等质量的水后恢复到t2°C,析出晶体的质量为A<B,故选项说法正确;
③由溶解度曲线可知,t3°C时,A、B、C三种物质溶解度的大小关系是A=B>C,故选项说法正确。
故选:②③。
15.(2023•榆阳区一模)t1℃时,将a、b两种固体物质(均不含结晶水)各25g,分别加入盛有100g水的烧杯中,充分搅拌后现象如图甲所示:升温到t2℃时,忽略水分蒸发,现象如图乙所示。图丙是a、b两种固体物质在水中的溶解度曲线。
(1)图乙中b溶液的溶质质量分数为 。
(2)图丙中曲线M表示 (填“a”或“b”)物质的溶解度曲线。
(3)t1℃时,若a饱和溶液和b饱和溶液中溶质的质量相等,则溶剂的质量 (填“相等”或“不相等”)。
(4)下列分析不正确的是 (填字母)。
A.图甲中两烧杯内a、b溶液的溶质质量分数相等
B.图乙中b一定是不饱和溶液
C.由图可知x、y的关系为y<25≤x
【答案】(1)20%;(2)b;(3)相等;(4)B。
【解析】(1)由题意可知,图乙中25gb完全溶解在100g水中,则此时b溶液的溶质质量分数为:×100%=20%。
(2)升高温度,b烧杯中的固体减少,所以b物质的溶解度随温度的升高而增大,所以图丙中曲线M表示b物质的溶解度曲线。
(3)t1℃时,a、b两种固体物质溶解度相等,则t1℃时,若a饱和溶液和b饱和溶液中溶质的质量相等,则溶剂的质量也相等。
(4)A、t1℃时,a、b物质的溶解度相等,由图可知,图甲中两烧杯内a、b溶液都是饱和溶液,则溶质质量分数相等,故选项说法正确;
B、由于不知道t2℃时,b的溶解度,所以图乙中b不一定是不饱和溶液,也可能是饱和溶液,故选项说法不正确;
C、由图可知,t1℃时,100g水不能完全溶解25ga或b,说明t1℃时,a和b的溶解度小于25g,故y<25,而升温到时t2℃时,25gb全部溶解了,此时b溶液如正好饱和,则x=25,如果不饱和,则x>25,故选项说法正确。
故选:B。
16.(2022秋•河东区期末)溶液与人类生活、生产密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是 (填序号)。
A.汽油 B.面粉 C.蔗糖
(2)下列说法中正确的是 (填序号)。
A.溶液一定是无色的
B.溶液是均一的、稳定的混合物
C.凡是均一的、稳定的液体一定是溶液
(3)如图为甲、乙两种固体物质的溶解度曲线。
①t1℃时,甲的溶解度是 g;
②t2℃时,乙的接近饱和的溶液,可以通过 方法转化成饱和溶液;
③t3℃时,向20g水中加入15g甲,充分溶解后,溶液的质量为 g,溶质质量分数为 ;
④t3℃时,等质量的甲、乙饱和溶液降温到t2℃,下列说法正确的是 (填序号)。
A.t2℃时,甲溶液中溶质质量=乙溶液中溶质质量
B.t3℃时,甲溶液中溶质质量>乙溶液中溶质质量
C.t2℃时,甲溶液中溶剂质量=乙溶液中溶剂质量
D.t3℃时,甲溶液中溶剂质量>乙溶液中溶剂质量
【答案】(1)C;
(2)B;
(3)①20;②增加溶质、蒸发溶剂;③32;37.5%;④B。
【解析】(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是蔗糖;
(2)A.溶液一定是无色的错误,如硫酸铜是蓝色的;
B.溶液是均一的、稳定的混合物正确;
C.凡是均一的、稳定的液体一定是溶液错误,如水不是溶液;
(3)①t1℃时,甲的溶解度是20g;
②t2℃时,乙的接近饱和的溶液,可以通过增加溶质、蒸发溶剂方法转化成饱和溶液;
③t3℃时,甲的溶解度是60g,向20g水中加入15g甲,充分溶解后,只能溶解12g,溶液的质量=20g+12g=32g;溶质质量分数==37.5%;
④t3℃时,等质量的甲、乙饱和溶液降温到t2℃,说法正确的是:
B.t3℃时,甲溶液中溶质质量>乙溶液中溶质质量;
17.(2022秋•高阳县校级期末)图中A、B、C分别表示三种不同的固体物质(不含结晶水),其溶解度曲线如图1所示。请回答下列问题:
(1)t1℃时,100g 水中最多溶解固体A g,t2℃时,三种固体物质溶解度由小到大的顺序是 。写出一种将固体B的不饱和溶液转化为饱和溶液的方法 。
(2)t1℃时,将30g固体C加到50g水中,充分搅拌后所得溶液的质量为 g。
(3)t2℃时分别将A、B、C的饱和溶液降温到t1℃,其质量分数由小到大的顺序是 。
(4)某化学小组欲从含有少量B的A样品中,提纯A固体。可采用的提纯方法是 (填“降温结晶”或“蒸发结晶”)。
【答案】(1)25;C<B<A;增加溶质或蒸发溶剂或降低温度;
(2)62.5;
(3)C<A<B;
(4)降温结晶;
【解析】(1)t1℃时,100g水中最多溶解固体A 25g,t2℃时,三种固体物质溶解度由小到大的顺序是C<B<A;将固体B的不饱和溶液转化为饱和溶液的方法:增加溶质、蒸发溶剂、降低温度;故答案为:25;C<B<A;增加溶质或蒸发溶剂或降低温度;
(2)t1℃时,C的溶解度是25g,将30g固体C加到50g水中,充分搅拌后所得溶液的质量=12.5g+50g=62.5g;故答案为:62.5;
(3)t2℃时分别将A、B、C的饱和溶液降温到t1℃,其质量分数由小到大的顺序是:C<A<B,因为降温后B的溶解度大于A,C的质量分数不变,还是最小;故答案为:C<A<B;
(4)某化学小组欲从含有少量B的A样品中,提纯A固体。可采用的提纯方法是:降温结晶,因为A的溶解度受温度的影响变化比较大;故答案为:降温结晶;
18.(2022•都安县校级模拟)t2℃时,将甲,乙各80g分别放到盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图。甲和乙的溶解度曲线如图。请结合图示回答下列问题:
(1)固体甲对应的溶解度曲线是 (填“a”或“b”)。
(2)a中含有少量b,可用 (填“降温结晶”或“蒸发结晶”)的方法提纯a。
(3)将t2℃等质量的甲、乙饱和溶液分别降温到t1℃时,所得溶液变成不饱和的是 (填“甲”或“乙”),所得溶液中溶剂的关系是甲 乙(填“>”或“<”或“=”)。
(4)t1℃时,将165g甲的饱和溶液稀释成20%的溶液,需加水 g。
【答案】(1)a;
(2)降温结晶;
(3)乙;<;
(4)160。
【解析】(1)由溶解度曲线可知,t2℃时,a的溶解度大于80g,b的溶解度小于80g,将80g固体a,b分别加入100g水中,a完全溶解,b部分溶解,甲中的固体全部溶解,故甲对应的曲线是a;故答案为:a;
(2)a的溶解度随温度的降低而减小,b的溶解度随温度的降低而增大,降低温度,a析出,b不析出,可采用降温结晶的方法将a分离出来;故答案为:降温结晶;
(3)温度降低,甲的溶解度减小,乙的溶解度增大,降温后,物质甲析出,溶液甲仍为饱和溶液,乙溶液变为不饱和溶液;降温前后,溶剂的质量没有变化,故判断原溶液中溶剂质量的关系即可,根据溶液质量=溶剂质量+溶质质量,溶液质量相等,溶质质量越大,溶剂质量越小,t2℃时,甲中溶质质量大于乙中溶质质量,故甲中溶剂质量小于乙中溶剂质量;故答案为:乙;<;
(4)设加水的质量为x,根据稀释前后,溶质的质量不变列出方程:165g×(×100%)=(165g+x)×20%,x=160g;故答案为:160。
19.(2022•蓝山县模拟)氯化铵、硫酸钠两种物质的溶解度曲线如图所示,回答下列问题:
(1)在20℃~35℃,氯化铵的溶解度 (填“>”“<”或“=”)硫酸钠的溶解度。40℃时,硫酸钠的饱和溶液中溶质质量分数为 (保留到0.1%)。
(2)70℃时,将65g硫酸钠加入到100g水中搅拌,形成硫酸钠的 (填“饱和”或“不饱和”)溶液。
(3)将60℃氯化铵的不饱和溶液变为饱和溶液,可采取的措施是 (填序号)。
A.蒸发溶剂
B.增加溶剂
C.降低温度
D.升高温度
【答案】(1)>;33.3%;
(2)饱和;
(3)AC。
【解析】(1)由溶解度曲线可知,在20℃~35℃,氯化铵的溶解度>硫酸钠的溶解度;40℃时,硫酸钠的溶解度是50g,硫酸钠的饱和溶液中溶质质量分数=≈33.3%;故答案为:>;33.3%;
(2)70℃时,硫酸钠的溶解度是45g,所以将65g硫酸钠加入到100g水中充分搅拌,形成硫酸钠的饱和溶液;故答案为:饱和;
(3)氯化铵的溶解度随温度的升高而增大,所以将60℃时氯化铵的不饱和溶液转变成饱和,可以采用的方法有:降低温度、增加溶质、蒸发溶剂等;故答案为:AC。
20.(2022•日照)如表是KNO3和NH4Cl分别在不同温度时的溶解度。
温度/℃
0
10
20
30
40
50
60
溶解度/g
KNO3
13.3
20.9
31.6
45.8
63.9
85.5
110
NH4Cl
29.4
33.3
37.2
41.4
45.8
50.4
55.2
根据数据,绘制二者的溶解度曲线如图所示,a点为曲线的交点。回答下列问题:
(1)下列说法错误的是 (填标号)。
A.二者的溶解度均随温度升高而增大
B.曲线M为KNO3的溶解度曲线
C.a点对应的温度在30℃与40℃之间
D.a点对应的溶解度在37.2g与41.4g之间
(2)60℃时,处于c点的KNO3溶液 (填“饱和”或“不饱和”)。欲将处于c点的KNO3溶液转变为b点,可以采取 (填“蒸发溶剂”“降低温度”或“增加溶质”)的措施。
(3)60℃时,饱和KNO3溶液中混有少量的NH4Cl,应采用 (填“蒸发溶剂”或“降温结晶”)、过滤的方法提纯KNO3。
(4)若不改变溶剂的质量,将60℃时的155.2g饱和NH4Cl溶液降温至10℃,能析出NH4Cl晶体的质量为 g。
【答案】(1)C;
(2)不饱和;增加溶质、蒸发溶剂;
(3)降温结晶;
(4)21.9。
【解析】(1)A.二者的溶解度均随温度升高而增大正确;
B.曲线M为KNO3的溶解度曲线正确,因为硝酸钾的溶解度随温度的升高变化比氯化铵大;
C.a点对应的温度在30℃与40℃之间错误,应该在20℃与30℃之间;
D.a点对应的溶解度在37.2g与41.4g之间正确;
故答案为:C;
(2)60℃时,处于c点是KNO3的不饱和溶液,因为c是硝酸钾溶解度曲线的线下点;欲将处于c点的KNO3溶液转变为b点,可以采取增加溶质或蒸发溶剂;故答案为:不饱和;增加溶质、蒸发溶剂;
(3)60℃时,饱和KNO3溶液中混有少量的NH4Cl,应采用降温结晶、过滤的方法提纯KNO3,因为硝酸钾的溶解度随温度的升高变化比氯化铵大;故答案为:降温结晶;
(4)若不改变溶剂的质量,将60℃时的155.2g饱和NH4Cl溶液降温至10℃,60℃时氯化铵的溶解度是55.2g,10℃时,氯化铵的溶解度是33.3g,能析出NH4Cl晶体的质量=55.2g﹣33.3g=21.9g;故答案为:21.9。
相关试卷
这是一份专题 11 坐标曲线-中考化学总复习高频考点必刷题(全国通用),文件包含专题11坐标曲线图解析版docx、专题11坐标曲线图原卷版docx等2份试卷配套教学资源,其中试卷共32页, 欢迎下载使用。
这是一份专题 09 计算题-中考化学总复习高频考点必刷题(全国通用),文件包含专题09计算题解析版docx、专题09计算题原卷版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
这是一份专题 08 实验探究-中考化学总复习高频考点必刷题(全国通用),文件包含专题08实验探究解析版docx、专题08实验探究原卷版docx等2份试卷配套教学资源,其中试卷共49页, 欢迎下载使用。












