







2024届高考化学一轮复习课件 第四章 化工生产中的重要非金属元素 第1讲 氯及其化合物
展开第四章 化工生产中的重要非金属元素第1讲 氯及其化合物
必备知识·整合
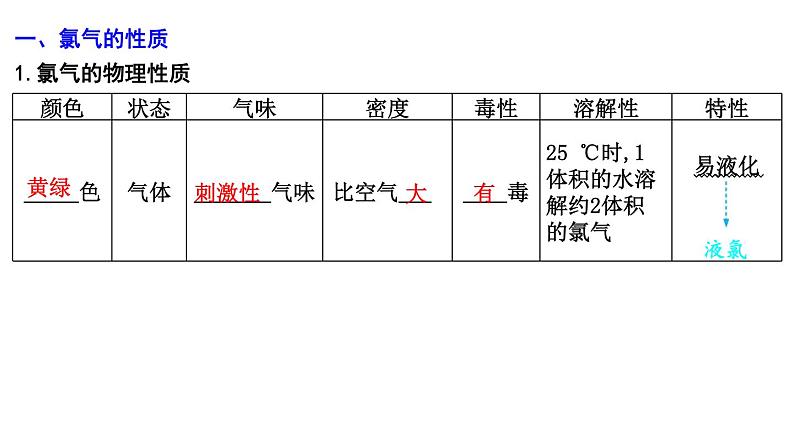
一、氯气的性质1.氯气的物理性质
黄绿
刺激性
大
有
液氯
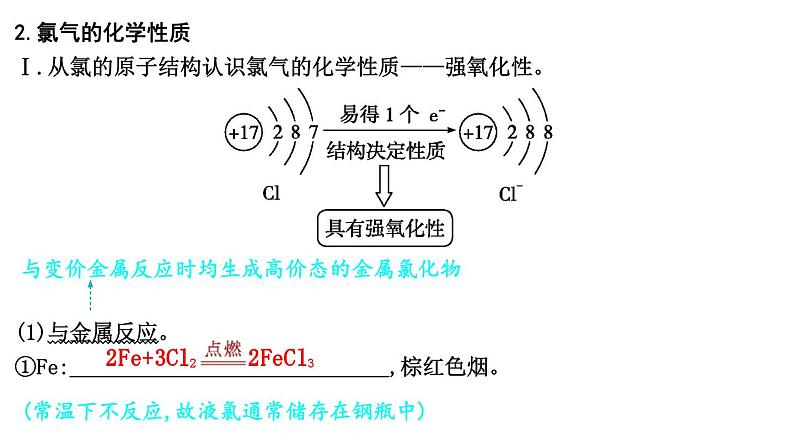
2.氯气的化学性质Ⅰ.从氯的原子结构认识氯气的化学性质——强氧化性。
(1)与金属反应。①Fe: ,棕红色烟。
与变价金属反应时均生成高价态的金属氯化物
(常温下不反应,故液氯通常储存在钢瓶中)
②Cu: , 色烟。
棕黄
(2)与非金属单质反应。①H2: ,苍白色火焰。(H2和Cl2的混合气体光照时会发生爆炸)
②能将P、Si等氧化为PCl3、PCl5、SiCl4。
(3)与还原性无机化合物反应。①与碘化钾溶液反应: 。②与SO2水溶液反应: 。③与FeCl2溶液反应: 。
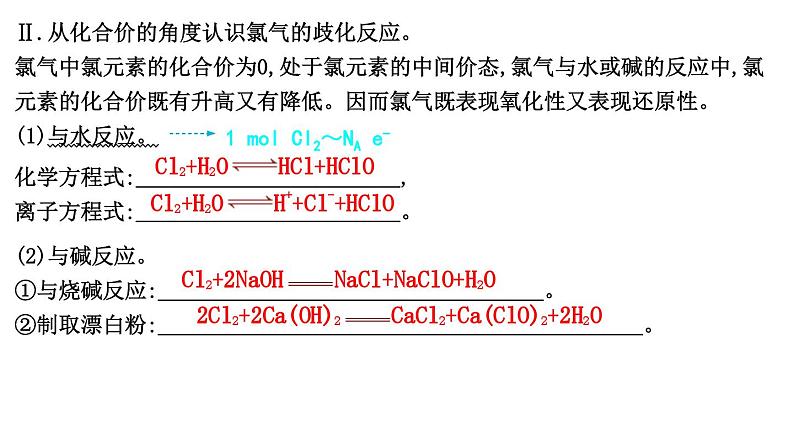
Ⅱ.从化合价的角度认识氯气的歧化反应。氯气中氯元素的化合价为0,处于氯元素的中间价态,氯气与水或碱的反应中,氯元素的化合价既有升高又有降低。因而氯气既表现氧化性又表现还原性。(1)与水反应。
化学方程式: ,离子方程式: 。
1 mol Cl2~NA e-
(2)与碱反应。①与烧碱反应: 。②制取漂白粉: 。
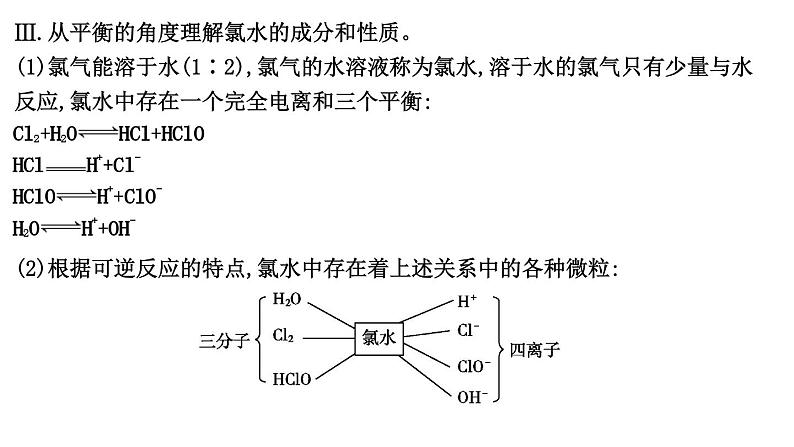
Ⅲ.从平衡的角度理解氯水的成分和性质。(1)氯气能溶于水(1∶2),氯气的水溶液称为氯水,溶于水的氯气只有少量与水反应,氯水中存在一个完全电离和三个平衡:
(2)根据可逆反应的特点,氯水中存在着上述关系中的各种微粒:
(3)氯水性质的多重性:新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。
(4)液氯、新制氯水、久置氯水的比较。
[理解·辨析] 判断正误:正确的画“√”,错误的画“×”。
(1)过量的铁粉在氯气中加热,充分反应后产物为FeCl2。( )
解析:(1)氯气具有强氧化性,与变价金属反应时均生成高价态的金属氯化物。
×
(2)Cl2具有很强的氧化性,在化学反应中只能作氧化剂。( )
解析:(2)Cl2与水或碱反应时既作氧化剂又作还原剂。
×
解析:(3)Cl2将碘化钾氧化为碘单质。
(3)氯气能使湿润的淀粉-碘化钾试纸变蓝,说明Cl2具有氧化性。( )
(4)为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可。( )
解析:(4)氯水具有漂白性。
√
×
二、氯的含氧酸及其盐1.氯的含氧酸(1)氯的含氧酸的种类。HClO( )、HClO2( )、 (氯酸)、 (高氯酸)。
次氯酸
亚氯酸
HClO3
HClO4
(2)氯的含氧酸的性质。酸性:HClO4>HClO3>HClO2>HClO;氧化性:HClO>HClO2>HClO3>HClO4。
H—O—Cl
写出下列反应的化学方程式:①不稳定性: (见光易分解)。
②弱酸性。NaClO溶液中通入少量CO2: 。
2.次氯酸盐(1)漂白液(“84”消毒液)。
NaClO
HClO
强氧化
(2)漂白粉。
Ca(ClO)2
碱
强氧化
[理解·辨析] 判断正误:正确的画“√”,错误的画“×”。
(1)氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂。( )
解析:(1)氯气与烧碱溶液、石灰乳反应分别得到“84”消毒液、漂白粉。
√
(2)“84”消毒液的消毒原理与H2O2的相同,都是利用强氧化性。( )
√
(3)漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3。( )
×
(4)NaClO和Ca(ClO)2的溶液能杀菌、消毒的原理是两者水解均呈碱性。( )
解析:(4)杀菌、消毒的原理是NaClO和Ca(ClO)2与空气中的水、CO2反应生成了次氯酸。
×
(5)洁厕灵不能与“84”消毒液混用,原因是两种溶液混合产生的HClO易分解。( )
解析:(5)洁厕灵与“84”消毒液混合产生有毒的Cl2。
×
三、氯气的实验室制法1.制取原理实验室通常可用强氧化剂[MnO2、KMnO4、K2Cr2O7、KClO3、Ca(ClO)2等]氧化浓盐酸来制取氯气。实验室用MnO2制取Cl2的化学方程式: 。
2.实验装置
3.实验室制取氯气的注意事项(1)反应物的选择:必须用浓盐酸,稀盐酸与MnO2不反应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。(2)实验结束后,先使反应停止并排出残留的Cl2后,再拆卸装置,避免污染空气。(3)尾气吸收时,用NaOH溶液吸收Cl2,不能用澄清石灰水吸收,因为澄清石灰水中含Ca(OH)2的量少,吸收不完全。
4.氯气的验满方法
变蓝
变红后褪色
[理解·辨析] 判断正误:正确的画“√”,错误的画“×”。
(1)含4 mol HCl的浓盐酸与足量MnO2反应,可制备标准状况下22.4 L Cl2。( )
解析:(1)稀盐酸与MnO2不反应,随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。
×
(2)用饱和NaHCO3溶液除去Cl2中混有的HCl。( )
×
解析:(2)应用饱和食盐水除去Cl2中混有的HCl。
(3)用浓硫酸或碱石灰干燥Cl2。( )
解析:(3)碱石灰与氯气会发生反应。
×
(4)可用排饱和食盐水法收集Cl2。( )
√
(5)常用饱和石灰水吸收尾气中的Cl2。( )
解析:(5)氢氧化钙微溶于水,吸收氯气不完全。
×
(6)用干燥的淀粉-碘化钾试纸检验Cl2是否收集满。( )
解析:(6)要用湿润的淀粉-碘化钾试纸检验Cl2。
×
四、卤素的性质1.卤素单质的相似性
FeI2
(3)都能与水反应: (F2例外)。
(4)都能与碱溶液反应: (F2例外)。
2.卤素单质性质的递变性
浅黄绿
黄绿
深红棕
紫黑
加深
升高
易
难
减弱
强
弱
增强
3.卤素单质的特殊性卤素单质及其化合物除了具有共性外,都有其特殊性质。
铅制器皿或塑料瓶
深红棕
挥发
有
液
橡胶
淀粉
升华
KIO3
4.卤素离子的检验方法(1)AgNO3溶液(稀硝酸)——沉淀法。
白
淡黄
黄
Br-
I-
蓝
五、氯、溴、碘的提取——海水资源的开发利用1.氯的提取——氯碱工业
Cl2
H2、NaOH
(1)电解NaCl溶液(写出化学方程式,下同): 。
(2)产物制盐酸: 。
(3)制漂白液: 。
2.海水提溴
3.海带提碘
[理解·辨析] 判断正误:正确的画“√”,错误的画“×”。
(1)能使湿润的淀粉-KI试纸变成蓝色的物质一定是Cl2。( )
解析:(1)其他氧化性的气体(NO2)也能将KI氧化为碘单质。
×
(2)用硝酸酸化的硝酸银溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液。( )
解析:(2)分别产生白色沉淀、淡黄色沉淀、黄色沉淀。
√
(3)某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I-。( )
解析:(3)原来溶液中存在碘单质。
×
(4)溴化银具有感光性,碘化银不具有感光性。( )
解析:(4)碘化银具有感光性,常用于人工降雨。
×
(5)氟气跟氯化钠水溶液反应,一定有氟化氢和氧气生成。( )
√
(6)海水中提取溴涉及多个氧化还原反应。( )
√
关键能力·提升
考点一 氯及其化合物
下列对实验现象的解释或结论正确的是( )
D
写出a、b、d、e处反应的离子方程式。
1.自来水厂一种预防和处理Cl2泄漏的方法如图所示。下列有关说法不正确的是( )
D
氯气的性质
解析:ClO-能把Fe2+氧化为Fe3+,Fe2+、ClO-不能大量共存,故D不正确。
2.(2023·甘肃武威期末)氯气溶于水达到平衡形成饱和溶液,若其他条件不变,只改变某一条件,下列叙述正确的是( )
A
3.物质分类和转化是学习化学的重要思想方法。部分含氯物质的分类与相应化合价关系如图所示,下列推断不合理的是( )
含氯化合物的性质与转化
C
A.①的水溶液能与④反应生成②B.用③代替②进行自来水消毒更安全C.②与SO2按物质的量之比1∶1通入水中,再滴入品红溶液,溶液呈无色D.由ClONO2在图中的位置可推测其可能具有强氧化性,能水解生成两种酸
4.(不定项)(2022·山东肥城教学研究中心模拟)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如图所示:
已知:“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。下列说法正确的是( )A.NaClO2的“有效氯含量”约为1.57 gB.反应①中NaHSO4和ClO2的物质的量之比为1∶2C.NaClO3的氧化性强于NaClO2的D.反应②中的H2O2可以用NaClO4代替
AC
考点二 氯气的实验室制备方法
金属锡是一种具有银白色金属光泽且质地较软的低熔点金属,常温下SnCl4为无色液体,沸点为 114 ℃,在空气中易水解为锡酸和HCl。可用Cl2与熔融金属锡反应制备SnCl4,装置如图(夹持装置略)。下列说法错误的是( )
C
A.用注射器代替长颈漏斗能更好地控制产生氯气的速率B.戊装置的作用是冷凝、收集SnCl4C.实验过程中应该先点燃酒精灯熔化金属锡,再向甲中注入浓盐酸D.用装有碱石灰的干燥管代替己装置更合理
解析:由于高锰酸钾与浓盐酸反应剧烈,故用注射器代替长颈漏斗能更好地控制浓盐酸的滴速,进而控制反应的速率,故A正确;常温下SnCl4为无色液体,沸点为114 ℃,故该物质的收集需要进行冷凝液化,故B正确;由于金属锡是排在氢前面的金属,活泼性较强,先点燃酒精灯熔化金属锡会与空气中的氧气反应,因此应该先制备氯气,将装置中的空气排尽后再加热金属锡,故C错误;己装置中的水蒸气会进入戊装置中,导致SnCl4水解,换用装有碱石灰的干燥管既能吸收多余的氯气,又能防止水蒸气扩散至戊装置中,故D正确。
(1)实验中己装置应起什么作用?如何改进己装置?
提示:SnCl4易水解,己装置应起到干燥和吸收尾气的作用。换用装有碱石灰的干燥管既能吸收多余的氯气,又能防止水蒸气扩散至戊装置中。
(2)实验结束拆卸装置前应注意什么?
提示:先使反应停止,排出残留的Cl2后,再拆卸装置,避免Cl2污染空气。
1.(2022·广东卷)实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是( )
D
氯气的实验室制备及检验
解析:浓盐酸易挥发,制备的氯气中含有HCl,可用饱和食盐水除去HCl,Cl2可用浓硫酸干燥,故A不符合题意;氯气的密度大于空气的密度,可用向上排空气法收集,故B不符合题意;湿润的红布条褪色,干燥的红布条不褪色,可验证干燥的氯气不具有漂白性,故C不符合题意;氯气在水中的溶解度较小,应用NaOH溶液吸收尾气,故D符合题意。
2.某小组同学利用一定浓度的HCl溶液和MnO2制备Cl2。为了防止制备的Cl2逸散,该小组同学设计了装置Ⅰ、Ⅱ、Ⅲ。
试回答下列问题。
(1)发生装置选择 (填“图甲”“图乙”或“图丙”)。
解析:利用一定浓度的HCl溶液和MnO2制备Cl2,需要加热,生成的氯气中含有挥发出的氯化氢气体,需要利用饱和食盐水除去氯化氢,依据Cl2的性质和装置特点分析解答。(1)反应需要加热,图丙装置中恒压分液漏斗能使液体顺利滴下,因此发生装置选择图丙。
答案:(1)图丙
2.某小组同学利用一定浓度的HCl溶液和MnO2制备Cl2。为了防止制备的Cl2逸散,该小组同学设计了装置Ⅰ、Ⅱ、Ⅲ。
试回答下列问题。
(2)①若用所选的发生装置和装置Ⅰ制取氯气,b瓶加入的液体一般为 。反应开始后,关闭活塞K时,发现c中液面上升不明显,可能的原因是 ,检查的简单方法是 . 。
饱和食盐水
装置漏气
用湿润的碘化钾-淀粉试纸靠近各接口
处检验,漏气处试纸变蓝(或涂肥皂水等合理方法均可)
2.某小组同学利用一定浓度的HCl溶液和MnO2制备Cl2。为了防止制备的Cl2逸散,该小组同学设计了装置Ⅰ、Ⅱ、Ⅲ。
试回答下列问题。
②装置Ⅰ能防止多余气体逸散的原因是 . 。
关闭活塞后,若a中仍有气体生成,气体压强增大,将b中液体压入c中,整个装置成为储气装置,不会有气体逸出
2.某小组同学利用一定浓度的HCl溶液和MnO2制备Cl2。为了防止制备的Cl2逸散,该小组同学设计了装置Ⅰ、Ⅱ、Ⅲ。
试回答下列问题。
③欲用装置Ⅱ(或装置Ⅲ)代替装置Ⅰ中的b~c部分(试剂相同),装置Ⅱ (填“是”或“否”)可行,理由是 。装置Ⅲ (填“是”或“否”)可行,理由是 . 。
是
装置Ⅱ的原理与装置Ⅰ相同
否
c瓶因密闭,体积不能改变,
压强增大时易发生危险
解析:(2)若用所选的发生装置和装置Ⅰ制取氯气,为了除去氯气中的氯化氢气体,b瓶加入的液体一般为饱和食盐水。反应开始后,关闭活塞K时,发现c中液面上升不明显,可能的原因是装置漏气。氯气具有强氧化性,则检查氯气是否泄漏的简单方法是用湿润的碘化钾-淀粉试纸靠近各接口处检验,漏气处试纸变蓝。
[归纳总结]氯气制备装置的创新考查
3.实验室中利用如图装置模拟制备“84”消毒液(有效成分为NaClO),下列说法不正确的是( )
其他含氯化合物的制备
A
A.为除去Cl2中的HCl,装置a中的试剂为饱和Na2CO3溶液B.盛放浓盐酸的仪器是分液漏斗C.装置b中,采用冰水浴冷却有利于NaClO的生成D.装置c的作用是吸收尾气
解析:为除去Cl2中的HCl,装置a中的试剂为饱和NaCl溶液,故A错误;装置b中,反应放热,采用冰水浴冷却有利于NaClO的生成,防止温度高时产生副产品NaClO3,故C正确。
4.三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33 ℃,沸点为73 ℃,氯气与单质碘需在温度稍低于70 ℃下反应制备ICl3,实验室制备装置如图所示。下列说法正确的是( )
A
A.装置A可选用的药品为高锰酸钾与浓盐酸B.装置B的作用是除杂,也作安全瓶,在本实验中可以和装置C互换位置C.装置C中的硅胶可用浓硫酸代替D.装置D最恰当的加热方式是用酒精灯先预热再集中加热
解析:高锰酸钾与浓盐酸在常温下发生氧化还原反应生成氯气,不需要加热装置,故A正确;装置B中饱和食盐水可除去氯气中混有的HCl杂质气体,装置C是干燥装置,两者位置不能互换,故B错误;装置C是利用硅胶吸收水蒸气,U形管内装固体干燥剂,浓硫酸是液体干燥剂,不能用浓硫酸代替,故C错误;装置D中碘和氯气反应生成ICl3,三氯化碘(ICl3)熔点为33 ℃,沸点为 73 ℃,该反应需在温度稍低于70 ℃下进行,则最恰当的加热方式是用水浴加热,故D错误。
考点三 卤素 卤素离子的检验
下列实验操作、现象和结论均正确的是( )
B
解析:A项,KI-淀粉溶液一般作为指示剂,设计用H2O2溶液滴定KI-淀粉溶液无法判定终点,错误;B项,在酸性环境中,KIO3与KI反应生成I2,正确;C项,NO2溶于水,与水反应生成硝酸,硝酸也具有强氧化性,也可使淀粉-碘化钾试纸变蓝,错误;D项,加入AgNO3溶液之前要用硝酸中和溶液中的碱,错误。
如何检验有机物中是否含有溴原子?提示:先将有机物在氢氧化钠溶液中加热,充分反应后静置,取上层溶液加适量的稀硝酸中和碱后,加入硝酸银溶液,若生成淡黄色沉淀,则证明该有机物中含溴原子。
卤素、卤素离子的检验
1.某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,则下列叙述正确的是( )A.原溶液中的Br-一定被氧化B.不能确定通入氯气之后的溶液中是否存在Fe2+C.通入氯气之后,原溶液中的Fe2+不一定被氧化D.若取少量所得溶液,再加入CCl4,静置、分液,向上层溶液中加入足量的AgNO3溶液,一定能产生淡黄色沉淀
B
解析:通入一定量氯气后再滴加KSCN溶液,溶液呈红色,说明有Fe3+生成,Fe2+被氧化但不一定全部被氧化,没有实验现象说明Br-部分被氧化或完全被氧化,A错误;不能确定通入氯气之后的溶液中是否存在Fe2+,B正确;通入一定量氯气后再滴加KSCN溶液,溶液呈红色,说明一定有Fe3+生成,C错误;没有实验现象说明Br-部分被氧化或完全被氧化,所以向分液后的上层溶液中加入足量硝酸银溶液,不一定生成淡黄色沉淀,D错误。
2.为证明卤族元素的非金属性强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检查)。实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。下列说法错误的是( )
C
解析:浓盐酸与KMnO4固体反应制取Cl2,Cl2与NaBr溶液反应生成NaCl和Br2;Br2加入KI溶液中,生成的I2被CCl4萃取,从而进入CCl4层。Ⅳ中,Br2加入KI溶液中,生成的I2被CCl4萃取,从而进入CCl4层,所以实验现象是四氯化碳层溶液变为紫红色,C不正确;过程Ⅲ,B装置中溶液颜色变为红棕色时,表明C中溶液不存在多余的氯气,从而排除氯气对溴置换碘实验的干扰,D正确。
3.海水开发利用的部分过程如图所示。下列说法错误的是( )
C
海水提溴 海带提碘
A.向苦卤中通入Cl2是为了提取溴B.粗盐可采用除杂和重结晶等过程提纯C.工业生产中常选用NaOH作为沉淀剂D.富集溴一般先用热空气和水蒸气吹出单质溴,再用SO2将其还原吸收
4.(2021·全国甲卷,节选)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。I2的一种制备方法如图所示:
(1)加入Fe粉进行转化反应的离子方程式为 ,生成的沉淀与硝酸反应,生成 后可循环使用。
回答下列问题:
4.(2021·全国甲卷,节选)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。I2的一种制备方法如图所示:
(2)通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为 ;若反应物用量比n(Cl2)/n(FeI2)=1.5时,氧化产物为 ;当n(Cl2)/n(FeI2)>1.5后,单质碘的收率会降低,原因是 。
回答下列问题:
微专题7 卤素互化物 拟卤素
1.卤素互化物由两种卤素互相结合而成的物质叫卤素互化物。如IBr、ICl、BrF3、ClF3。
2.拟卤素有些多原子分子与卤素单质性质相似,其阴离子与卤素阴离子性质相似。如:氰[(CN)2]、硫氰[(SCN)2]、氧氰[(OCN)2]。解答这类题目时可用换元法,如把(SCN)2当作X2,把SCN-当作X-。卤素单质和“拟卤素”的氧化性由强到弱的顺序为F2、(OCN)2、Cl2、Br2、(CN)2、(SCN)2、I2。
1.(2022·天津期中)“XYn”表示不同卤素原子之间通过共用电子对形成的卤素互化物(非金属性:X
2.(2022·湖南涟源第一中学阶段练习)(SCN)2称为拟卤素,将几滴KSCN溶液加入酸性的含有Fe3+的溶液中,溶液变为红色,将该红色溶液分为两份:①向其中一份溶液中加入适量KMnO4溶液,红色褪去;②向另一份溶液中通入SO2,红色也褪去。下列说法中不正确的是( )
B
3.氰[(CN)2]的结构式为N≡C—C≡N,其化学性质与卤素单质(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间。
(1)写出(CN)2的电子式: 。
(2)写出(CN)2在常温下与烧碱溶液反应的化学方程式: . 。(3)在KBr、KI、KCN的混合溶液中通入少量氯气,发生反应的离子方程式为 。
4.一氯化碘(ICl)、三氯化碘(ICl3)都是卤素互化物,它们的性质与卤素单质相似。(1)ICl3与水反应的产物可能为 (填化学式)。 (2)ICl在常温下与烧碱溶液反应的离子方程式为 ,该反应是否是氧化还原反应? (填“是”或“否”)。
HCl、HIO2
否
高考真题·导向
D
2.(2021·北京卷)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。①反应的离子方程式是 。
2.(2021·北京卷)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。②电极反应式:
2.(2021·北京卷)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。ⅰ.随c(H+)降低或c(Mn2+)升高,MnO2氧化性减弱。ⅱ.随c(Cl-)降低, 。
解析:③反应不能发生也可能是还原剂还原性减弱,或者产生了氧化性更强的氧化剂,即Cl-还原性减弱或Cl2的氧化性增强。
答案:③Cl-还原性减弱或Cl2的氧化性增强
2.(2021·北京卷)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。④补充实验证实了③中的分析。
a是 ,b是 。
解析:④可以从增大氯离子浓度的角度再结合实验Ⅱ的现象分析,试剂a可以是KCl固体(或浓/饱和溶液);结合实验Ⅲ的现象是没有氯气,且实验Ⅲ也加入了试剂a,那一定是试剂b影响了实验Ⅲ的现象,再结合原因i可知试剂b是MnSO4固体(或浓/饱和溶液)。
答案:④KCl固体(或浓/饱和溶液) MnSO4固体(或浓/饱和溶液)
2.(2021·北京卷)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(2)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是 ,从原子结构角度说明理由 。
解析:(2)非金属性越弱,其阴离子的还原性越强,反应时所需的氢离子浓度越小,故顺序是KCl>KBr>KI;其原因是Cl、Br、I位于第ⅦA族,从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,阴离子的还原性逐渐增强。
答案:(2)KCl>KBr>KI Cl、Br、I位于第ⅦA族,从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,阴离子的还原性逐渐增强
2.(2021·北京卷)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是 。
解析:(3)根据(1)中的结论推测随Cl-浓度降低导致二氧化锰的氧化性减弱,那么如果进一步降低Cl-浓度则可以提高溴的氧化性,将Mn2+氧化为MnO2,故该化合物为AgNO3或Ag2SO4。
答案:(3)AgNO3或Ag2SO4
2.(2021·北京卷)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(4)Ag分别与1 mol·L-1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因: 。
2.(2021·北京卷)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(5)总结:物质氧化性和还原性变化的一般规律是 。
解析:(5)物质氧化性和还原性还与物质的浓度有关,浓度越大,氧化性或者还原性越强,故规律为氧化剂(还原剂)的浓度越大,其氧化性(还原性)越强,还原产物(氧化产物)的浓度越大,氧化剂(还原剂)的氧化性(还原性)越小;还原反应中,反应物浓度越大或生成物浓度越小,氧化剂氧化性越强。
答案:(5)氧化剂(还原剂)的浓度越大,其氧化性(还原性)越强,还原产物(氧化产物)的浓度越大,氧化剂(还原剂)的氧化性(还原性)越小;还原反应中,反应物浓度越大或生成物浓度越小,氧化剂氧化性越强
3.(2021·广东卷)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取Cl2的化学方程式为 。
3.(2021·广东卷)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(2)实验室制取干燥Cl2时,净化与收集Cl2所需装置的接口连接顺序为 。
解析:(2)实验室制得的Cl2中含有HCl、H2O,可依次通过饱和食盐水、浓硫酸分别除去HCl、H2O,再收集Cl2并进行尾气处理,因此装置的接口连接顺序为cdbae。
答案:(2)cdbae
3.(2021·广东卷)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中 已分解。检验此久置氯水中Cl-存在的操作及现象是 。
解析:(3)氯水中能使品红溶液褪色的物质是HClO,氯水久置后不能使品红溶液褪色,可推测氯水中HClO已分解。检验Cl-存在的方法是取少量久置氯水于试管中,加入几滴硝酸酸化的AgNO3溶液,若有白色沉淀生成,则该久置氯水中存在Cl-。
答案:(3)HClO 取少量久置氯水于试管中,加入几滴硝酸酸化的AgNO3溶液,若有白色沉淀生成,则该久置氯水中存在Cl-
3.(2021·广东卷)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(4)某合作学习小组进行以下实验探究。①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25 ℃时,Ksp(AgCl)=1.8×10-10。③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。猜想b:AgCl在水中的溶解度S(45 ℃)>S(35 ℃)>S(25 ℃)。④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。表1
⑤数据分析、交流讨论 25 ℃的AgCl饱和溶液中,c(Cl-)= mol·L-1。实验结果为 A3>A2>A1。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有 。
3.(2021·广东卷)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(4)某合作学习小组进行以下实验探究。①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25 ℃时,Ksp(AgCl)=1.8×10-10。③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。猜想b:AgCl在水中的溶解度S(45 ℃)>S(35 ℃)>S(25 ℃)。⑥优化实验 小组同学为进一步验证猜想b,在实验1~3 的基础上完善方案,进行实验4和5。请完成表2中内容。表2
解析:⑥需要设计实验证明AgCl在水中的溶解度S(45 ℃)>S(35 ℃)>S(25 ℃),则需要控制变量。可以设计不同温度的饱和溶液在相同温度下测试,如果温度较高的饱和溶液电导率比温度较低的饱和溶液电导率高,则可以得出温度升高,饱和溶液中离子浓度高。所以可以设计试样Ⅰ在45 ℃下测试与实验3比较,设计试样Ⅱ在45 ℃下测试与实验3比较。
答案:⑥45 Ⅱ 45
3.(2021·广东卷)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(4)某合作学习小组进行以下实验探究。①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25 ℃时,Ksp(AgCl)=1.8×10-10。③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。猜想b:AgCl在水中的溶解度S(45 ℃)>S(35 ℃)>S(25 ℃)。⑥优化实验 小组同学为进一步验证猜想b,在实验1~3 的基础上完善方案,进行实验4和5。请完成表2中内容。表2
⑦实验总结 根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是 。
解析:⑦猜想b成立的判断依据是A3>B2>B1。
答案:⑦A3>B2>B1
点击进入 课后作业·集训
2024届高考化学一轮复习课件 第四章 化工生产中的重要非金属元素 热点强化练2 氯及其化合物的综合实验: 这是一份2024届高考化学一轮复习课件 第四章 化工生产中的重要非金属元素 热点强化练2 氯及其化合物的综合实验,文件包含热点强化练2氯及其化合物的综合实验pptx、热点强化练2氯及其化合物的综合实验docx等2份课件配套教学资源,其中PPT共31页, 欢迎下载使用。
2024届高考化学一轮复习课件 第四章 化工生产中的重要非金属元素 第4讲 无机非金属材料 化学与可持续发展: 这是一份2024届高考化学一轮复习课件 第四章 化工生产中的重要非金属元素 第4讲 无机非金属材料 化学与可持续发展,文件包含第4讲无机非金属材料化学与可持续发展pptx、第4讲无机非金属材料化学与可持续发展docx、第4讲无机非金属材料化学与可持续发展课后作业docx等3份课件配套教学资源,其中PPT共57页, 欢迎下载使用。
2024届高考化学一轮复习课件 第四章 化工生产中的重要非金属元素 第3讲 氮及其化合物: 这是一份2024届高考化学一轮复习课件 第四章 化工生产中的重要非金属元素 第3讲 氮及其化合物,文件包含第3讲氮及其化合物pptx、第3讲氮及其化合物docx、第3讲氮及其化合物课后作业docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。