
04 常考题空4 平衡图像原因解释之温度、压强对平衡的影响 (附答案解析)-备战高考化学大题逐空突破系列(全国通用)
展开常考题空4 平衡图像原因解释之温度、压强对平衡的影响
【高考必备知识】
1.影响化学平衡的因素
(1)若其他条件不变,改变下列条件对化学平衡的影响
改变的条件(其他条件不变)
化学平衡移动的方向
浓度
增大反应物浓度或减小生成物浓度
向正反应方向移动
减小反应物浓度或增大生成物浓度
向逆反应方向移动
压强(对有气体参加的反应)
反应前后气体体积改变
增大压强
向气体分子总数减小的方向移动
减小压强
向气体分子总数增大的方向移动
反应前后气体体积不变
改变压强
平衡不移动
温度
升高温度
向吸热反应方向移动
降低温度
向放热反应方向移动
催化剂
同等程度改变v正、v逆,平衡不移动
(2)“惰性气体”对化学平衡移动的影响
①恒温、恒容下:加入惰性气体体系总压增大,但体积不变,各反应物、生成物的浓度均未改变,故反应速率不变,V正、V逆也不变,化学平衡也不发生移动
②恒温、恒压下:加入惰性气体体积增大各反应物浓度减少反应速率减小,V正、
V逆均减小,等效于降压,故化学平衡向气体总体积增大的方向移动
2.掌握三类平衡移动图像:反应mA(g)+nB(g)pC(g)+qD(g),m+n>p+q,且ΔH>0
(1)速率—时间图——注意断点
t1时增大反应物的浓度,正反应速率瞬间增大,然后逐渐减小,而逆反应速率逐渐增大;t2时升高温度,对任何反应,正反应和逆反应速率均增大,吸热反应的正反应速率增大较快;t3时减小压强,容器容积增大,浓度变小,正反应速率和逆反应速率均减小;t4时使用催化剂,正反应速率和逆反应速率均瞬间增大
(2)转化率(或含量)—时间图——先拐先平
甲表示压强对反应物转化率的影响,对于气体反应物化学计量数之和大于气体生成物化学计量数之和的反应,压强越大,反应物的转化率越大;乙表示温度对反应物转化率的影响,对于吸热反应,温度越高,反应物的转化率越大;丙表示催化剂对反应物转化率的影响,催化剂只能改变化学反应速率,不能改变反应物的转化率
(3恒压(温)线——定一议二
分析时可沿横轴作一条平行于纵轴的虚线,即:为等压线或等温线,然后分析另一条件变化对该反应的影响
【答题模板及剖析】
恒压线(恒温线)
答题策略
叙特点(反应特点或容器特点)→变条件→定方向→得结论(或结果)
答题模板
该反应的正反应是气体分子数减小(或增大)的反应,当温度一定时,增大压强,平衡正向移动,因此×××(得结论)
经典例题
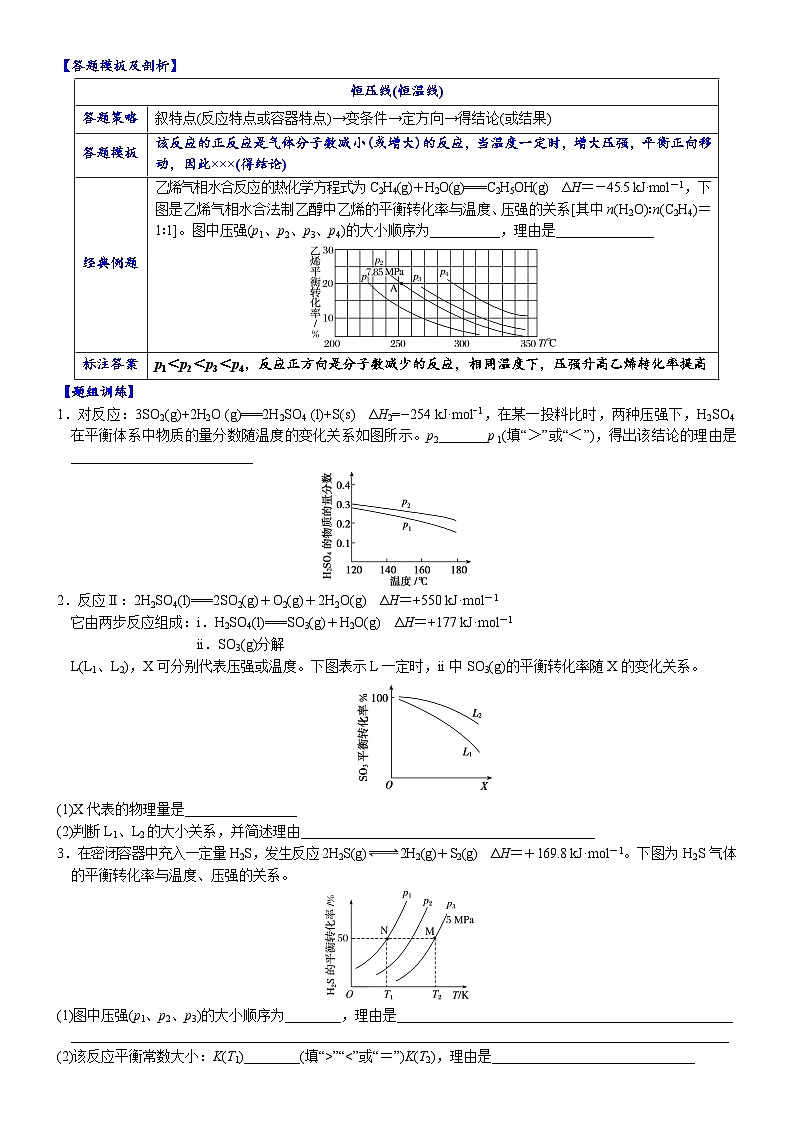
乙烯气相水合反应的热化学方程式为C2H4(g)+H2O(g)===C2H5OH(g) ΔH=-45.5 kJ·mol-1,下图是乙烯气相水合法制乙醇中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。图中压强(p1、p2、p3、p4)的大小顺序为__________,理由是______________
标注答案
p1<p2<p3<p4,反应正方向是分子数减少的反应,相同温度下,压强升高乙烯转化率提高
【题组训练】
1.对反应:3SO2(g)+2H2O (g)===2H2SO4 (l)+S(s) ΔH2=−254 kJ·mol−1,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2_______p 1(填“>”或“<”),得出该结论的理由是__________________________
2.反应Ⅱ:2H2SO4(l)===2SO2(g)+O2(g)+2H2O(g) ΔH=+550 kJ·mol-1
它由两步反应组成:i.H2SO4(l)===SO3(g)+H2O(g) ΔH=+177 kJ·mol-1
ii.SO3(g)分解
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
(1)X代表的物理量是________________
(2)判断L1、L2的大小关系,并简述理由__________________________________________
3.在密闭容器中充入一定量H2S,发生反应2H2S(g)2H2(g)+S2(g) ΔH=+169.8 kJ·mol-1。下图为H2S气体的平衡转化率与温度、压强的关系。
(1)图中压强(p1、p2、p3)的大小顺序为________,理由是________________________________________________
______________________________________________________________________________________________
(2)该反应平衡常数大小:K(T1)________(填“>”“<”或“=”)K(T2),理由是_____________________________
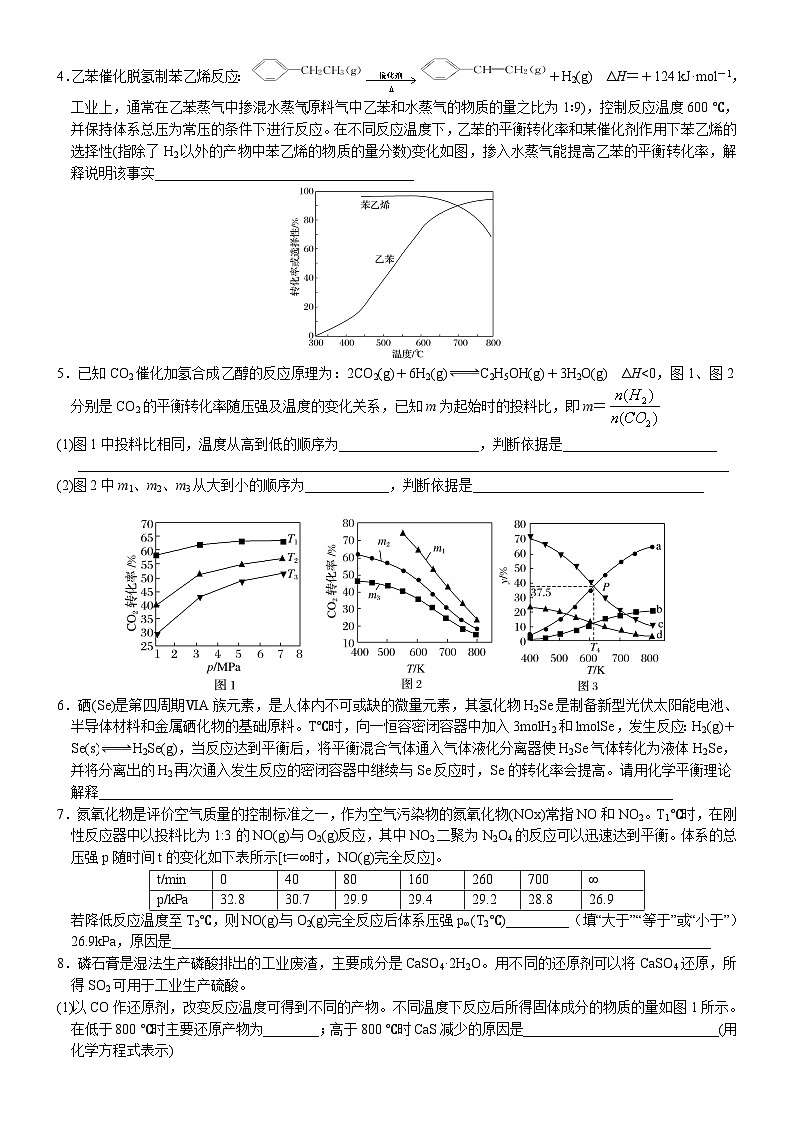
4.乙苯催化脱氢制苯乙烯反应:+H2(g) ΔH=+124 kJ·mol-1,工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1∶9),控制反应温度600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)变化如图,掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实_____________________________________
5.已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) ΔH<0,图1、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=
(1)图1中投料比相同,温度从高到低的顺序为____________________,判断依据是______________________
_____________________________________________________________________________________________
(2)图2中m1、m2、m3从大到小的顺序为____________,判断依据是_________________________________
6.硒(Se)是第四周期ⅥA族元素,是人体内不可或缺的微量元素,其氢化物H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的基础原料。T℃时,向一恒容密闭容器中加入3molH2和lmolSe,发生反应:H2(g)+Se(s)H2Se(g),当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为液体H2Se,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释__________________________________________________________________________________
7.氮氧化物是评价空气质量的控制标准之一,作为空气污染物的氮氧化物(NOx)常指NO和NO2。T1℃时,在刚性反应器中以投料比为1:3的NO(g)与O2(g)反应,其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
t/min
0
40
80
160
260
700
∞
p/kPa
32.8
30.7
29.9
29.4
29.2
28.8
26.9
若降低反应温度至T2℃,则NO(g)与O2(g)完全反应后体系压强p∞(T2℃)_________(填“大于”“等于”或“小于”)26.9kPa,原因是_____________________________________________________________________________
8.磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4·2H2O。用不同的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸。
(1)以CO作还原剂,改变反应温度可得到不同的产物。不同温度下反应后所得固体成分的物质的量如图1所示。在低于800 ℃时主要还原产物为________;高于800 ℃时CaS减少的原因是____________________________(用化学方程式表示)
(2)以高硫煤为还原剂焙烧2.5 h,不同条件对硫酸钙转化率的影响如图2所示。CaCl2的作用是_________;当温度高于1 200 ℃时,无论有无CaCl2存在,CaSO4的转化率趋于相同,其原因是____________________________
____________________________________________________________________________________________
(3)以C作还原剂,向密闭容器中加入相同质量的几组不同C/S值(C与CaSO4的物质的量比)的混合物在1 100 ℃加热,结果如图3所示。当C/S值为0.5时,反应产物为CaO、SO2、CO2;当C/S值大于0.7时,反应所得气体中SO2的体积分数不升反降,其可能原因是______________________________________________
9.(1)在400 ℃时,向1 L的恒容反应器中充入1 mol CH4,发生反应2CH4(g)C2H4(g)+2H2(g) ΔH=+202.0 kJ·mol-1,测得平衡混合气体中C2H4的体积分数为20.0%。则在该温度下,其平衡常数K=____。按化学平衡移动原理,在图1中画出CH4的平衡转化率与温度及压强(p1>p2)的关系曲线
(2)在制备C2H4时,通常存在副反应:2CH4(g)C2H6(g)+H2(g)。在常温下,向体积为1 L的恒容反应器中充入1 mol CH4,然后不断升高温度,得到图2所示C2H4与C2H6的体积分数关系
①在200 ℃时,测出乙烷的量比乙烯多的主要原因是_________________________________________________
②在600 ℃后,乙烯的体积分数减少的主要原因是_____________________________________
10.甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:ⅰ、CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-63kJ·mol-1
ⅱ、CO2(g)+H2(g)CO(g)+H2O(g) ΔH2==+36 kJ·mol-1
ⅲ、CH3OH(g)CO(g)+2H2(g) ΔH3=+99 kJ·mol-1
一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图1所示。温度为470 K时,图中P点________(填“是”或“不是”)处于平衡状态。在490 K之前,甲醇产率随着温度升高而增大的原因是__________________________________________________________________;
490 K之后,甲醇产率下降的原因是_________________________________________________________________
11.容积均为1 L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器。相同温度下,分别充入0.2 mol的NO2,发生反应:2NO2(g)N2O4(g) ΔH<0,甲中NO2的相关量随时间变化如下图所示。0~3 s内,甲容器中NO2的反应速率增大的原因是______________________________________________
12.某实验室模拟反应2C(s)+2NO2(g)N2(g)+2CO2(g) ΔH=-64.2 kJ·mol-1,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T ℃,如图为不同压强下该反应经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1 050 kPa前,反应中NO2转化率随着压强增大而增大的原因____________
________________________________________;在1 100 kPa时,NO2的体积分数为__________
13.CH4—CO2重整反应[CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH>0]在大力推进生态文明建设、“碳达峰”、“碳中和”的时代背景下,受到更为广泛的关注。该反应以两种温室气体为原料,可以生成合成气。如何减少反应过程中的催化剂积碳,是研究的热点之一,某条件下,发生主反应的同时,还发生了积碳反应:
CO歧化:2CO(g)CO2(g)+C(s) ΔH=-172 kJ·mol-1
CH4裂解:CH4(g)C(s)+2H2(g) ΔH=+75 kJ·mol-1
(1)对积碳反应进行计算,得到温度和压强对积碳反应中平衡碳量的影响图(图a和图b),其中表示温度和压强对CH4的裂解反应中平衡碳量影响的是______________(填字母),理由是___________________________________
_________________________________________________________
(2)实验表明,在重整反应中,低温、高压时会有显著积碳产生,由此可推断,对于该重整反应而言,其积碳主要由__________反应产生。综合以上分析,为抑制积碳产生,应选用高温、低压条件
14.研究表明,SO2催化氧化的反应速率方程为v=k0.8(1-nα′)。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α′为某时刻SO2转化率,n为常数。在α′=0.90时,将一系列温度下的k、α值代入上述速率方程,得到vt曲线,如图所示
曲线上v最大值所对应温度称为该α′下反应的最适宜温度tm。t
15.将甲醇转化耦合到丁烯裂解过程中生产丙烯,主要涉及下列反应:
①2C4H8(g)2C3H6(g)+C2H4(g) ΔH>0
②2CH3OH(g)C2H4(g)+2H2O(g) ΔH<0
③C2H4(g)+C4H8(g)2C3H6(g) ΔH<0
已知:甲醇吸附在催化剂上,可以活化催化剂;甲醇浓度过大也会抑制丁烯在催化剂上的转化
(1)图1是C3H6及某些副产物的产率与的关系曲线。最佳的约为_______
(2)图2是某压强下,将CH3OH和C4H8按一定的物质的量之比投料,反应达到平衡时C3H6的体积分数随温度的变化曲线。由图可知平衡时C3H6的体积分数随温度的升高呈现先升高后降低的变化,其原因可能是_________
_____________________________________________________________________________________
16.利用太阳能光解水,制备的H2用于还原CO2合成有机物,可实现资源的再利用
用H2还原CO2可以在一定条件下合成CH3OH(不考虑副反应)
CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0
恒压下,CO2和H2的起始物质的量比为1∶3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O
(1)甲醇平衡产率随温度升高而降低的原因为_______________________________________________________
(2)P点甲醇产率高于T点的原因为_______________________________________________________________
(3)根据图,在此条件下采用该分子筛膜时的最佳反应温度为______℃
17.实验测定2H2S(g)2H2(g)+S2(g) ΔH=+169.8 kJ·mol-1的化学平衡常数Kp随温度变化的曲线是如图中的________(填“a”或“b”),理由是_____________________________________________
【常考题空4 平衡图像原因解释之温度、压强对平衡的影响】答案
1.> 反应Ⅱ是气体物质的量减小的反应,温度一定时,增大压强使反应正向移动,H2SO4 的物质的量增大,体系总物质的量减小,H2SO4的物质的量分数增大
2.(1)压强
(2)L2>L1 2SO3(g)===2SO2(g)+O2(g) ΔH=+196 kJ·mol-1,压强一定时,温度升高,平衡转化率增大
3.(1)p1
4.正反应方向气体分子数增加,加入水蒸气稀释,相当于起减压的效果
5.(1)T3>T2>T1 正反应放热,升高温度平衡逆向移动,温度越高,CO2的平衡转化率越小,所以T3>T2>T1 (2)m1>m2>m3 保持n(CO2)不变,增大n(H2),平衡正向移动,CO2的平衡转化率增大,所以m1>m2>m3
6.将分离出的H2重新通入容器中,平衡正向移动,Se的转化率提高
解析:将平衡混合气通入气体液化分离器气体H2Se转化为液体H2Se,并将分离出的H2重新通入反应容器,会增大反应物中H2的浓度,平衡正向移动,Se的转化率提高,故答案为:将分离出的H2重新通入容器中,平衡正向移动,Se的转化率提高。
7.小于 温度降低,体积不变,总压强降低,NO2二聚为放热反应,温度降低,平衡右移,体系中气体物质的量减少,总压强降低
解析:若降低反应温度至T2℃,则NO(g)与O2(g)完全反应后体系压强p∞(T2℃)小于26.9kPa,原因是温度降低,体积不变,总压强降低,NO2二聚为放热反应,温度降低,平衡右移,体系中气体物质的量减少,总压强降低。
8.(1)CaS CaS+3CaSO44CaO+4SO2↑
(2)作催化剂 两种情况下反应均达到平衡状态,催化剂CaCl2不改变平衡状态
(3)CO2高温下与过量C反应生成CO,使气体总体积增大(或部分转化为其他含S物质)
解析:(1)由图示可知,在低于800 ℃时,还原的主要产物为CaS,在高于800 ℃ 时,得到的主要产物为CaO,则此时是CaS与CaSO4反应生成CaO。(2)由图2可看出,在高于1 200 ℃时,加入CaCl2与不加入CaCl2时CaSO4的转化率相同,但较低温度下加入CaCl2时转化率高,故CaCl2的作用为催化剂。(3)当C/S值大于0.7时,原料中的还原剂C的含量增加,则高温下过量的C与CO2发生反应CO2+C高温,2CO,从而使得气体总体积增大。
9.(1)0.25 如图所示
(2)①在200 ℃时,乙烷的生成速率比乙烯的快
②在600 ℃后,乙烯开始分解为碳和氢气
解析:(1)设平衡时转化的CH4的物质的量为2x mol,根据三段式法进行计算:
2CH4(g)C2H4(g)+2H2(g)
起始/mol 1 0 0
转化/mol 2x x 2x
平衡/mol 1-2x x 2x
则×100%=20.0%,解得x=0.25,则平衡时CH4、C2H4、H2的物质的量浓度分别为0.50 mol·L-1、0.25 mol·L-1和0.50 mol·L-1,则K==0.25。该反应为吸热反应,升高温度,CH4的平衡转化率增大;该反应为气体分子数增大的反应,温度相同时增大压强,CH4的平衡转化率降低,据此画出图像。(2)①题图中200 ℃时乙烷的量比乙烯多,这是因为该条件下乙烷的生成速率比乙烯的快。②在600 ℃后,乙烯的体积分数减少,主要是因为乙烯发生了分解反应。
10.不是 温度越高化学反应速率越快;升高温度,反应ⅰ逆向移动、催化剂活性降低
解析:温度为470 K时,图中P点不是处于平衡状态。在490 K之前,甲醇产率随着温度升高而增大的原因是温度越高化学反应速率越快;490 K之后,甲醇产率下降的原因是升高温度,反应ⅰ逆向移动、催化剂活性降低
11.0~3 s内温度升高对速率的影响大于浓度降低的影响
12.1 050 kPa前反应未达平衡状态,随着压强增大,反应速率加快,NO2转化率提高 50%
解析:根据示意图,1 050 kPa前,反应未达到平衡,随着压强增大,反应速率增大,NO2的转化率加快;假设通入1 mol NO2,
2C(s)+2NO2(g)N2(g)+2CO2(g)
起始/mol 1 0 0
变化/mol 0.4 0.2 0.4
平衡/mol 0.6 0.2 0.4
1 100 kPa时,NO2的体积分数为×100%=50%。
13.(1)a CH4的裂解反应为体积增大的吸热反应,减小压强或升高温度,平衡正移,即高温低压有利于反应正向进行,平衡碳量增大,与图a相符
(2)CO歧化
解析:(1)甲烷的裂解反应为气体体积增大的吸热反应,增大压强,平衡向逆反应方向移动,平衡碳量减小,升高温度,平衡向正反应方向移动,平衡碳量增大,由图可知,图a中温度升高或降低压强时,平衡碳量增大,则图a表示温度和压强对甲烷裂解反应中平衡炭量的影响。
(2)由在重整反应中,低温、高压时会有显著积碳产生可知,产生积碳的反应为气体体积减小的放热反应,由题给化学方程式可知,积碳主要是由一氧化碳的歧化反应产生。
14.升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。当t<tm,k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低
解析:由于该反应是放热反应,温度升高后α降低。由题中信息可知,v=k0.8(1-nα′),升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。当t<tm,k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低。
15.(1)1.0
(2)300~500 ℃时,丁烯裂解(反应①)为主要反应,是吸热反应,升高温度,平衡正向移动,使C3H6的体积分数增大;温度高于500 ℃时,反应②③为主要反应,是放热反应,升高温度,平衡逆向移动,使C3H6的体积分数降低,同时温度升高易发生副反应,C3H6可能转化为C2H4、C3H8、C4H10、C等,使C3H6的体积分数降低
16.(1)该反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小)
(2)分子筛膜从反应体系中不断分离出H2O,有利于反应正向进行,甲醇产率升高
(3)210
解析:(1)该反应是放热反应,温度升高有利于平衡逆向移动,甲醇的平衡产率随温度升高而降低。(2)P点对应反应有分子筛膜,分子筛膜能选择性分离出水,有利于反应正向进行,故P点甲醇产率高于T点甲醇产率。(3)由题图知,当温度为210 ℃时,甲醇的产率最高,因此最佳反应温度为210 ℃。
17.a 正反应为吸热反应,升高温度,平衡常数增大,负对数减小,曲线a满足
06 常考题空6 平衡图像原因解释之转化率、产率变化分析 (附答案解析)-备战高考化学大题逐空突破系列(全国通用): 这是一份06 常考题空6 平衡图像原因解释之转化率、产率变化分析 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共10页。
05 常考题空5 平衡图像原因解释之选择反应最佳条件 (附答案解析)-备战高考化学大题逐空突破系列(全国通用): 这是一份05 常考题空5 平衡图像原因解释之选择反应最佳条件 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共9页。
03 常考题空3 分压平衡常数(Kp)计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用): 这是一份03 常考题空3 分压平衡常数(Kp)计算 (附答案解析)-备战高考化学大题逐空突破系列(全国通用),共19页。












