
2023届江苏省前黄高级中学高三考前攀登行动+化学试卷及答案(一)
展开
这是一份2023届江苏省前黄高级中学高三考前攀登行动+化学试卷及答案(一),共10页。试卷主要包含了5 Mn 55,5~8,059,0 kJ·ml-1,2 ml·L-1、c=0,7,保留两位有效数字),1 kJ·ml-1等内容,欢迎下载使用。
江苏省前黄中学2023届高三考前攀登行动(一)
化学试卷
(考试时间:75分钟 试卷满分:100分)
可能用到的相对原子质量:H 1 C 12 O 16 F 19 Na 23 Mg 24 C1 35.5 Mn 55
一、 单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.化学推动着社会的进步和人类的发展,下列有关说法正确的是 ( )
A.聚氯乙烯可用作不粘锅的耐热涂层材料
B.芯片材料光刻胶中的聚乙烯醇肉桂酸酯属于有机高分子材料
C.纺织行业常用的棉花、麻、蚕丝等材料均属于碳水化合物
D.火箭表面涂层的成分为石墨烯,该成分是一种烯烃
2.少量H2S通入CuSO4溶液生成CuS沉淀和H2SO4。下列说法正确的是 ( )
A. H2S的电子式: B. CuSO4仅含离子键
C. Cu在周期表中位于d区 D. SO42-的空间构型为正四面体
3.黑火药其爆炸反应为,下列说法正确的是 ( )
A.半径大小: B.电负性大小:
C.电离能大小: D.酸性强弱:
4.下列实验装置可以达到实验目的是 ( )
A.装置①用来进行酸碱中和滴定
B.装置②制取收集并吸收HCl
C.装置③可用于除去NaCl固体中混有的NH4Cl
D.装置④可用于制备溴苯并验证发生了取代反应
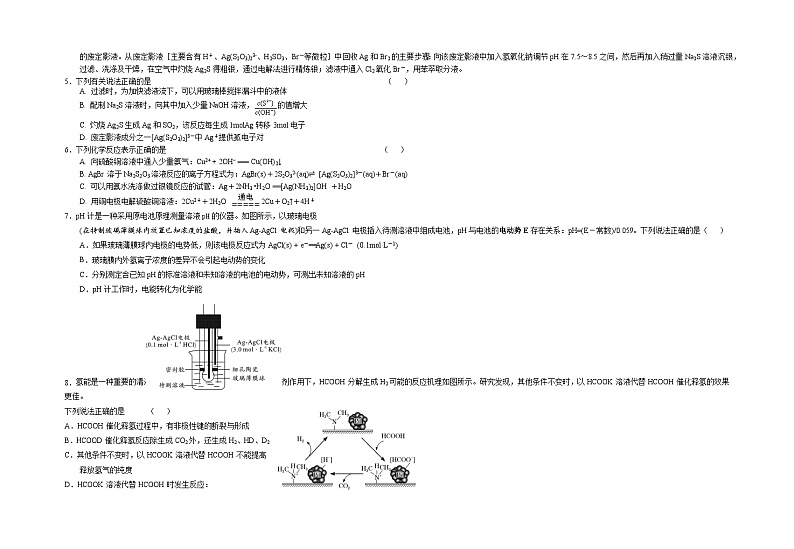
阅读下列资料,完成5~6题:
铜、银位于周期表中第IB族。铜、硫酸铜、硝酸银、银氨溶液是实验室常用的含铜或银的化学试剂。照相底片未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成含有Na3[Ag(S2O3)2]的废定影液。从废定影液[主要含有H+、Ag(S2O3)23-、H2SO3、Br-等微粒]中回收Ag和Br2的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量Na2S溶液沉银,过滤、洗涤及干燥,在空气中灼烧Ag2S得粗银,通过电解法进行精炼银;滤液中通入Cl2氧化Br-,用苯萃取分液。
5. 下列有关说法正确的是 ( )
A. 过滤时,为加快滤液流下,可以用玻璃棒搅拌漏斗中的液体
B. 配制Na2S溶液时,向其中加入少量NaOH溶液,的值增大
C. 灼烧Ag2S生成Ag和SO2,该反应每生成1molAg转移3mol电子
D. 废定影液成分之一[Ag(S2O3)2]3-中Ag+提供孤电子对
6.下列化学反应表示正确的是 ( )
A. 向硫酸铜溶液中通入少量氨气:Cu2+ + 2OH− === Cu(OH)2↓
B. AgBr溶于Na2S2O3溶液反应的离子方程式为:AgBr(s)+2S2O32-(aq)⇌ [Ag(S2O3)2]3-(aq)+Br-(aq)
C. 可以用氨水洗涤做过银镜反应的试管:Ag+2NH3 •H2O =[Ag(NH3)2]OH +H2O
D 890753:fId:890753 . 用铜电极电解硫酸铜溶液:2Cu2++2H2O 通电=====2Cu+O2↑+4H+
7.pH计是一种采用原电池原理测量溶液pH的仪器。如图所示,以玻璃电极
(在特制玻璃薄膜球内放置已知浓度的盐酸,并插入Ag-AgCl电极)和另一Ag-AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=(E-常数)/0.059。下列说法正确的是( )
A.如果玻璃薄膜球内电极的电势低,则该电极反应式为AgCl(s) + e-==Ag(s) + Cl- (0.1mol·L-1)
B.玻璃膜内外氢离子浓度的差异不会引起电动势的变化
C.分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可测出未知溶液的pH
D.pH计工作时,电能转化为化学能
8. 氢能是一种重要的清洁能源,由HCOOH可以制得H2。在催化剂作用下,HCOOH分解生成H2可能的反应机理如图所示。研究发现,其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳。
下列说法正确的是 ( )
A.HCOOH催化释氢过程中,有非极性键的断裂与形成
B.HCOOD催化释氢反应除生成CO2外,还生成H2、HD、D2
C.其他条件不变时,以HCOOK溶液代替HCOOH不能提高
释放氢气的纯度
D.HCOOK溶液代替HCOOH时发生反应:
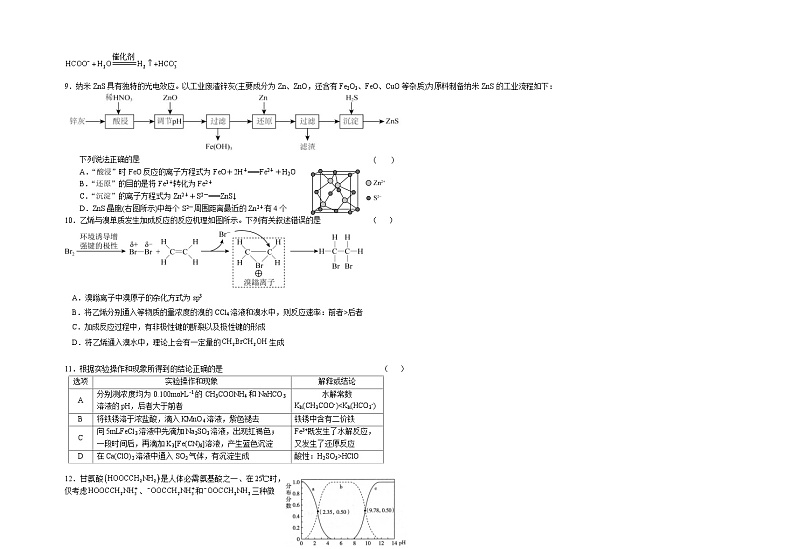
9.纳米ZnS具有独特的光电效应。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
下列说法正确的是 ( )
A.“酸浸”时FeO反应的离子方程式为FeO+2H+===Fe2++H2O
B.“还原”的目的是将Fe3+转化为Fe2+
C.“沉淀”的离子方程式为Zn2++S2-===ZnS↓
D.ZnS晶胞(右图所示)中每个S2-周围距离最近的Zn2+有4个
10.乙烯与溴单质发生加成反应的反应机理如图所示。下列有关叙述错误的是 ( )
A.溴鎓离子中溴原子的杂化方式为sp3
B.将乙烯分别通入等物质的量浓度的溴的CCl4溶液和溴水中,则反应速率:前者>后者
C.加成反应过程中,有非极性键的断裂以及极性键的形成
D.将乙烯通入溴水中,理论上会有一定量的生成
11.根据实验操作和现象所得到的结论正确的是 ( )
选项
实验操作和现象
解释或结论
A
分别测浓度均为0.100mol•L-1的CH3COONH4和NaHCO3溶液的pH,后者大于前者
水解常数
Kh(CH3COO-)HClO
12.甘氨酸是人体必需氨基酸之一、在时,仅考虑、和三种微粒,其分布分数()与溶液关系如图。[如中的分布系数:]。下列说法不正确的是 ( )
A.曲线a代表
B.两性离子的浓度在附近最大,说明两性离子的电离能力比水解强
C.的平衡常数
D.
13.甲醇脱氢法制HCOOCH3工艺过程涉及如下反应:
反应Ⅰ:2CH3OH(g)===HCOOCH3(g)+2H2(g); ΔH1=+135.4 kJ·mol-1
反应Ⅱ:CH3OH(g)===CO(g)+2H2(g); ΔH2=+106.0 kJ·mol-1
向容积为10 L的恒容密闭容器中通入1.0 mol CH3OH气体 发生上述反应,反应相同时间,测得CH3OH的转化率和HCOOCH3的选择性随温度变化如右图所示。(已知:HCOOCH3的选择性=2nHCOOCH3nCH3OH反应×100%)
下列说法正确的是( )
A. 553 K时,HCOOCH3的产量为0.1 mol
B. 虚线代表的是CH3OH的转化率
C. HCOOCH3(g)===2CO(g)+2H2(g)的ΔH=-76.6 kJ·mol-1
D. 低于553 K时,温度越高,生成的HCOOCH3越多;高于553 K时,温度越高,生成的CO越多。
二、非选择题:共4题。共61分
14.(16分)铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、 71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:
已知: Ⅰ.铍、铝元素化学性质相似,BeCl2熔融时能微弱电离。
Ⅱ.常温下部分难溶物的溶度积常数如下表:
难溶物
Cu(OH)2
Fe(OH)3
Mn(OH)2
溶度积常数(Ksp)
2.2×10-20
4.0×10-38
2.1×10-13
⑴ 滤液A的主要成分除NaOH外,还有 (填化学式),写出反应Ⅰ中含铍化合物
与过量盐酸反应的离子方程式: 。
⑵ ①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH
d.加入适量的HCl e.洗涤 f.过滤
② 从BeCl2溶液中获得BeCl2的晶体易带结晶水,但是将BeCl2晶体与SOCl2(易水解,产物
之一能使品红褪色)混合可得无水BeCl2,请从平衡移动角度解释原因:
。
⑶ MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的化学方程式:
。
⑷ 若滤液D中c(Cu2+)=2.2 mol·L-1、c(Fe3+)=0.0080 mol·L-1、c(Mn2+)=0.010 mol·L-1,缓慢通
氨气调节pH可将其依次分离。当Cu2+恰好完全沉淀[c(Cu2+)=1.0×10-5mol·L-1]时,
溶液中cCu2+cFe3+约为________。(22≈4.7,保留两位有效数字)
⑸ 电解NaCl-BeCl2混合熔盐可制备金属铍。
① 电解过程中,加入氯化钠的目的是
物质
熔点(K)
沸点(K)
Be
1551
3243
Na
370
1156
② 电解得到的Be蒸气中约含1%的Na蒸气,
除去Be中少量Na的方法为 。
已知部分物质的熔沸点如表:
15.(15分)有机化合物K是治疗胃炎药物的中间体,其合成路线如图所示:
已知:①;
②
③
回答下列问题:
(1)A(化学式C7H6O2)的结构简式为_______________。
(2)B→C的反应类型为_____________。
(3)写出G的结构简式:_________________________________________________________。
(4)H的同分异构体满足条件:①能与FeCl3溶液发生显色反应;②能发生银镜反应;③含有碳碳双键且苯环上有四个取代基。写出其中核磁共振氢谱中峰面积之比为2:2:2:1:1的有机物的结构简式:___________________________________________________。
(5)参照题中信息和合成路线,写出以和为原料制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
16.(15分) 以废锰酸锂电池为原料,回收MnO2、精铜的实验流程如下:
(1)“浸取”在如图所示装置中进行。
①将一定量“和石墨混合粉末”与H2SO4 溶液、H2O2溶液中的一种配成悬浊液,加入到三颈烧瓶中,75℃下通过滴液漏斗缓慢滴加另一种溶液。滴液漏斗中的溶液是___________。
②转化为MnSO4的化学方程式为 。
③保持温度、反应物和溶剂的量不变,能提高Mn元素浸出率的措施有_________。
(2) 补充以“铜箔和铝箔”为原料制备精铜的实验方案:
;
将所得精铜用蒸馏水洗净,干燥。实验中须使用的试剂溶液、不锈钢片、混合溶液,除常用仪器外须使用的仪器:直流电源。
(3)通过下列方法测定MnO2的纯度:准确称取0.4000g MnO2样品,加入25.00mL溶液和适量硫酸,加热至完全反应(发生反应为),用标准溶液滴定过量的至终点,消耗标准溶液20.00mL(滴定反应为)。计算样品中MnO2的质量分数(写出计算过程)_______。
17.(15分)气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及相关反应是新型科研热点。回答下列问题:
(1) 还原法:①用NH3催化还原NOx可以消除氮氧化物的污染。已知:
ⅰ:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH=-a kJ·mol-1
ⅱ:N2(g)+O2(g)=2NO(g) ΔH=b kJ·mol-1
写出NH3还原NO至N2和水蒸气的热化学方程式 。
②尿素水溶液热解产生的NH3可去除尾气中的NOx,流程如下:
a. 尿素废水使水体富营养化,通过电解法处理后可排放,其装置示意图如图所示,
该装置阳极的电极反应式为_______。
b.若氧化处理后的尾气中混有SO2,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低NOx的去除率。试分析硫酸盐的产生过程 。
③某脱硝反应机理如题17图-1所示,C2H4参与Ⅰ的反应方程式为 。
题17图-1
题17图-2
(2)氧化法:O3氧化性强于O2,能更有效地氧化NO。
Ⅰ:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1
Ⅱ:2O3(g)=3O2(g) ΔH2=-284.2 kJ·mol-1 (活化能Ea=119.2 kJ·mol-1)
Ⅲ:NO(g)+O3(g)=NO2(g)+O2(g) ΔH3=-199.1 kJ·mol-1 (活化能Ea=3.2 kJ·mol-1)
NO可经O3处理后再用碱液吸收而实现脱除。为分析氧化时温度对NO脱除率的影响,将NO与O3混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,NO脱除率随NO与O3混合反应温度变化如题17图-2所示。试分析在50~250℃范围内,随着温度的升高NO脱除率先几乎不变后下降的可能原因是 。
(3)研究表明氮氧化物的脱除率除了与还原剂、氧化剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以La0.8A0.2BCoO3+x (A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ. NO(g)+□→NO(a) Ⅱ.2NO(a)→2N(a)+O2(g)
Ⅲ.2N(a)→N IUTUQI :fId: IUTUQI 2(g)+2□ Ⅳ.2NO(a)→N2(g)+2O(a)
Ⅴ.2O(a)→O2(g)+2□
注:£表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B2023-01-19T16:09:08.4349124+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是 。
江苏省前黄中学2023届高三考前攀登行动(一)
化学试题参考答案与评分标准
单项选择题:本题包括13小题,每小题3分,共39分。每小题只有一个选项符合题意
1. B 2. D 3. B 4.C 5. C 6. B 7. C 8. D 9. D 10. B 11. C 12.D 13.D
14.(16分)
⑴ Na2BeO2、Na2SiO3 (2分) BeO22-+ 4H+== Be2+ + 2H2O (2分)
⑵ ①afed (2分)
②SOCl2 + H2OSO2 + 2HCl,SOCl2能吸收水,同时产生HCl,抑制BeCl2的水解 (3分)
⑶ MnO2 + CuS + 2H2SO4==MnSO4 + S + CuSO4 + 2H2O (2分)
⑷ 2.6×1010 (3分)
⑸ ①增强熔融物的导电性 (1分)
②可以控制温度在1156~3243K之间冷却 (1分)
15.【答案】(1)(2分)
(2)取代反应(2分)
(3)(3分)
(4)(3分)
(5)
(5分)
16(15分)
(1) ①. (1分)
②. ↑+8H2O (3分)
③. 适当加快搅拌速率;延长反应时间 (2分)
(2)边搅拌边向“铜箔和铝箔”中加入溶液,当溶液中不再产生气泡时,过滤;将铜箔压制成片并与直流电源正极相连,不锈钢片与直流电源负极相连,在混合溶液中电解,当铜箔完全溶解时取出不锈钢片,刮出精铜。 (5分)
(3)97.88% (4分)
根据可知,与MnO反应的C2O的物质的量:,0.4000 g样品中MnO2的物质的量:;;则样品中的质量分数。
17.(15分)
(1)①4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH= -(3b+a)kJ/mol (3分)
②a. CO(NH2)2-6e-+8OH-=+N2↑+6H2O (2分)
b.SO2与O2、H2O反应生成H2SO4,H2SO4与NH3反应生成(NH4)2SO4或者NH4HSO4 (2分)
说明:SO2与NH3、H2O反应生成(NH3)2SO3,(NH3)2SO3继续被O2氧化生成(NH4)2SO4也正确。
③ 2C2H4+6Cu+(NO2)=3N2+4CO2+4H2O+6Cu+ (3分)
(2)50~150 ℃时,O3分解的活化能高,反应速率慢,O3分解对反应Ⅲ的影响不大;温度高于150℃时,O3分解速率迅速增加,导致O3浓度下降,使NO脱除率下降(3分)
还原后催化剂中金属原子的个数不变,价态降低,氧缺位增多,反应速率加快。 (2分)
相关试卷
这是一份江苏省前黄高级中学2023-2024学年高三上学期期中适应性考试化学试卷(含答案),共21页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
这是一份江苏省前黄高级中学2022-2023学年高一下学期综合素质测试化学试卷(含答案),共13页。试卷主要包含了单选题,多选题,填空题等内容,欢迎下载使用。
这是一份江苏省前黄高级中学2023-2024学年高三上学期第一次阶段检测化学试卷,文件包含江苏省前黄高级中学2024届高三第一学期阶段检测化学试卷pdf、江苏省前黄高级中学2024届高三第一学期阶段检测化学参考答案docx等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。









