

湖北省荆荆宜三校2023届高三化学下学期5月联考试题(Word版附解析)
展开2023届高三下学期5月三校联考
高三化学试题
考试时间:2023年5月19日下午14:30-17:05 试卷满分:100分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Fe-56
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项符合题目要求
1. 化学与科学技术、生产生活息息相关,下列叙述正确的是
A. 聚氯乙烯属于有机高分子材料,可用于制作不粘锅的耐热涂层
B.氮氧化合物与“光化学烟雾”、“臭氧层空洞”、“硝酸型酸雨”的形成有关
C.食品包装袋中常放置硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质
D.我国新一代长征七号运载火箭使用的是液氧煤油发动机,煤油可由煤的干馏制得
2. 下列化学用语表示正确的是
A.NH3中N的杂化轨道表示式: B. Cl2的p-p σ键电子云轮廓图:
C.淀粉的分子式:(C6H12O6)n D. 1-丁炔的键线式:
3. NA为阿伏加德罗常数的值,下列说法正确的是
A.10 g 14N16O2和16O2混合气体中含有的质子数为5NA
B.标准状况下,22.4 L NO2含有的原子数目为3NA
C.常温下,1 L pH=9 的CH3COONa 溶液中,水电离出的 H+的数目为10-9NA
D.等物质的量的N2和C2H2所含有的电子数均为14NA
4. 下列反应的离子方程式正确的是
A. 二元弱碱N2H4与足量硫酸溶液反应:N2H4+H+ = N2H5+
B. 惰性电极电解饱和硫酸锌溶液:2Zn2+ + 2H2O 2Zn+4H++O2↑
C.向Fe(SCN)3溶液中滴加NaF溶液,红色褪去:Fe3++6F- = [FeF6]3-
D. Na2S2O3溶液中通少量Cl2:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
5. 三甲基铝[Al(CH3)3]在常温常压下为无色透明液体,与水反应剧烈生成一种可燃性气体。在一定溶剂中可发生如下反应:4[Al(CH3)3]+K2SO4=K2[Al4(CH3)12SO4]。下列推测不合理的是
A. Al(CH3)3是非极性分子,Al原子以sp2杂化
B. Al(CH3)3与水反应的方程式可能为Al(CH3)3+3H2O=3CH4↑+Al(OH)3↓
C. K2[Al4(CH3)12 SO4]中Al提供空轨道与SO42-中的S原子形成配位键
D.相同条件下和水反应的剧烈程度:Al(OCH3)3
6.某有机物的结构简式如图所示,下列说法正确的是
A. 该物质与H2加成的产物中含有3个手性碳原子,有光学活性
B. 该物质与碳酸钠、碳酸氢钠、钠都能反应
C. 1 mol该物质与足量溴水反应,最多可消耗4 mol Br2
D. 1 mol该物质与足量NaOH溶液反应,最多可消耗4 mol NaOH
7.有科学研究提出:锂电池负极材料(Li)由于生成LiH而不利于电池容量的保持。一定温度下,利用足量重水(D2O)与含LiH的Li负极材料反应,通过测定n(D2)/n(HD)可以获知n(Li)/n(LiH)。已知:①LiH+H2O = LiOH+H2↑,②2Li(s)+H2(g) ⇌ 2LiH(s) ΔH<0
下列说法错误的是
A.可用质谱区分D2和HD
B.Li与D2O的反应:2Li+2D2O = 2LiOD+D2↑
C.若n(Li)/n(LiH)越大,则n(D2)/n(HD)越小
D.80℃反应所得n(D2)/n(HD)比25℃反应所得n(D2)/n(HD)大
8. 化学是一门以实验为基础的学科。下列实验操作能达到目的的是
目的
操作
A
萃取碘水中的I2
将2mL丙酮加入适量碘水中,振荡,静置
B
分析检测含苯环的蛋白质
向蛋白质溶液中加入浓硝酸,加热
C
验证干燥的氯气是否具有漂白性
将有色鲜花放入盛有干燥氯气的集气瓶中
D
探究浓度对化学反应速率的影响
分别取0.1mol/L Na2S2O3 溶液1mL、2mL,向其中加入2mL 0.1mol/L H2SO4,比较出现浑浊快慢
9. 一种在300℃下工作的新型锂-二硫化亚铁热电池的截面结构如图所示,LLZTO导体管只允许Li+通过。当用1.8V电压充电后,电池正极材料中S、Fe的原子个数比为1.02(不计Li2S,下同);2.3V电压充电后,S、Fe的原子个数比为2.01。下列说法错误的是
A.Al2O3绝缘体隔离正负极,使化学能有效的转化为电能
B.电池工作时,负极发生反应:2Li+S2−−2e-=Li2S
C.电池正级材料的变化为FeS2 ⇌ FeS ⇌ Fe
D.电池总反应可表示为2xLi+FeS2 xLi2S+FeS2−x
10.有氧条件下,在Fe基催化剂表面,NH3还原NO的反应机理如图所示。该反应能够有效脱除烟气中的NO。下列说法错误的是
A.在酸性配位点上,NH3与H+通过配位键形成NH4+
B.增大压强有利于NO与O2吸附在Fe3+配位点上形成NO2
C.在反应过程中,有极性键和非极性键的断裂和形成
D.该反应的总方程式为:8NH3+6NO+3O2 = 7N2+12H2O
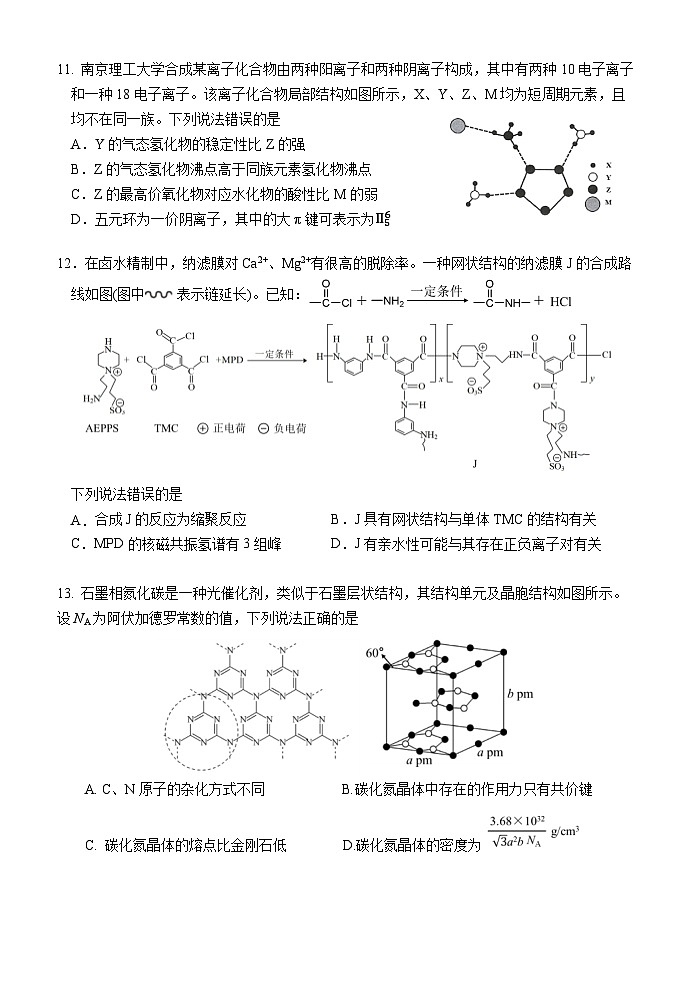
11. 南京理工大学合成某离子化合物由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。该离子化合物局部结构如图所示,X、Y、Z、M均为短周期元素,且均不在同一族。下列说法错误的是
A.Y的气态氢化物的稳定性比Z的强
B.Z的气态氢化物沸点高于同族元素氢化物沸点
C.Z的最高价氧化物对应水化物的酸性比M的弱
D.五元环为一价阴离子,其中的大π键可表示为Π56
12.在卤水精制中,纳滤膜对Ca2+、Mg2+有很高的脱除率。一种网状结构的纳滤膜J的合成路
线如图(图中表示链延长)。已知:
下列说法错误的是
A. 合成J的反应为缩聚反应 B.J具有网状结构与单体TMC的结构有关
C.MPD的核磁共振氢谱有3组峰 D.J有亲水性可能与其存在正负离子对有关
13. 石墨相氮化碳是一种光催化剂,类似于石墨层状结构,其结构单元及晶胞结构如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是
A. C、N原子的杂化方式不同 B.碳化氮晶体中存在的作用力只有共价键
C. 碳化氮晶体的熔点比金刚石低 D.碳化氮晶体的密度为
14. 某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号
I
II
III
实验步骤
充分振荡,加入2 mL蒸馏水
充分振荡,加入2 mL蒸馏水
充分振荡,加入2 mL蒸馏水
实验现象
铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象
铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀
铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀
下列说法错误的是
A.实验I、II、III中均涉及Fe3+被还原
B.对比实验I、II说明白色沉淀的产生与铜粉的量有关
C.实验II、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
15. 已知:酸碱质子理论认为,凡能给够出质子(H+)的物质是酸(如:NH4+),能接受质子的物质是碱(如:HS-),而酸给出质子转变为相应的碱,碱接受质子转变为相应的酸,这种得失质子可以相互转变的一对酸碱型体称为共轭酸碱对。常温下,调节HA溶液pH,含A微粒的分布系数δ随pH变化关系如图所示[比如HA的分布系数
δ=c(HA)c(HA)+c(A-)]。下列说法错误的是
A. A-是HA的共轭碱
B. Ka(HA)=10-5
C. 增大pH过程中,c(A-)c(HA)的值减小
D. 变化曲线上任意一点均满δ(HA)+δ(A-)=1.0
16. (14分)某兴趣小组研究FeSO4溶液与NaOH溶液反应过程中物质的变化。
(1)小组实验
如图,向2mL 0.1mol/L新制FeSO4溶液中滴加少量0.1mol/L NaOH溶液,
生成白色沉淀,迅速变成灰绿色,最终变为红褐色。写出沉淀由白色变成
红褐色的化学方程式 。
(2)探究灰绿色沉淀的成因
猜想1:白色沉淀吸附Fe2+,呈现灰绿色。
猜想2:铁元素部分被氧化后,Fe(Ⅱ)、Fe(Ⅲ)形成的共沉淀为灰绿色。
实验
操作
试剂(均为0.1mol/L)
实验现象
Ⅰ
向两片玻璃片中心分别滴加试剂i和ii,面对面快速夹紧
i.
ii.2滴NaOH溶液
玻璃片夹缝中有白色浑浊。分开玻璃片白色浑浊迅速变为灰绿色
Ⅱ
i. 2滴FeSO4溶液,
1滴Fe2(SO4)3溶液
ii.2滴NaOH溶液
玻璃片夹缝中立即有灰绿色浑浊
①将试剂i补充完整。
②根据实验现象得出结论,猜想 正确。
(3)探究灰绿色沉淀的结构和组成
资料:i. Fe(OH)2 层状结构示意图如右,OH-位于八面体的顶点,
Fe2+占据八面体中心。当部分Fe(Ⅱ)被氧化为Fe(Ⅲ)时,层状结构不被破坏。
ii. Fe2+在强酸性条件下不易被空气氧化;低浓度Cl-难以体现还原性。
iii. I2+2S2O32-=2I-+S4O62-。
称取一定量灰绿色沉淀,用稀盐酸完全溶解后,定容至250mL得样品液。
①小组同学根据资料推测:灰绿色沉淀的层间可能嵌入了SO42-,理由是 。
通过实验证实了该推测正确,实验操作和现象是 。
②取样品液100.00mL,测得其中SO42-的物质的量为6.4×10-4 mol。
③取样品液25.00mL,用0.0050mol/L 酸性KMnO4溶液滴定至终点,消耗KMnO4溶液
25.60mL,写出该滴定过程中反应的离子方程式 。
④取样品液25.00mL,加适量水及KI固体静置后,立即以0.0250mol/LNa2S2O3溶液滴定至浅黄色,在加入淀粉溶液滴定至蓝色恰好消失,消耗Na2S2O3溶液12.80mL。
结论:用Fe(Ⅱ)xFe(Ⅲ)y(OH)z(SO4)m表示灰绿色沉淀的组成,则此样品中x:y:z:m= (取最简整数比)。
17.(13分)有机物G是一种抗新型冠状病毒口服药的合成中间体,其合成路线如下,
回答下列问题:
(1)A的化学名称为 。
(2)C→D反应的化学方程式为 。
(3)E→F中被还原的官能团是 。
F→G的过程中F发生取代反应的官能团是 。
(4)在E的同分异构体中,同时满足下列条件的总数为 种,其中核磁共振氢谱有2
组峰的结构简式为 。
a.分子中含有苯环 b.能发生银镜反应 c.能发生水解反应
(5)已知B→C、C→D、D→E的产率分别约为85%、84%和80%,则B→E的总产率为
(计算结果保留一位小数)。
(6)化合物E的酸性强于苯甲酸的原因是 。
18.(14分)金属钇(Y)具有重要的国防价值,但因过度开采已濒临枯竭。通过硫酸浸泡深海磷灰石矿,可以得到Y3+的浸出液:
Al3+
Fe3+
Ca2+
PO43-
Mg2+
Mn2+
Y3+
浓度/(mg•L-1)
7670
9460
550
640
5600
1500
70.2
表1.浸出液成分
(1)浸出液可用有机溶剂(HR)进行萃取,实现Y3+的富集(已知:Y3+与Fe3+性质相似),原理如下:Fe3+ + 3HR FeR3 + 3H+ 、Y3+ + 3HR YR3 + 3H+ (已知:FeR3、YR3均易溶于HR)。浸出液在不同pH下萃取的结果如图1。
①用平衡移动原理解释,随pH增大,Y3+萃取率增大
的原因____________________。
②萃取Y3+时,为使Y3+萃取率≥50%,杂质离子
相对含量尽可能少,结合图1分析,萃取时
应控制的最佳pH为_____左右。
(2)采用“中和沉淀法”和“磷酸法”可以除铁。
中和沉淀法:向浸出液中加入NaOH除Fe3+,去除率如表2所示。
①Ksp[Fe(OH)3]___ Ksp[Y(OH)3](选填“>”或“<”)。 表2.Fe3+、Y3+去除率表
终点pH
去除率/%
Fe3+
Y3+
3.0
87.84
19.86
3.5
92.33
23.63
4.5
99.99
44.52
5.0
99.99
89.04
磷酸法:将磷酸(H3PO4:三元弱酸)加入到浸出液中,
再加入Na2CO3溶液,调pH为2.5,有气泡产生,过滤除
去磷酸铁(FePO4)沉淀,滤液中剩余的Fe3+、Y3+浓度如表3。
Fe3+
Y3+
浓度/(mg•L-1)
508
68.9
②“磷酸法”除铁过程中的离子方程式
。
③ 综合分析表1、表2、表3,工业上采用的最佳除铁方法
是________________(选填“中和沉淀法”或“磷酸法”)。
(3)经“磷酸法”除铁后,用有机溶剂HR萃取Y3+,可通过
________(填操作)收集含Y3+的有机溶液。 表3.滤液中Fe3+、Y3+的浓度
(4)综合分析以上材料,下列说法不合理的是________。
a. 分析图1可知,pH在0.2~2.0范围内,有机溶剂中的
Fe3+多于水溶液中的Fe3+
b. 表2中pH在3.0~3.5范围内,Y3+损失率在20%左右的原因可能是生成的Fe(OH)3对Y3+的吸附
c. 表2中pH在4.5~5.0范围内,Y3+损失率变大的可能原因:Y3+ + 3OH- = Y(OH)3↓
d. 有机溶剂萃取Y3+的优点是Ca2+、Mg2+、Mn2+等金属离子萃取率极低
19.(14分) 工业烟气中常含有NOx(NO、NO2)。用NaClO溶液将NOx氧化为NO3-,实现烟气中NOx的脱除。
(1)NOx在大气中会形成酸雨。形成酸雨的过程中,NO表现______性。
(2)向NaClO溶液中加入硫酸,研究初始pH对NOx脱除率的影响,结果如下。
已知:
①不用盐酸调节NaClO溶液初始pH的原因是________________________。
②将pH=3.5时NaClO溶液脱除NO的离子方程式(可逆)为 。
③pH<5.5时,分析NOx脱除率随溶液初始pH升高而增大的可能原因:_________________。
(3)用CrO3分别将脱除前后的NOx全部转化为NO2,并用库仑仪测定NO2的量,可计算NOx脱
除率。库仑仪工作的原理和装置如下:
检测前,电解质溶液中的c(I2)c(I-)保持定值时,电解池不工作。NO2进入电解池后与I-反应,
库仑仪便立即自动进行电解到c(I2)c(I-)又回到原定值,测定结束。通过测定电解消耗的电量可以求出NO2的物质的量。
①NO2在电解池中被I- 还原为NO的离子方程式为__________________。
②将脱除前、后等体积的烟气分别用上述装置进行测定,电解时转移电子的物质的量分别为amol、bmol。NOx脱除率是______。
③测量结束后,电解池中还检测到少量NO3-和NO2-,这将导致NO2测定结果______(填“偏高”或“偏低”),需进行校正。
2023届高三下5月三校第二次联考答案及解析
1.【答案】B
【详解】A. 不粘锅的耐热涂层是聚四氟乙烯,A错误;C. 硅胶、生石灰是干燥剂无法防止食品氧化,C错误;D. 煤油是石油分馏的产品,D错误。
2.【答案】A
【详解】C.淀粉的分子式是(C6H10O5)n,C错误。
3.【答案】A
【详解】A.10 g 14N16O2和16O2混合气体中,设14N16O2和16O2物质的量分别为x和y,根据混合气体总质量46x+32y=10,质子数为23x+16y=5,质子数为5NA,A正确;B. 标准状况下NO2不是气体,不能用气体摩尔体积计算,B错误;;C.常温下,1 L pH=9 的 CH3COONa 溶液中,水电离出的 H+的数目为10-5NA,C错误;D. 等物质的量的N2和C2H2所并未说明物质的量是1 mol,D错误。
4.【答案】B
【详解】A.二元弱碱N2H4与足量硫酸溶液反应生成N2H6(HSO4)2,A错误;C.Fe(SCN)3中Fe3+与SCN-以配位键结合形成配合物,不能拆,C错误;D.Na2S2O3溶液中通少量Cl2生成的H+与过量的Na2S2O3不共存,D错误。
5.【答案】C
【详解】A.[Al(CH3)3]中心原子Al形成3根σ键,为sp2杂化,空间结构为平面三角形,结构对称是非极性分子,A推测合理;[Al(CH3)3]与水反应生成一种可燃性气体,方程式可能为[Al(CH3)3]+3H2O=3CH4↑+Al(OH)3↓,B推测合理;C. 中心原子Al有空轨道,SO2- 4中的O原子有孤电子对,S无孤电子对,因此Al与O形成配位键,C推测不合理;D.原子半径C>O,键长Al-C>Al-O,因此[Al(OCH3)3]更稳定,与水反应不如[Al(CH3)3]剧烈,D推测合理。
6.【答案】D
【详解】A. 该物质与足量H2加成的产物只有2个手性碳,结构如图
A错误;B. 该物质含有酚羟基和醇羟基,可与碳酸钠和钠反应,不能与碳酸氢钠反应,B错误;C. 酚羟基含有邻位H,另外碳碳双键能和单质溴发生加成反应,所以最多消耗单质溴3 mol,C错误;分子中含酰胺基、碳溴键、酚羟基均能和氢氧化钠反应,1 mol该物质与足量NaOH溶液反应,最多可消耗4 mol NaOH,D正确;
7.【答案】C
【详解】A.D2和HD的相对分子质量不同,可以用质谱区分,A正确;B.类似于钠和水的反应, Li与D2O反应生成LiOD与D2,化学方程式是2Li+2D2O=2LiOD+D2↑,B正确;C.D2由Li与D2O反应生成,HD通过反应LiH+D2O=LiOD+HD↑,n(D2)/n(HD)越大,则n(Li)/n(LiH)越大,C错误;D.升高温度,2Li(s)+H2(g)⇌2LiH(s) △H<0,平衡左移,Li增多,LiH减少,则结合选项C可知:80℃下的n(D2)/n(HD)大于25℃下的n(D2)/n(HD) ,D正确;
8.【答案】B
【详解】A.丙酮与水互溶,不能用于萃取碘水中的I2,A错误;B. 含苯环的蛋白质可与浓硝酸发生显色反应,B正确;C. 有色鲜花中含有水,无法验证干燥的氯气是否具有漂白性,C错误;D. 探究浓度对化学反应速率的影响要控制变量,两组实验中溶液的体积不同,各反应物的浓度均不同,无法探究浓度对反应速率的影响,D错误。
9.【答案】B
【详解】A.为使化学能有效的转化为电能,需要用Al2O3绝缘体隔离正负极,A正确;B.LLZTO导体管只允许Li+通过,因此电池工作时负极发生反应:Li−e-=Li+,B错误;C.根据用1.8V电压充电后,电池正极材料中S、Fe的原子个数比为1.02(不计Li2S,下同);2.3V电压充电后,S、Fe的原子个数比为2.01,说明电池正级材料的变化为FeS2 ⇌ FeS ⇌ Fe,C正确。
10.【答案】D
【详解】A.NH3与H+通过配位键形成NH4+,A正确;B.由图可知,NO与O2吸附在Fe3+配位点上形成NO2,该过程中气体体积减小,增大压强平衡正向移动,B正确;C.在反应过程中,有O-O键的断裂和N-N键的形成,存在N-O键的断裂和N-H键的形成,C正确;D.中间产物NO2(NH4+)2中NO2和NH4+比例应为1:2,总方程式为:4NH3+4NO+O2 = 4N2+6H2O
11.【答案】B
【分析】物质由两种阳离子和两种阴离子构成,由图可知,M的离子半径最大,应该为18电子的离子,即M为Cl-,10电子离子应该为H3O+和NH4+,所以对应的元素分别为H、N、O和Cl,依据原子半径的关系可推知X为H、Y为O、Z为N、M为Cl。
【详解】A.O的电负性大于N,故H2O分子比NH3稳定,A正确;B.NH3的沸点知识比PH3、AsH3高,比SbH3、BiH3低,B错误。C.酸性:HNO3<HClO4,C正确。D.五元环为N5-,其中存在的大π键为Π56,D正确。
12.【答案】C
【详解】A.反应除生成高聚物J外,还有小分子HCl生成,该反应为缩聚反应,故A项正确;B.单体TMC中三个侧链均发生反应,使高聚物J形成网状结构,故B项正确; C.MPD的结构简式为,核磁共振氢谱中有4组峰,故C项错误;D.正、负离子容易与水形成水合离子,高聚物J有亲水性可能与其存在正负离子对有关。
13.【答案】D
【详解】A. 石墨相氮化碳类似于石墨层状结构,故N、C原子杂化相同,均为sp2杂化,A错误。B. 碳化氮晶体中存在的作用力除共价键外,还有层与层间的范德华力,B错误。C..原子半径:N
【分析】Cu和FeCl3溶液反应生成FeCl2和CuCl2,若铜过量,溶液黄色褪去,加入蒸馏水后生成白色沉淀,可能是发生了反应:CuCl2+Cu=2CuCl↓,据此分析解答。
【详解】A. 实验I、II、III中的现象为溶液黄色变浅或溶液黄色褪去,说明Fe3+被Cu还原,A正确;B. 对比实验I、II现象,说明白色沉淀的产生与铜粉的量有关,B正确;
C. 对比实验II、III,参加反应的Fe3+的量相同,则生成的Cu2+应相同,但由于实验II生成CuCl,所以加入蒸馏水后c(Cu2+)不相同,C错误;D. 实验III溶液为蓝色,含有Cu2+和过量的铜,向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀CuCl,D正确。
15.【答案】C
【详解】A.酸给出质子转变为相应的碱,HA给出质子得到A-,故A-是HA的共轭碱,A正确;B.由图可知,c(HA)=c(A-)时,pH=5,则Ka(HA)=10-5,B正确;
C.,增大pH过程中,氢离子浓度减小,则的值增大,C错误;D.根据A守恒可知,曲线上任意一点均满足δ(HA)+δ(A-)=1.0,D正确;
16.(14分)(每空2分)
(1)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(2) 2滴FeSO4溶液和1滴蒸馏水 2
(3)层状结构不被破坏,故根据电荷守恒可知,当部分Fe(Ⅱ)被氧化为Fe(Ⅲ)时,层间会引入阴离子平衡电荷。 取少量灰绿色沉淀加入足量的盐酸溶解,再加BaCl2溶液,生成白色沉淀,说明灰绿色沉淀的层间嵌入了SO42-(或取少量样品溶液于试管中,滴加氯化钡溶液生成白色沉淀) 5Fe2++MnO4-+8H+ =5Fe3++Mn2+ +4H2O 4:2:12:1
【详解】(1)向2mL0.1mol/L新制 FeSO4溶液中滴加少量0.1mol/LNaOH溶液,生成Fe(OH)2白色沉淀,迅速被O2氧化变为灰绿色,最终变成红褐色Fe(OH)3沉淀,反应为Fe(OH)2和氧气、水共同作用生成氢氧化铁,化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(2)①由实验操作可知,实验Ⅱ验证猜想2,实验Ⅰ验证猜想1,实验Ⅰ需要使用Fe2+过量且需要保证硫酸亚铁溶液的浓度与实验Ⅱ相同,则需要向两片玻璃片中心分别滴加2滴FeSO4溶液和1滴蒸馏水,然后再2滴NaoH溶液,面对面快速夹紧;
②实验Ⅰ、实验Ⅱ变量为是否存在三价铁,实验Ⅱ现象为玻璃片夹缝中立即有灰绿色浑浊,实验Ⅰ现象为玻璃片夹缝中有白色浑浊,分开玻璃片,白色浑浊迅速变为灰绿色;说明呈现灰绿色的原因是存在三价铁,故猜想2正确。
(3)①共沉淀物为灰绿色的原因是铁元素部分被氧化后,Fe(Ⅱ)、Fe(Ⅲ)形成的;Fe(OH)2层状结构中OH-位于八面体的顶点,Fe2+占据八面体的中心,两层间有空隙,当部分Fe(Ⅱ)被氧化为Fe(Ⅲ)时,层状结构不被破坏,故根据电荷守恒可知,当部分Fe(Ⅱ)被氧化为Fe(Ⅲ)时,层间会引入阴离子平衡电荷;硫酸根离子能和钡离子生成不溶于酸的硫酸钡沉淀,则证明SO42-的实验操作和现象是:取少量灰绿色沉淀加入足量的盐酸溶解,再加BaCl2溶液,生成白色沉淀,说明灰绿色沉淀的层间嵌入了SO42-;
③滴定过程中Fe2+被高锰酸钾氧化为Fe3+,高锰酸根离子被还原为锰离子同时生成水,离子方程式为:5Fe2++MnO4-+8H+ =5Fe3++Mn2+ +4H2O;
③滴定过程中Fe2+被高锰酸钾氧化为Fe3+,高锰酸根离子被还原为锰离子同时生成水,离子方程式为:5Fe2++MnO4-+8H+ =5Fe3++Mn2+ +4H2O;
17.(13分)
18. (14分)(每空2分)
(1)①Y3+在溶液中存在平衡:Y3++3HRYR3+3H+,pH增大,c(H+) 减小(或c(OH-)
增大),平衡右移,Y3+萃取率提高 ②1.5
(2)①< ②2Fe 3++2 H3PO4+ 3CO32-= 2FePO4↓+ 3CO 2↑+3H2O ③磷酸法
(3)分液 (4)a
【详解】考查化学反应原理的综合运用,(1)①Y3+的溶液中存在:Y3++3HRYR3+3H+,pH增大,c(H+)减小,根据勒夏特列原理,平衡向正反应方向移动,Y3+的转化率增大,即Y3+萃取率提高;②为使Y3+萃取率≥50%,且杂质离子尽可能少,最佳pH应为1.5左右
(2)①表2采用的是中和沉淀法,通过调节pH,Fe3+去除率高,其原因可能是Ksp[Fe(OH)3]
19. (14分)(每空2分)
(1)还原
(2)①盐酸具有还原性,能与NaClO反应
②
③溶液初始pH高,c(H+)小,有利于和正向进行,NOx脱除率大
(3)①
②
③偏低
湖北省宜荆荆随2023-2024学年高三化学上学期10月联考试题(Word版附解析): 这是一份湖北省宜荆荆随2023-2024学年高三化学上学期10月联考试题(Word版附解析),共18页。试卷主要包含了选择题的作答,非选择题的作答,某神经类药物的结构如图所示,下列说法正确的是等内容,欢迎下载使用。
湖北省荆荆宜三校2023届高三下学期5月联考化学试题(含解析): 这是一份湖北省荆荆宜三校2023届高三下学期5月联考化学试题(含解析),共23页。试卷主要包含了单选题,实验题,有机推断题,工业流程题,原理综合题等内容,欢迎下载使用。
湖北省荆荆宜三校2023届高三化学下学期5月联考试题(Word版附答案): 这是一份湖北省荆荆宜三校2023届高三化学下学期5月联考试题(Word版附答案),共8页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












