

山东省烟台市2023届高三下学期适应性练习(二)化学试题(Word版含答案)
展开烟台市2023届高三下学期适应性练习(二)
化学
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对姓名、考生号和座号。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H1 Li7 C12 N14 O16 S32 Fe56 Zn65 Se79
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学与科技、生产、生活密切相关,下列说法正确的是( )
A.医用酒精和含氯消毒液杀灭流行性病毒的原理相同
B.聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层
C.聚乳酸酯的降解和油脂的皂化都是高分子生成小分子的过程
D.“嫦娥五号”配置的砷化镓太阳能电池将化学能直接转化为电能
2.茶叶中铁元素的检验可经过以下四步完成:灼烧灰化→6mol•L⁻¹硝酸溶解→过滤→检测滤液中的铁元素。下列说法正确的是( )
A.“灼烧灰化”选用的玻璃仪器有①②③
B.④用于配制硝酸时需洗净并烘干
C.“过滤”吋需沿②向⑤中转移液体并小心搅拌
D.检测铁元素时,⑥悬垂于⑦的上方滴加KSCN溶液
3.我国高分子科学家对聚乙烯进行胺化修饰,并进一步制备新材料,合成路线如图:
下列说法错误的是( )
A.a→c为加成反应 B.b的核磁共振氢谱有2组峰
C.c不存在立体异构 D.d能与水形成氢键
4.实验室中下列做法错误的是( )
A.用除去NO中混有的少量
B.苯酚的浓溶液不慎沾在皮肤上,立即用酒精清洗
C.用盐酸滴定未知浓度的溶液,选用甲基橙作指示剂
D.分液漏斗使用前加入少量水,观察到旋塞处不漏水即可使用
5.设为阿伏加德罗常数的值,下列说法错误的是( )
A.1 mol Cu和Na分别与足量硫粉反应时,转移的电子数均为
B.铅蓄电池放电时,jE极质量增加9.6 g,电路中通过的电子数目为
C.标准状况下4.48 L NH₃溶于水得到的溶液中,和的总数小于
D.金刚石晶体密度为,则晶体中碳原子的最小间距为 pm
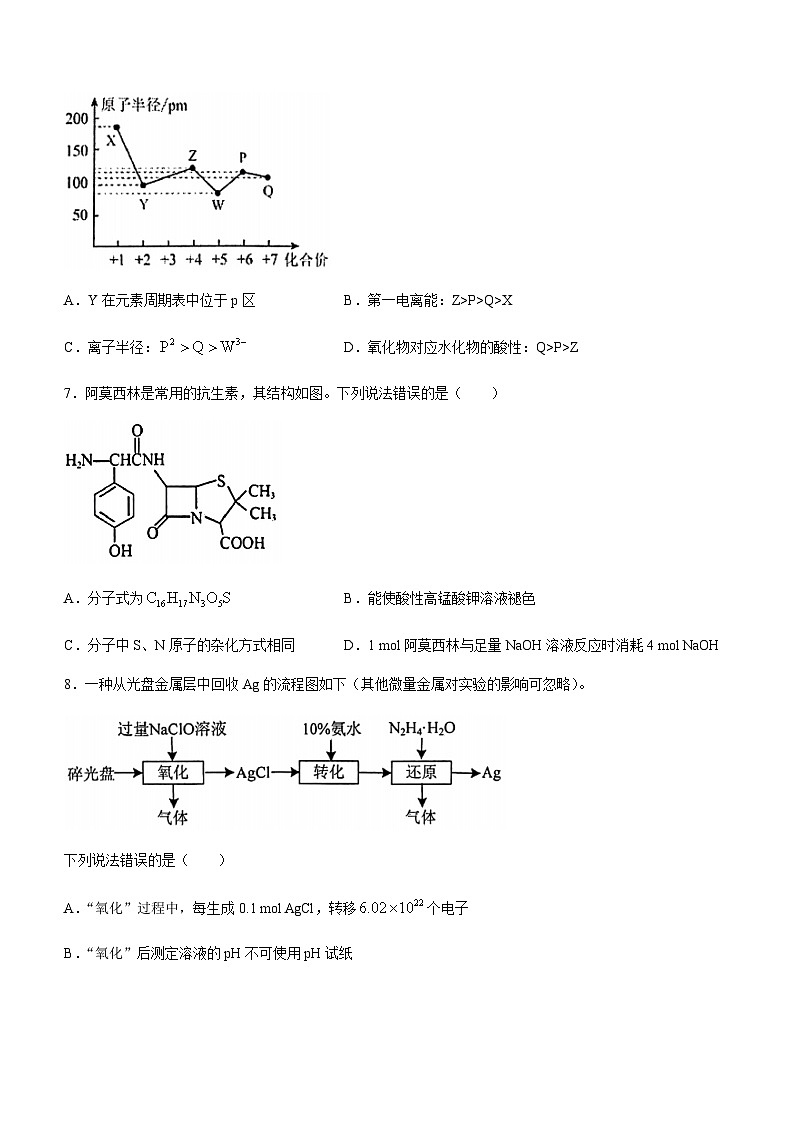
6.X、Y、Z、W、P、Q为短周期元素,其中Y的原子序数最小,它们的最高正价与原子半径关系如图所示。下列说法正确的是( )
A.Y在元素周期表中位于p区 B.第一电离能:Z>P>Q>X
C.离子半径: D.氧化物对应水化物的酸性:Q>P>Z
7.阿莫西林是常用的抗生素,其结构如图。下列说法错误的是( )
A.分子式为 B.能使酸性高锰酸钾溶液褪色
C.分子中S、N原子的杂化方式相同 D.1 mol阿莫西林与足量NaOH溶液反应时消耗4 mol NaOH
8.一种从光盘金属层中回收Ag的流程图如下(其他微量金属对实验的影响可忽略)。
下列说法错误的是( )
A.“氧化”过程中,每生成0.1 mol AgCl,转移个电子
B.“氧化”后测定溶液的pH不可使用pH试纸
C.“转化”时的离子方程式为
D.“还原”过程中生成的气体可能是
9.3-氨基-1-金刚烷醇是一种重要的医药中间体,其分子结构如图。下列说法正确的是( )
A.分子中H、O之间形成s-pσ键
B.分子间存在4种氢键
C.该物质存在芳香族化合物的同分异构体
D.分子中带有*的碳原子均为手性碳原子
10.盐酸羟胺()可用作合成抗癌药,其化学性质类似。工业上制备盐酸羟胺的装置及含Fe的催化电极反应机理如图。下列说法正确的是( )
A.电子从含Fe的催化电极流出沿导线流入Pt电极
B.电池工作一段时间后,正极区溶液的pH减小
C.电池工作时,当有标准状况下3.36 L 参与反应,左室溶液质量增加3.3 g
D.X为和,Y为
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全
部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列由实验操作和现象推出的结论错误的()
| 实验操作和现象 | 结论 |
A | 向含有ZnS和的白色悬浊液中滴加少量溶液,有黑色沉淀生成 | |
B | 向和KOH的绿色混合溶液中通入,溶液变为紫红色 | 碱性条件下,氧化性: |
C | 向铁粉与水蒸气高温反应后的固体中加入稀硫酸,溶解后加入KSCN溶液,溶液未变红 | 铁粉与水蒸气反应生成FeO |
D | 常温下,将50 mL苯与50 mL 混合,得到101 mL混合液 | 苯减弱了分子间的氢键 |
12.二甲基砜是重要的有机合成中间体,可采用“成对间接电氧化”法合成。电解槽中某电极区反应过程如图所示,其电解液显碱性。
下列说法正确的是( )
A.电极反应式为
B.离子交换膜为阴离子交换膜
C.反应前后不变
D.消耗1 mol氧气,理论上可得到1 mol二甲基砜惰性电极离子交换膜
13.实验室对某铁的氧化物()进行如下实验。下列说法错误的是( )
A.
B.溶液A为和混合溶液
C.反应②生成标准状况下1.12 L
D.Zn至少参加了3个氧化还原反应4.73 g固体
14.湿法炼锌的净化钴渣中含有Zn、Co、Cu和Fe的单质及,利用过硫酸钠氧化水解法制备,同时分别回收锌、铜和铁元素的工艺流程如下,可能用到的数据见下表。
| ||||
开始沉淀pH | 1.9 | 4.2 | 6.2 | 7.7 |
沉淀完全pH | 3.2 | 6.7 | 8.2 | 9.2 |
下列说法错误的是( )
A.固体X主要成分是Cu,金属M为Zn
B.根据流程可知:的还原性弱于
C.调pH的范围为3.2~7.7
D.“沉钴”反应的离子方程式为
15.常温下,用0.1 mol⋅L NaOH溶液滴定10 mL 和HA混合溶液,滴定过程中HA和分布系数及pH随NaOH溶液体积变化如图。
已知,下列说法正确的是( )
A.起始 mol⋅L
B.时,
C.溶液显碱性[已知 mol⋅L]
D.可利用甲基紫(变色范围为2.0~3.0)确定第一滴定终点
三、非选择题:本题共5小题,共60分。
16.(12分)金属锂溶于液氨可得到具有高反应活性的金属电子溶液,与其作用可制得超导体,进一步可制得超导材料。
回答下列问题:
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有______种,下列状态的铁中,电离最外层一个电子所需能量最大的是______(填标号)
A. B.C. D.
(2)液氨可以发生微弱的电离生成和,下列说法错误的是( )。
A.键角: B.结合质子能力:
C.热稳定性: D.与的分子构型及N的化合价均相同
(3)可与邻二氮菲形成红色配合物,结构如图所示。元素的电负性从大到小的顺序为______(填元素符号)。配合物中N原子的VSEPR模型为____________;下列对Fe杂化方式推断合理的是______(填标号)。
A. B. C. D.
(4)晶体属四方晶系,其结构由铁硒层和锂铁氢氧层交替堆垛而成,晶胞中铁硒层在bc、ac和ab平面投影如图所示。铁硒层中Fe原子的配位数是______,铁硒层和锂铁氢氧层之间由极其微弱的氢键相连,该氢键可表示为______。已知锂铁氢氧层中锂铁个数之比为4∶1,阿伏加德罗常数的值为,则该晶体的密度为______g·cm。
17.(12分)以电解金属锰阳极渣(主要成分为,杂质为Pb、Fe、Ca、Mg元素的化合物)和黄铁矿(杂质为)为原料制备的工艺流程如下:
已知:,。
回答下列问题:
(1)为提高酸浸效果,可采取的措施有______(写出两项)。
(2)“酸浸”过程中没有S单质生成,滤渣①的主要成分为(填化学式);参与反应的离子方程式为____________。
(3)向氧化过滤后的溶液中加入HF以除去溶液中钙元素和镁元素,除钙前滤液中(浓度为 mol⋅L,当溶液中 mol⋅L时,除钙率为______。
(4)将“碱化”步骤所得含少量的固体加去离子水打成浆,通空气氧化过程溶液pH随时间变化如图所示,pH先基本不变后迅速下降的原因为____________。
(5)向滤液④中加入氧化钙,可得到在上述流程中循环利用的物质是____________;“一系列操作”包括____________。
18.(13分)醋酸亚铬水合物是一种砖红色晶体,可作氧气吸收剂,微溶于乙醇,不溶于冷水和乙醚。实验室以Zn粉、盐酸、溶液、溶液为原料制备的装置如图。
实验操作:①检查装置气密性,向仪器中加入药品;②加入适量溶液,甲中溶液由绿色逐渐变为亮蓝色;③关闭,打开、,向三颈烧瓶中滴加试剂a;④当丙中有均匀气泡冒出时,……;当乙中析出大量砖红色沉淀时,关闭;⑤将乙中混合物过滤、洗涤和干燥,得到。
回答下列问题:
(1)试剂b为____________;补充完整④中的操作____________;步骤③中滴加试剂a的作用是____________。
(2)装置乙中反应的化学方程式为__________________。
(3)丙中水的作用是____________。
(4)步骤⑤中的过滤用如图所示装置进行,与普通过滤相比,优点是__________________。
(5)为标定实验所用的溶液的浓度,进行如下实验:
取25.00 mL 溶液于碘量瓶(一种带塞的锥形瓶)中,加入适量,充分反应后加入过量稀至溶液呈强酸性,此时铬元素以形式存在。再加入足量KI溶液,塞紧瓶塞,摇匀充分反应使完全转化为。滴加2~3滴淀粉溶液,用0.25mol⋅L 溶液滴定,达终点时消耗溶液24.00 mL。(已知:)
①溶液的物质的量浓度为_____________。
②下列情况会导致浓度测定值偏低的是_______(填标号)。
A.溶液因久置水解产生少量浑浊[固体]
B.盛溶液的滴定管滴定前有气泡,滴定后无气泡
C.用滴定管量取溶液时,先俯视后仰视
D.滴定达终点时发现滴定管尖嘴外挂有一滴液珠未滴落
19.(12分)抗癌新药M的一种合成路线如下:
已知:Ⅰ.
Ⅱ.,X=卤素原子
Ⅲ.
回答下列问题:
(1)A的名称为__________;A→B的反应条件为________;写出符合下列条件的B的同分异构体的结构简式________________。
①仅含有苯环、和②含有4种化学环境的氢
(2)C中含氧官能团的名称为________;E→F反应的目的是________;F→G的反应类型为________。
(3)D+H→I的反应方程式为________________________。
(4)根据上述信息,写出以1,4-丁二醇、对硝基甲苯为主要原料制备的合成路线。
20.(11分)丙烯是重要的化工原料,丙烷直接脱氢制丙烯的相关反应及能量变化如图。
回答下列问题:
(1)主反应的焓变______0(填“>”或“<”);在600℃、1MPa条件下,丙烷脱氢制丙烯反应到达平衡,测得、的体积分数均为30%,则此时的体积分数为____________。
(2)向密闭容器中充入,发生主反应:(忽略副反应的发生)。
①测得反应速率方程为,k为反应速率常数。已知:(R、C为常数,T为温度,Ea为活化能)。实验测得其他条件相同,不同催化剂Cat1、Cat2对k的影响如图甲所示,则催化效能较高的是______(填“Catl”或“Cat2”)。
②在100 kPa、10 kPa不同起始压强下达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图乙所示。起始压强为10 kPa,丙烷、丙烯随温度变化的物质的量分数曲线分别是______、______(填代号);A点对应的平衡常数______kPa(为以分压表示的平衡常数);B点丙烷的平衡转化率为______。
化学参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.B 2.D 3.C 4.D 5.D 6.C 7.A 8.A 9.B 10.C
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.AC 12.CD 13.B 14.C 15.BD
三、非选择题
16.(12分)
(1)3(1分)C(1分)
(2)BD(2分)
(3)N>C>H>Fe(1分)平面三角形(1分)C(1分)
(4)4(2分)O—HSe(1分)(2分)
17.(12分)
(1)适当增大稀硫酸浓度或升高温度或粉碎或搅拌(2分)
(2)、、(2分)
(2分)
(3)99.7%(2分)
(4)开始时被氧化生成水,溶液pH无明显变化;7h后被氧化,生成,溶液pH减小(或,故溶液pH无明显变化;,溶液pH减小)(2分)
(5)或氨水(1分)过滤、洗涤、干燥(1分)
18.(13分)
(1)溶液(1分)关闭,打开(1分)与Zn粉反应产生氢气,排净装置中的空气,防止被氧化(2分)
(2)(2分)
(3)液封,防止产品被氧化(1分)
(4)快速过滤、产品易于干燥(2分)
(5)①0.08 mol·L(2分)②AC(2分)
19.(12分)
(1)邻甲基苯甲酸(或2-甲基苯甲酸)(1分)浓硫酸,加热(1分)
、(2分)
(2)硝基、酯基(1分)保护氨基(1分)取代反应(1分)
(3)(2分)
(4)(3分)
20.(11分)
(1)>(1分) 5%(2分)
(2)①Cat2(2分)
②d(1分) b(1分) 12.5(2分) 66.7%(2分)
山东省烟台市2023届高三下学期二模化学试题(Word版含答案): 这是一份山东省烟台市2023届高三下学期二模化学试题(Word版含答案),共15页。试卷主要包含了某聚合物Z的合成路线如下,实验室通过反应,PCl₅晶体的晶胞结构如图等内容,欢迎下载使用。
山东省烟台市2023届高三下学期二模化学试题: 这是一份山东省烟台市2023届高三下学期二模化学试题,共12页。试卷主要包含了某聚合物Z的合成路线如下,实验室通过反应,PCl₅晶体的晶胞结构如图等内容,欢迎下载使用。
2022届山东省烟台市高三下学期三模化学试题PDF版含答案: 这是一份2022届山东省烟台市高三下学期三模化学试题PDF版含答案












