



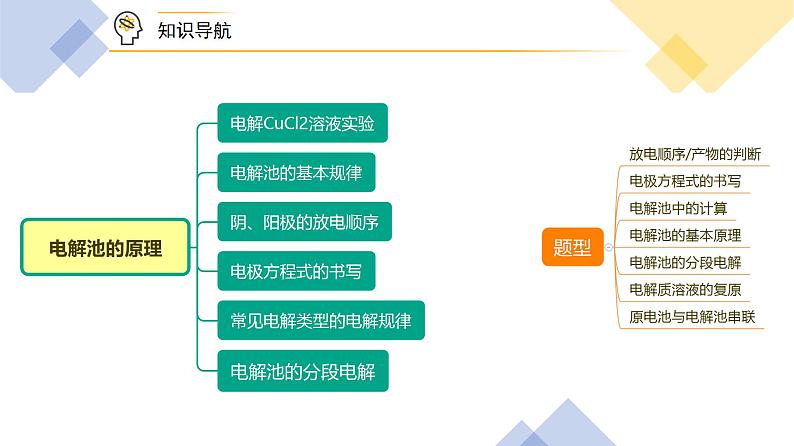

高中化学人教版 (2019)选择性必修1第二节 电解池获奖ppt课件
展开高中化学新教材特点分析及教学策略
(一)化学基本概念和化学基本理论:全套教材的知识安排,注意各年级内及各年级间的联系,在保证知识结构的系统性和完整性的同时,对内容的安排采用了将各部分知识分散处理,相对集中的方法。
(二)元素化合物知识:关于元素化合物知识,高一教材首先介绍了碱金属和卤素两个最典型的金属族和非金属族。
(三)化工基础知识:高一介绍了硅酸盐工业和环境保护知识。高二主要介绍合成氨工业,删掉了硝酸工业、钢铁工业和铝的冶炼。重点突出了合成氨工业中合成氨条件的选择。
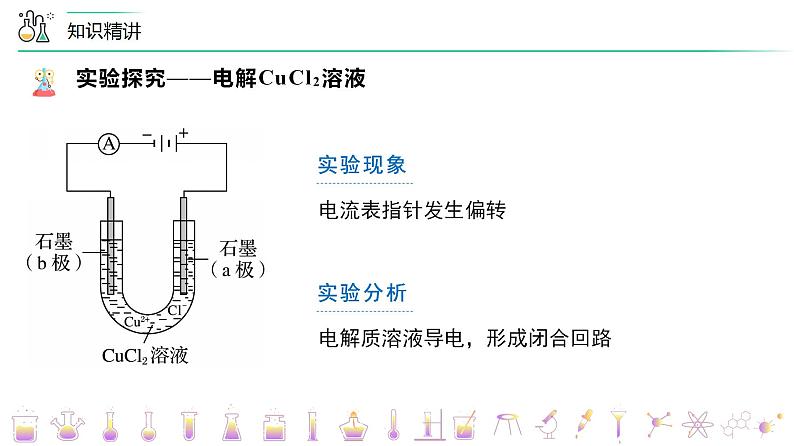
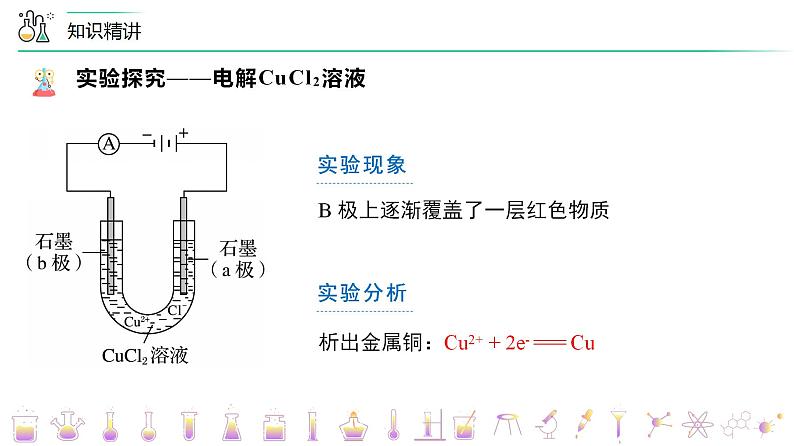
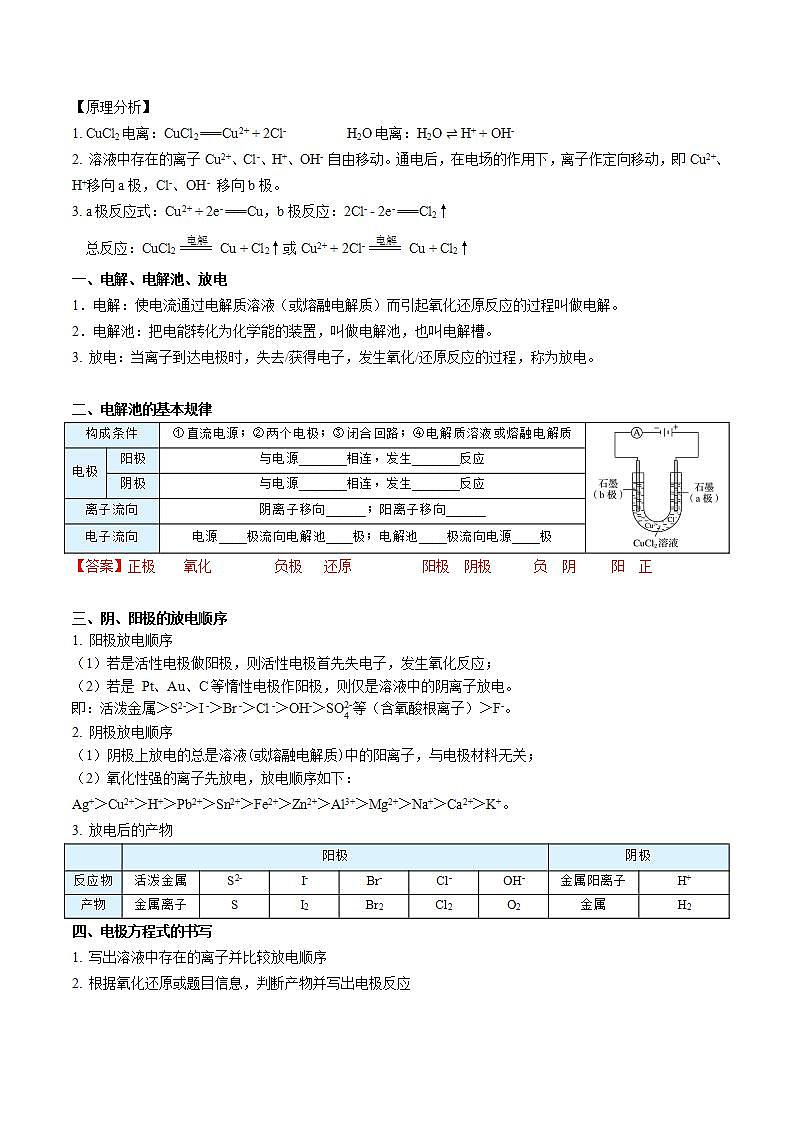
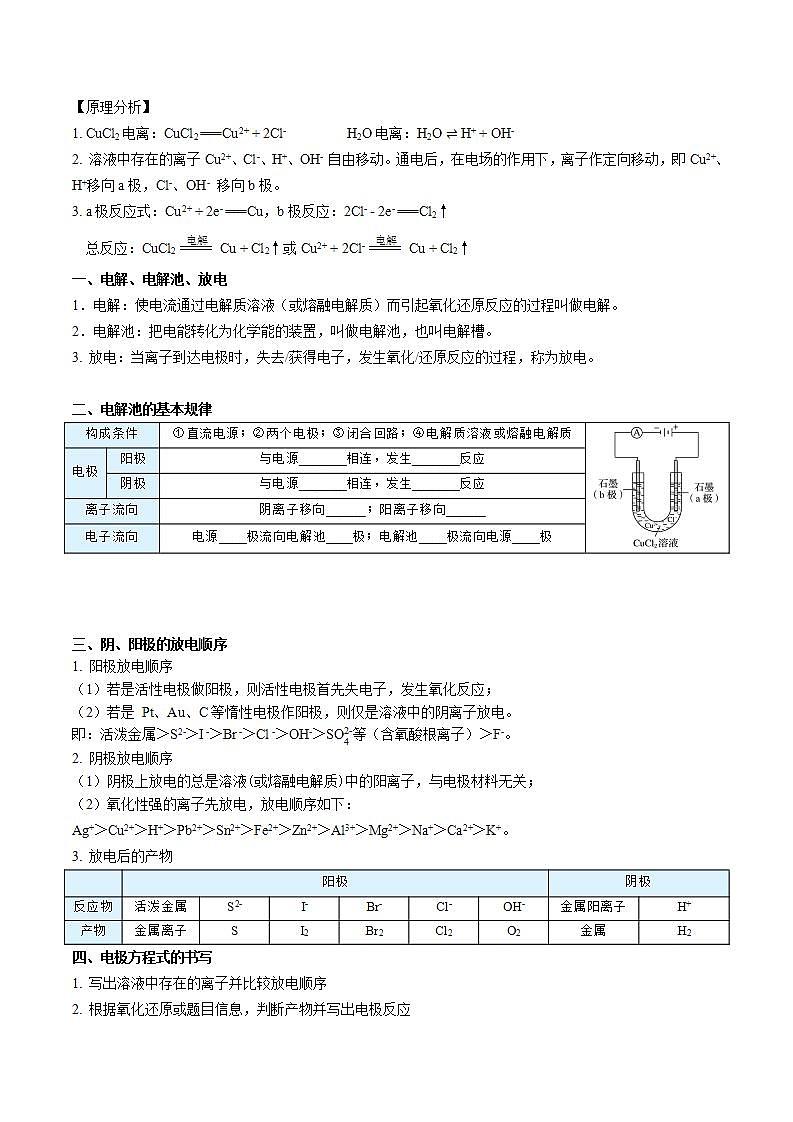
实验探究——电解CuCl2溶液
实验操作 | 实验现象 | 实验分析 |
电流表指针发生偏转 | 电解质溶液导电,形成闭合回路 | |
b极上逐渐覆盖了一层红色物质 | 析出金属铜,Cu2+ + 2e- === Cu | |
a极上产生刺激性气味的气体,使湿润的碘化钾淀粉试纸变蓝 | 产生了氯气,2Cl- - 2e- === Cl2↑ | |
电解CuCl2溶液的总反应:CuCl2 Cu + Cl2↑ | ||
【原理分析】
1. CuCl2电离:CuCl2 === Cu2+ + 2Cl- H2O电离:H2O H+ + OH-
2. 溶液中存在的离子Cu2+、Cl-、H+、OH- 自由移动。通电后,在电场的作用下,离子作定向移动,即Cu2+、H+移向a极,Cl-、OH- 移向b极。
3. a极反应式:Cu2+ + 2e- === Cu,b极反应:2Cl- - 2e- === Cl2↑杨sir化学,侵权必究
总反应:CuCl2 Cu + Cl2↑或Cu2+ + 2Cl- Cu + Cl2↑
一、电解、电解池、放电
1.电解:使电流通过电解质溶液(或熔融电解质)而引起氧化还原反应的过程叫做电解。
2.电解池:把电能转化为化学能的装置,叫做电解池,也叫电解槽。
3. 放电:当离子到达电极时,失去/获得电子,发生氧化/还原反应的过程,称为放电。
二、电解池的基本规律
构成条件 | ①直流电源;②两个电极;③闭合回路;④电解质溶液或熔融电解质 | ||
电极 | 阳极 | 与电源_______相连,发生_______反应 | |
阴极 | 与电源_______相连,发生_______反应 | ||
离子流向 | 阴离子移向______;阳离子移向______ | ||
电子流向 | 电源____极流向电解池____极;电解池____极流向电源____极 | ||
【答案】正极 氧化 负极 还原 阳极 阴极 负 阴 阳 正
三、阴、阳极的放电顺序
1. 阳极放电顺序
(1)若是活性电极做阳极,则活性电极首先失电子,发生氧化反应;
(2)若是 Pt、Au、C等惰性电极作阳极,则仅是溶液中的阴离子放电。
即:活泼金属>S2->I ->Br ->Cl ->OH->等(含氧酸根离子)>F-。杨sir化学,侵权必究
2. 阴极放电顺序
(1)阴极上放电的总是溶液(或熔融电解质)中的阳离子,与电极材料无关;
(2)氧化性强的离子先放电,放电顺序如下:
Ag+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+。
3. 放电后的产物
| 阳极 | 阴极 | ||||||
反应物 | 活泼金属 | S2- | I- | Br- | Cl- | OH- | 金属阳离子 | H+ |
产物 | 金属离子 | S | I2 | Br2 | Cl2 | O2 | 金属 | H2 |
四、电极方程式的书写
1. 写出溶液中存在的离子并比较放电顺序
2. 根据氧化还原或题目信息,判断产物并写出电极反应
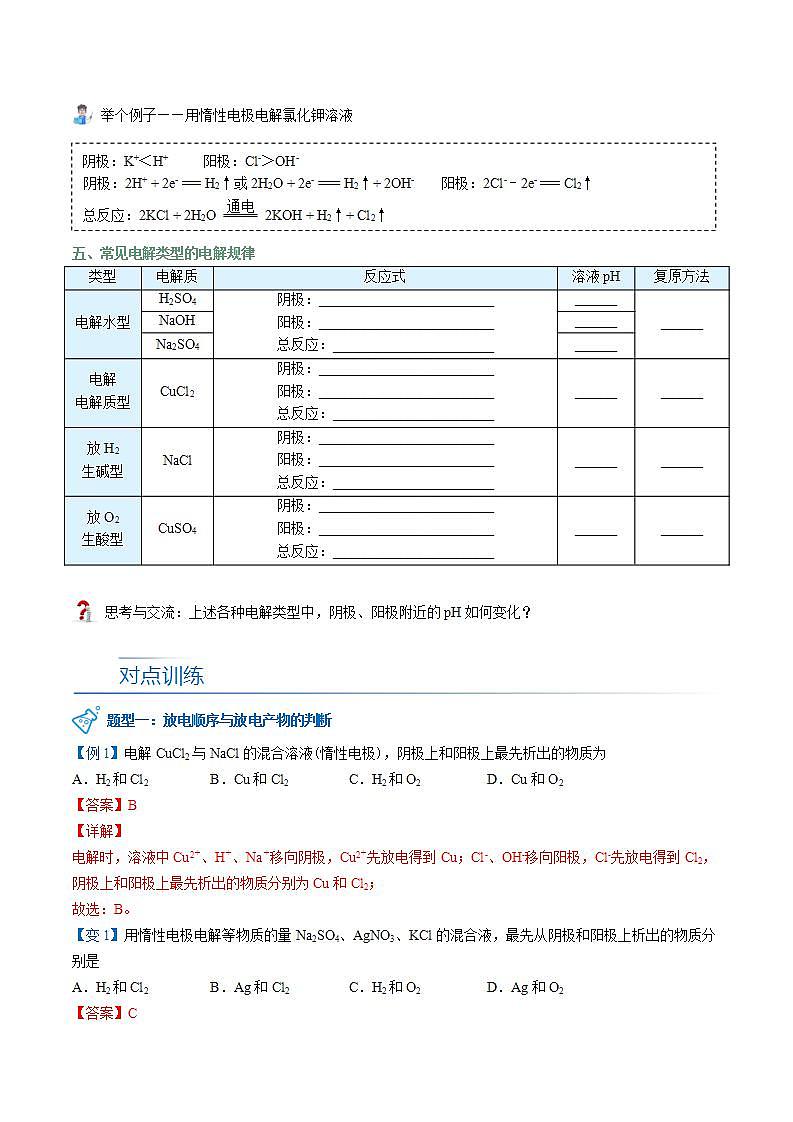
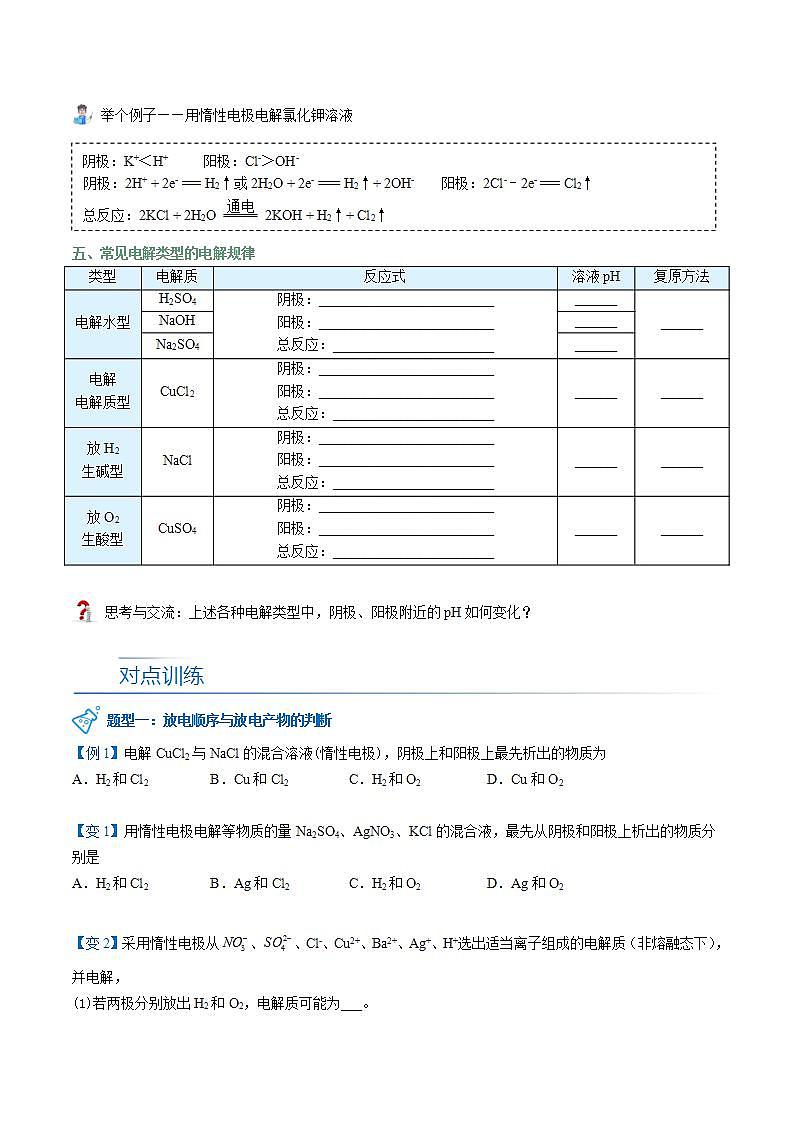
举个例子——用惰性电极电解氯化钾溶液杨sir化学,侵权必究
五、常见电解类型的电解规律
类型 | 电解质 | 反应式 | 溶液pH | 复原方法 |
电解水型 | H2SO4 | 阴极:_________________________ 阳极:_________________________ 总反应:_______________________ | ______ | ______ |
NaOH | ______ | |||
Na2SO4 | ______ | |||
电解 电解质型 | CuCl2 | 阴极:_________________________ 阳极:_________________________ 总反应:_______________________ | ______ | ______ |
放H2 生碱型 | NaCl | 阴极:_________________________ 阳极:_________________________ 总反应:_______________________ | ______ | ______ |
放O2 生酸型 | CuSO4 | 阴极:_________________________ 阳极:_________________________ 总反应:_______________________ | ______ | ______ |
思考与交流:上述各种电解类型中,阴极、阳极附近的pH如何变化?
题型一:放电顺序与放电产物的判断杨sir化学,侵权必究
【例1】电解CuCl2与NaCl的混合溶液(惰性电极),阴极上和阳极上最先析出的物质为
A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2
【答案】B
【详解】
电解时,溶液中Cu2+、H+、Na+移向阴极,Cu2+先放电得到Cu;Cl-、OH-移向阳极,Cl-先放电得到Cl2,阴极上和阳极上最先析出的物质分别为Cu和Cl2;
故选:B。
【变1】用惰性电极电解等物质的量Na2SO4、AgNO3、KCl的混合液,最先从阴极和阳极上析出的物质分别是
A.H2和Cl2 B.Ag和Cl2 C.H2和O2 D.Ag和O2
【答案】C
【详解】
用等物质的量的Na2SO4、AgNO3、KCl的混合液中,首先生成AgCl沉淀,实际电解Na2SO4和KNO3,相当于电解水,两极分别生成H2和O2,故选C。
【变2】采用惰性电极从、、Cl-、Cu2+、Ba2+、Ag+、H+选出适当离子组成的电解质(非熔融态下),并电解,
(1)若两极分别放出H2和O2,电解质可能为___。
(2)若阴极析出金属,阳极放出O2,电解质可能为___。
(3)若两极分别放出气体,且体积比为1:1,电解质可能为___。杨sir化学,侵权必究
(4)若既无O2也无H2放出,则电解质可能为___。
【答案】Ba(NO3)2、H2SO4、HNO3 AgNO3、Cu(NO3)2、CuSO4 HCl、BaCl2 CuCl2
【分析】
阴极上阳离子放电顺序为Ag+>Cu2+>H+>Ba+,阳极上阴离子放电顺序为Cl->OH->、,
根据电极产物判断阴阳极放电的离子,从而确定溶液中的电解质。
【详解】
阴极上阳离子放电顺序为Ag+>Cu2+>H+>Ba2+,阳极上阴离子放电顺序为Cl−>OH−>含氧酸根,
(1)当阴极放出H2,阳极放出O2时,则阴极H+放电,阳极OH−放电,则溶液中的阴离子为硫酸根或硝酸根,阳离子是H+或Ba2+,BaSO4为沉淀,所以电解质是Ba(NO3)2、H2SO4、HNO3;
故答案为Ba(NO3)2、H2SO4、HNO3;
(2)当阴极析出金属时,阴极为Cu2+或Ag+放电,阳极放出O2,阳极为OH−放电,则溶液中的阴离子为硫酸根或硝酸根,电解质是AgNO3、Cu(NO3)2、CuSO4,
故答案为AgNO3、Cu(NO3)2、CuSO4;
(3)若两极分别放出气体,且体积比为1:1,则阴极放出H2,阳极放出Cl2,阴极为H+放电,溶液中的阳离子为H+或Ba2+,阴离子为Cl−放电,溶液中的阴离子为Cl−,所以电解质为HCl、BaCl2;
故答案为HCl、BaCl2;
(4)电解过程中既无O2也无H2放出,则阴极上析出金属,阴极为Cu2+或Ag+放电,阳极上产生氯气,阴离子为Cl−放电,AgCl为沉淀,则电解质应为CuCl2;
故答案为CuCl2。
【点睛】
电解池中阴阳极放电顺序的判断方法:
(1)阴极:阴极上放电的总是溶液中的阳离子,与电极材料无关。金属活动性顺序表中越排在后面的,其离子的氧化性越强,越易得到电子(注意Fe3+在Cu2+后面)而放电,其放电顺序为:K+Ca2+Na+Al3+(水中)H+ Zn2+Fe2+Sn4+ Pb2+H+Cu2+Fe3+Ag+。
(2)阳极:若为活性电极做阳极,则活性电极首先失电子,发生氧化反应;若为惰性电极做阳极,则仅是溶液中的阴离子放电,其常见的放电顺序为:F- 含氧酸根离子OH-Cl-Br-I-S2-。
如本题中溶液中的阳离子有H+和Na+,阴极上H+优先放电,得电子得到氢气,氢离子来自水,则同时生成氢氧化钠;溶液中的阴离子有Cl-和OH-,阳极上Cl-优先放电,失电子得到氯气。
题型二:电极方程式的书写杨sir化学,侵权必究
【例3】用情性电极电解下列溶液
(1)电解KNO3溶液阳极反应___________
(2)电解CuCl2溶液阴极反应___________
(3)电解氢氧化钠溶液的总反应___________
(4)电解CuSO4与NaCl混合溶液开始时阳极反应___________,阴极反应___________
【答案】
(1)4OH--4e-=O2↑+2H2O或2H2O-4e-=O2↑+4H+
(2)Cu2++2e-=Cu
(3)2H2OO2↑+2H2↑
(4) 2Cl--2e-=Cl2↑ Cu2++2e-=Cu
【解析】
(1)
惰性电极电解硝酸银溶液时,阳极为水电离出的氢氧根放电生成氧气,电极方程式为4OH--4e-=O2↑+2H2O或2H2O-4e-=O2↑+4H+;
(2)
惰性电极电解CuCl2溶液时,阴极铜离子放电生成铜单质,电极方程式为Cu2++2e-=Cu;
(3)
惰性电极电解NaOH溶液时,阳极氢氧根放电生成氢气,阴极水电离出的氢离子放电生成氢气,实质上是电解水,总反应为2H2OO2↑+2H2↑;
(4)
惰性电极电解CuSO4与NaCl混合溶液开始时阳极氯离子放电生成氯气:2Cl--2e-=Cl2↑,阴极为铜离子放电生成铜单质:Cu2++2e-=Cu。
题型三:电解池中的计算杨sir化学,侵权必究
【例4】如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol·L−1的CuCl2溶液,B池中加入0.1 mol·L−1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是
A.2∶2∶4∶1 B.1∶1∶2∶1
C.2∶1∶1∶1 D.2∶1∶2∶1
【答案】A
【详解】a为阴极,铜离子得到电子生成铜,电极反应为Cu2++2e-=Cu;b为阳极,氯离子失去电子生成氯气,电极反应为2Cl--2e-=Cl2↑;c为阴极,银离子得到电子生成银,电极反应为Ag++e-=Ag;d为阳极,氢氧根离子失去电子生成氧气,电极反应为4OH- -4e-=O2↑+2H2O;根据电子守恒,四种物质的物质的量关系为2:2:4:1。
故选A。
【点睛】
掌握串联电路中电流相同,所以通过电子物质的量相等。
题型四:电解池的基本原理杨sir化学,侵权必究
【例6】在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g。请回答下列问题:
(1)Y电极为直流电源的___________极。
(2)B中阳极的电极反应式为___________。
(3)C中pH变化:___________(填“增大”、“减小”或“不变”)。
(4)A中反应的方程式为___________。若A中KCl溶液的体积是200mL,电解后,溶液的pH为___________(设电解前后溶液体积不变)。
【答案】正极 2H2O-4e-=O2↑+4H+ 不变 2KCl+2H2OCl2↑+H2↑+2KOH 13
【分析】
用通直流电5min时,铜电极质量增加2.16g,则Cu电极为阴极,因此X为电源的负极,Y电极为直流电源的正极。A为用惰性电极电解氯化钾溶液,生成氯气、氢气和氢氧化钾;B为用惰性电极电解硫酸铜溶液,生成铜Cu、O2和H2SO4;C中的Ag电极为阳极,银本身放电,据此分析解答。
【详解】
(1)铜电极的质量增加,发生的反应为Ag++e-═Ag,则Cu电极为阴极,Ag为阳极,因此Y为直流电源的正极,X为直流电源的负极,故答案为:正;
(2)B中的阳极上OH-放电,电极反应式为4OH--4e-═2H2O+O2↑(或2H2O-4e-=O2↑+4H+),故答案为:4OH--4e-═2H2O+O2↑(或2H2O-4e-=O2↑+4H+);
(3) C中的Ag电极为阳极,银本身放电,故电极反应为:Ag-e-═Ag+,C中阴极反应为Ag++e-═Ag,因此溶液pH不变,故答案为:不变;
(4)A为电解KCl溶液,生成KOH、Cl2和H2,电解的方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-(或2KCl+2H2OCl2↑+H2↑+2KOH);通电5 min时,铜电极的反应式为Ag++e-═Ag,n(Ag)==0.02mol,电路中通过0.02 mol电子。A中放出0.01 mol H2,溶液中生成0.02 mol KOH,c(OH-)==0.1 mol•L-1,则c(H+)=10-13 mol•L-1,因此pH=-lg c(H+)=13,故答案为:2KCl+2H2OCl2↑+H2↑+2KOH(或2Cl-+2H2O Cl2↑+H2↑+2OH-);13。
【点睛】
明确Cu电极的质量增加是解答本题的突破口。本题的易错点为(4),要注意溶液pH的计算方法的理解和应用。
【变7】在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案(原理如图),下列说法不正确的是
A.电源a端为负极
B.Fe3+对总反应起催化作用
C.阳极发生的电极反应式为2HCl-2e-=2H++Cl2
D.电路中转移1mol电子,需要消耗11.2LO2(标准状况)
【答案】D
【详解】
A.根据图示,a端,发生还原反应,所以a端为电源负极,故A正确;
B.根据图示,、,a端总反应为,所以Fe3+对总反应起催化作用,故B正确;
C.根据图示,阳极发生的电极反应式为2HCl-2e-=2H++Cl2,故C正确;
D.阴极反应为,电路中转移1mol电子,根据电子守恒,需要消耗5.6LO2(标准状况),故D错误;
选D。
题型五:电解池的分段电解杨sir化学,侵权必究
【例9】用石墨电极电解50mLCuSO4的溶液,两极上均收集到4.48L气体(标准状况),则原混合液中Cu2+物质的量浓度为
A.1mol·L-1 B.2 mol·L-1 C.3mol·L-1 D.4 mol·L-1
【答案】D
【详解】
电解50mLCuSO4的溶液,阳极发生的反应为:4OH--4e-=2H2O+O2↑,阴极上发生的电极反应为:Cu2++2e-=Cu,2H++2e-→H2↑,两极均收集到4.48L(标准状况)气体,即均生成0.2mol的气体,阳极生成0.2mol氧气说明转移了0.8mol电子,而阴极上生成的0.2molH2只得到了0.4mol电子,所以剩余0.4mol电子由铜离子获得,则溶液中有0.2mol铜离子,据c= 得到铜离子的浓度为:=4mol/L。答案选D。
【变9-3】如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极 上析出6.4g某金属,下列说法正确的是
A.甲池是b极上析出金属银,乙池是c极上析出某金属
B.甲池是a极上析出金属银,乙池是d极上析出某金属
C.某盐溶液可能是CuSO4溶液
D.某盐溶液可能是Mg(NO3)2溶液杨sir化学,侵权必究
【答案】C
【分析】
甲池中a极与电源负极相连为阴极,电极上银离子得电子析出银单质,b电极为阳极,水电离出的氢氧根放电产生氧气,同时产生氢离子;乙池中c为阴极,d为阳极,乙池电极析出6.4g金属,金属应在c极析出,说明乙池中含有氧化性比氢离子强的金属阳离子。
【详解】
A.甲池a极上析出金属银,乙池c极上析出某金属,故A错误;
B.甲池a极上析出金属银,乙池c极上析出某金属,故B错误;
C.乙池电极析出6.4g金属,说明乙池中含有氧化性比氢离子强的金属阳离子,Cu2+氧化性强于氢离子,会先于氢离子放电,则某盐溶液可能是CuSO4溶液,故C正确;
D.Mg2+氧化性较弱,电解时在溶液中不能得电子析出金属,所以某盐溶液不能是Mg(NO3)2溶液,故D错误;
故答案为C。
题型六:电解质溶液的复原杨sir化学,侵权必究
【变10-2】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,向溶液中加入( )
A.0.1 mol CuO B.0.1 mol CuCO3
C.0.075 mol Cu(OH)2 D.0.05 mol Cu2(OH)2CO3
【答案】D
【分析】
电解CuSO4溶液时,开始发生反应:2CuSO4+2H2O 2Cu+O2↑+2H2SO4,一段时间后,气体体积增大,说明发生反应:2H2O 2H2↑+O2↑。结合图象数据分析解答。
【详解】
电解CuSO4溶液时,开始发生反应:2CuSO4+2H2O 2Cu+O2↑+2H2SO4,一段时间后,转移相同电子时得到气体体积增大,说明发生反应:2H2O 2H2↑+O2↑。由图可知,第一阶段析出Cu为=0.1mol,放出的氧气为0.05mol,则需要加入0.1molCuO,第二阶段消耗的水为=0.05mol,因此恢复为电解前的浓度需要加入0.1molCuO和0.05molH2O。由于CuCO3反应生成二氧化碳,0.1 mol CuCO3相当于加入0.1 mol CuO,不能恢复为电解前的浓度;Cu(OH)2可以改写为CuO·H2O,0.075 mol Cu(OH)2相当于加入0.075 mol CuO和0.075 molH2O,也不能恢复为电解前的浓度;Cu2(OH)2CO3可以改写为2CuO·H2O·CO2,0.05 mol Cu2(OH)2CO3等效为加入0.1molCuO、0.05molH2O,溶液可恢复为电解前的浓度,故选D。
题型七:原电池与电解池串联杨sir化学,侵权必究
【变11-1】已知某锂离子电池的总反应为LixC+Li1-xCoO2C+LiCoO2,锂硫电池的总反应为2Li+SLi2S有关上述两种电池说法正确的是
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.两种电池的负极材料相同
D.图中表示用锂离子电池给锂硫电池充电
【答案】B
【详解】
A.根据同种电荷相互排斥,异种电荷相互吸引的原则,在原电池中阳离子向负电荷较多的正极移动,则锂离子电池放电时,Li+向正极迁移,A错误;
B.锂硫电池充电时,锂电极与外接电源的负极相连,锂电极上Li+得电子发生还原反应产生Li单质,B正确;
C.图中表示锂硫电池给锂离子电池充电,右边电极材料是Li和S,锂负极,硫为正极。左边电极材料是C和LiCoO2,两种电池的负极材料不相同,C错误;
D.图中表示锂硫电池给锂离子电池充电,D错误;
故合理选项是B。
【题1】用惰性电极电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上析出的物质分别是
A.H2和Cl2 B.H2和O2 C.Cu和Cl2 D.Cu和O2
【答案】C
【详解】
稀H2SO4、Cu(NO3)2、NaCl的混合液,阳离子的放电顺序:Cu2+>H+>Na+,阴离子的放电顺序:Cl->OH->酸根离子,因此用惰性电极电解稀H2SO4、Cu(NO3)2、NaCl的混合液,阳极Cl-先失电子生成Cl2,阴极Cu2+先得电子生成Cu,即最初一段时间阴极和阳极上析出的物质分别是Cu和Cl2,C满足题意;
答案选C。
【题2】如图所示电解池Ⅰ和Ⅱ中,a、b、c、d均为铂电极,在电解过程中b电极有气体逸出,d电极质量增大。符合上述实验结果的一项是
| X | Y |
A | AgNO3 | Na2CO3 |
B | Cu(NO3)2 | Pb(NO3)2 |
C | FeSO4 | Al2(SO4)3 |
D | MgSO4 | CuSO4 |
A.A B.B C.C D.D杨sir化学,侵权必究
【答案】D
【分析】
首先,根据电源正负极可知a、c为阳极,b、d为阴极,然后再根据惰性电极电解时离子的放电顺序,阳离子放电顺序:
Ag+>Hg2+>Fe3+>Cu2+>H+(指酸电离的)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
阴离子的放电顺序
是惰性电极时:S2->I->Br->Cl->OH-> > (含氧酸根离子)
是活性电极时:电极本身溶解放电,即可判断。
【详解】
A.X溶液为AgNO3时,b极为阴极,根据放电顺序可知,是Ag+放电生成固体银,不产生气体,A错误;
B.X溶液为Cu(NO3)2时,b极为阴极,根据放电顺序可知,是Cu2+放电生成固体铜,不产生气体,B错误;
C.Y溶液为Al2(SO4)3时,d极为阴极,根据放电顺序可知,H+放电产生氢气,电极质量不增加,C错误;
D.X溶液为MgSO4时,b极为阴极,根据放电顺序可知,H+放电产生氢气,Y溶液为CuSO4时,d极为阴极,根据放电顺序可知,是Cu2+放电生成固体铜,电极质量增加,D正确;
【点睛】
电解时阴阳离子的放电顺序的准确记忆是解决这种题目的关键。
【题3】用惰性电极电解下列各组中的三种溶液,电解过程中,溶液中pH依次为减小、不变、增大的是
A.HCl、HNO3、K2SO4 B.AgNO3、CuCl2、 Cu(NO3)2
C.CaCl2、 KOH、NaNO3 D.CuSO4、Na2SO4、KCl
【答案】D
【详解】
A.电解HCl生成氯气和氢气,电解本身,电解HNO3时生成氢气和氧气,即电解水型的,电解K2SO4时,时生成氢气和氧气,即电解水型的,溶液的pH依次为升高,降低,不变,故A错误;
B.电解AgNO3会生成硝酸、银和氧气,溶液的pH降低;氯化铜溶液呈酸性,电解CuCl2会生成铜和氯气,电解后浓度减小,铜离子水解程度减弱,溶液的pH增大;电解Cu(NO3)2时会生成铜、硝酸和氧气,溶液的pH降低,故B错误;
C.电解CaCl2时生成氢氧化钙、氯气和氢气,电解KOH时生成氢气和氧气,即电解水型的,电解NaNO3时,生成氢气和氧气,即电解水型的,溶液的pH依次为升高,升高,不变,故C错误;
D.电解CuSO4时,生成铜和氧气以及硫酸,电解Na2SO4生成氢气和氧气,即电解水型的,电解KCl时会生成氢气、氯气单质和氢氧化钾,溶液中c(H+)依次为升高,不变,降低,pH依次为减小、不变、增大,故D正确;
故选:D。
【题5】在100 mL H2SO4和CuSO4的混合液中,用石墨作电极进行电解,两极上均收集到2.24 L气体(标准状况下),则原混合液中Cu2+的物质的量浓度为
A.0.1 mol·L-1 B.0.2 mol·L-1 C.1 mol·L-1 D.2 mol·L-1
【答案】C
【详解】
电解0.1LH2SO4和CuSO4的混合溶液,阳极发生的反应为:4OH-→2H2O+O2↑+4e-,阴极上发生的电极反应为:Cu2++2e-→Cu,2H++2e-→H2↑,两极均收集到2.24L(标况)气体,即均生成0.1mol的气体,阳极生成0.1mol氧气说明转移了0.4mol电子,而阴极上生成的0.1molH2只得到了0.2mol电子,所以剩余0.2mol电子由铜离子获得,且溶液中有0.1mol铜离子,据c=得到铜离子的浓度为:=1mol/L,故选C。
【题7】如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液。
(1)A、B、C三个装置中属于电解池的是__。
(2)A池中Zn是__极,Cu极的电极反应式为__。
(3)B池中Pt棒上的电极反应为__。B池中的总反应化学方程式为__。
(4)C池中Cu极电极反应式为__。
【答案】BC 负 Cu2++2e-=Cu 2Cl--2e-=Cl2↑ CuCl2Cu+Cl2↑ Cu-2e-=Cu2+
【详解】
(1)A中有自发的氧化还原反应:Zn+CuCl2=ZnCl2+Cu,所以为原电池,B、C均有外接电源,为电解池;
(2)A池中总反应为Zn+CuCl2=ZnCl2+Cu,所以Zn电极失电子发生氧化反应为负极;Cu电极上铜离子得电子生成Cu,电极反应式为Cu2++2e-=Cu;
(3)B中Pt电极与电源的正极相连为阳极,溶液中氯离子在阳极失电子被氧化,电极反应式为2Cl--2e-=Cl2↑;
B中C电极为阴极,铜离子得电子被还原生成铜单质,所以总反应为CuCl2Cu+Cl2↑;
(4)C中铜电极与电源正极相连为阳极,铜失电子被氧化成铜离子,电极反应式为Cu-2e-=Cu2+。
【题9】回答下列问题
(1)请你将反应设计成原电池,并回答下列问题:
①该电池的正极材料可以是___________,也可选用___________等代替。
②画出你所设计的双液原电池的装置图,并标注出电极材料和电解质溶液。___________
③写出电极反应式:负极___________,正极___________。
④该电池负极材料质量减重3.2g,则电路中通过的电子的数目为___________。
(2)从、、Na+、Cu2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。(注意:请填写满足条件的所有电解质的化学式)
①若两极分别放出H2和O2时,电解质可能为___________(填化学式,下同)。杨sir化学,侵权必究
②若阴极析出金属,阳极放出气体,电解质可能为___________。
③若两极分别放出气体,且气体体积比为1∶1时,电解质只能为___________。
【答案】
(1) Ag 石墨(C)或Pt 或
(2) 、 、、、 NaCl
【分析】
(1)
①由可知,Cu失电子发生氧化反应作负极、不如Cu活泼的金属或导电的非金属作正极,FeCl3溶液为电解质溶液,则该电池的正极材料可以是Ag,也可选用石墨(C)或Pt;答案为Ag;石墨(C)或Pt。
②由可知,Cu作负极,C棒作正极,电解质溶液为FeCl3溶液和CuSO4溶液,用盐桥相连接成闭合回路,双液原电池的装置图为;答案为
。
③由可知,该原电池中,负极的电极反应式为,正极的电极反应式为;答案为;。
④该电池负极材料质量减重3.2g,则反应的Cu的物质的量为n(Cu)==0.05mol,由负极的电极反应式为可知,电路中通过的电子的数目为0.05×2×NA=0.1NA或0.05×2×6.02×1023=6.02×1022;答案为0.1NA或6.02×1022。
(2)
阴极上阳离子放电顺序为Ag+>Cu2+>H+>Na+,阳极上阴离子放电顺序为Cl->OH->、
①若两极分别放出H2和O2时,溶液中的电解质不放电,溶液中阳离子为Na+,阴离子为、,所以电解质是或中的任意一种;答案为、。
②当阴极析出金属,则金属离子为Cu2+或Ag+,阳极放出气体时,阴离子为Cl-、或,所以电解质是或或或中的任意一种;答案为、、、。
③当阴极放出H2,则阴极为水中H+放电,溶液中的阳离子为Na+,阳极放出Cl2,阴离子为Cl-放电,满足气体体积比为1:1,所以电解质为NaCl;答案为NaCl。
【练1】用惰性电极电解CuSO4和NaCl 的混合溶液,开始时阴极和阳极上分别
析出的物质是
A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2
【答案】B
【详解】
根据电解原理,阳离子放电顺序是Cu2+>H+>Na+,阴离子放电顺序是Cl->OH->SO
,所以开始时阴极反应式Cu2++2e-=Cu,阳极反应式:2Cl--2e-=Cl2↑,故选项B正确。
【练2】在某电解质溶液里,用M和N作电极,通电一段时间后,发现M极质量减小,N极质量增大,符合这一情况的是( )
A.电解质溶液是稀硫酸 B.金属M是阳极,金属N是阴极
C.M和N都是石墨电极 D.M是阴极,N是阳极
【答案】B
【详解】
A.电解稀硫酸溶液,阳极发生氧化反应,质量会减少,即M极质量减小;阴极发生还原反应放出氢气,N极质量不变,故A不符合题意;
B.由题意可知,M电极溶解,则发生氧化反应,为阳极;N电极质量增加,溶液中的金属阳离子得电子在N电极上析出,发生还原反应,N为阴极,故B符合题意;
C.如果M和N均是石墨电极,M极质量不会减小,故C不符合题意;
D.由题意可知,M电极溶解,则发生氧化反应,为阳极;N电极质量增加,溶液中的金属阳离子得电子在N电极上析出,发生还原反应,N为阴极,故D不符合题意;
答案选B。
【练3】用石墨电极电解稀硫酸的过程中,溶液pH的变化情况为
A.逐渐减小 B.逐渐增大 C.不改变 D.先减小,后增大
【答案】A
【详解】
用石墨电极电解稀硫酸,阳极为氢氧根离子失电子发生氧化反应,阴极为氢离子得电子发生还原反应,其实质为电解水,所以电解过程中,硫酸硫酸浓度越来越大,则溶液pH的变化情况为逐渐减小,故选:A。
【练4】用惰性电极电解饱和食盐水,下列说法正确的是
A.电解过程中, Cl-向阳极方向移动,发生还原反应
B.电解一段时间后,阴极附近溶液pH增大
C.电解池中的总反应为:2H++2Cl-=H2↑+Cl2↑
D.欲使电解池中的溶液恢复到电解前状态,应加入适量浓盐酸
【答案】B
【解析】
试题分析:A.电解过程中, Cl-向阳极方向移动,发生氧化反应,A错误;B.电解一段时间后,阴极氢离子放电,产生氢氧根,阴极附近溶液pH增大,B正确;C.电解池中的总反应为:2H2O+2Cl-H2↑+Cl2↑+2OH-,C错误;D.欲使电解池中的溶液恢复到电解前状态,应通入适量氯化氢气体,D错误,答案选B。
考点:考查电解饱和食盐水的有关判断
【练5】用石墨作电极完全电解含1 mol溶质X的溶液后,向溶液中加入一定量的物质Y能使电解液恢复到起始状态是
选项 | X溶液 | 物质Y |
A | CuCl2 | 1 mol Cu(OH)2 |
B | KOH | 1 mol KOH |
C | Na2SO4 | 1 mol H2SO4 |
D | AgNO3 | 0.5 mol Ag2O |
A.A B.B C.C D.D杨sir化学,侵权必究
【答案】D
【解析】
A.电解氯化铜,在两极上分别产生金属铜和氯气,电解质复原加入氯化铜即可,故A错误;B.电解氢氧化钾的实质是电解水,所以电解质复原加入水即可,故B错误;C.电解硫酸钠的实质是电解水,所以电解质复原加入水即可,故C错误;D.电解硝酸银两极上产生的是金属银和氧气,所以电解质复原加氧化银即可,电解含1mol溶质硝酸银的溶液,会析出金属银1mol,根据银元素守恒,所以加入0.5mol Ag2O后即可复原,故D正确;故选D。
点睛:理解电解池的工作原理以及电解质复原的方法是解题关键,根据电解原确定电解后析出的金属或是放出的气体,根据:出什么加什么,出多少加多少的原理确定电解质复原加入的物质以及量的多少。
【练6】如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液。
(1)A、B、C三个装置中属于电解池的是_______。
(2)A池中Zn是_______极,Cu极的电极反应式为_______。
(3)B池中的总反应化学方程式为_______,若将B池的溶液换成饱和的食盐水,当电路中通过1mol电子时两极共产生的气体体积为_______(标准状况)。杨sir化学,侵权必究
(4)C池中Cu极电极反应式为_______。
(5)某化学学习小组在学完原电池后,以Zn+Fe2+=Zn2++Fe为电池总反应设计电池,该电池的正极反应式为_______。
【答案】BC 负 Cu2++2e-=Cu CuCl2Cu+Cl2↑ 22.4L Cu-2e-=Cu2+ Fe2++2e-=Fe
【详解】
(1)A没有外接电源,属于原电池,BC装置都有外接电源,所以是把电能转化为化学能的装置,属于电解池,
故答案为:BC;
(2)铜、锌、氯化铜原电池中,锌作负极,负极上锌失电子发生氧化反应,电极反应式为:Zn−2e−=Zn2+,铜离子在正极得电子生成Cu单质,电极反应为:Cu2++2e-=Cu,
故答案为:负;Cu2++2e-=Cu;
(3)该装置是电解池,且阳极是惰性电极,C连接电源负极,所以是阴极,阴极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e−=Cu,铂连接电源正极,所以铂在阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl−−2e−=Cl2↑,所以其电池反应式为:CuCl2Cu+Cl2↑,若将B池的溶液换成饱和的食盐水,则电解的总反应为:,由反应可知转移2mol电子时生成1mol氢气和1mol氯气,则通过1mol电子时两极共产生的气体的物质的量为1mol,标况下的体积为22.4L,故答案为:CuCl2Cu+Cl2↑;22.4L;
(4)该装置是电解池,铜是阳极,阳极上铜失电子发生氧化反应,电极反应式为:Cu−2e−=Cu2+,
故答案为:Cu−2e−=Cu2+;
(5)以Zn+Fe2+=Zn2++Fe为电池总反应设计电池,Zn失电子作负极,Fe2+得电子在正极发生反应,电极反应为:Fe2++2e-=Fe,故答案为:Fe2++2e-=Fe;
【练7】某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时。观察到电流表的指针发生了偏转。
请回答下列问题:
(1)甲池为___________(填“原电池”、“电解池”或“电镀池”),通入电极的电极反应式为___________。
(2)乙池中A(石墨)电极的名称为___________(填“正极”、“负极”、“阴极”或“阳极”)。总反应的离子方程式为___________。
(3)当乙池中B极质量增加21.6g时,甲池中理论上消耗的体积为___________mL(标准状况下),丙池中___________极析出___________g铜。杨sir化学,侵权必究
(4)若丙池中电极不变,将其溶液换成溶液,电键闭合一段时向后。甲中溶液的pH将___________(填“增大”“减小”或“不变”);丙中溶液的pH将___________(填“增大”、“减小”或“不变”)。
【答案】
(1) 原电池
(2) 阳极
(3) 1120 D 6.4
(4) 减小 不变
【分析】
由图可知,甲池为燃料电池,通入甲醇的的Pt电极为负极,碱性条件下,甲醇在负极失去电子发生氧化反应生成碳酸根离子和水,通入氧气的Pt电极为正极,碱性条件下,氧气在正极得到电子发生还原反应生成氢氧根离子;乙池为电解池,A电极为电解池的阳极,水在阳极失去电子发生氧化反应生成氧气,B电极为阴极,银离子在阴极得到电子发生还原反应生成银;丙池为电解池,C电极为阳极,氯离子在阳极失去电子发生氧化反应生成氯气,D电极为阴极,铜离子在阴极得到电子发生还原反应生成铜。
(1)
由分析可知,甲池为原电池;通入甲醇的的Pt电极为负极,碱性条件下,甲醇在负极失去电子发生氧化反应生成碳酸根离子和水,电极反应式为;
(2)
乙池为电解池,A电极为电解池的阳极,水在阳极失去电子发生氧化反应生成氧气,B电极为阴极,银离子在阴极得到电子发生还原反应生成银,总反应的离子方程式为;
(3)
21.6g银的物质的量为,由得失电子数目守恒可知,甲池中理论上消耗氧气的体积为0.2mol××22.4L/mol×1000=1120mL,丙池中D极析出铜的质量为0.2mol××64g/mol=6.4g;
(4)
若丙池中电极不变,将其溶液换成溶液,电键闭合一段时间后,甲池中的总反应为2CH3OH+3O2+4OH-=2CO+6H2O,反应中消耗氢氧根离子,溶液的pH将减小;丙池中电解溶液的方程式为,丙中溶液的pH不变。
高中人教版 (2019)第二节 电解池背景图课件ppt: 这是一份高中人教版 (2019)第二节 电解池背景图课件ppt,共43页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 电解池教案配套课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池教案配套课件ppt,共31页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
化学选择性必修1第二节 电解池作业课件ppt: 这是一份化学选择性必修1第二节 电解池作业课件ppt,共26页。PPT课件主要包含了逐渐变浅,∶2∶2∶2,AgNO3等内容,欢迎下载使用。













