


福建省三明市尤溪县2022-2023学年高一下学期4月第一次阶段检测化学试题(Word版含答案)
展开
这是一份福建省三明市尤溪县2022-2023学年高一下学期4月第一次阶段检测化学试题(Word版含答案),文件包含化学试题docx、化学试题参考答案docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
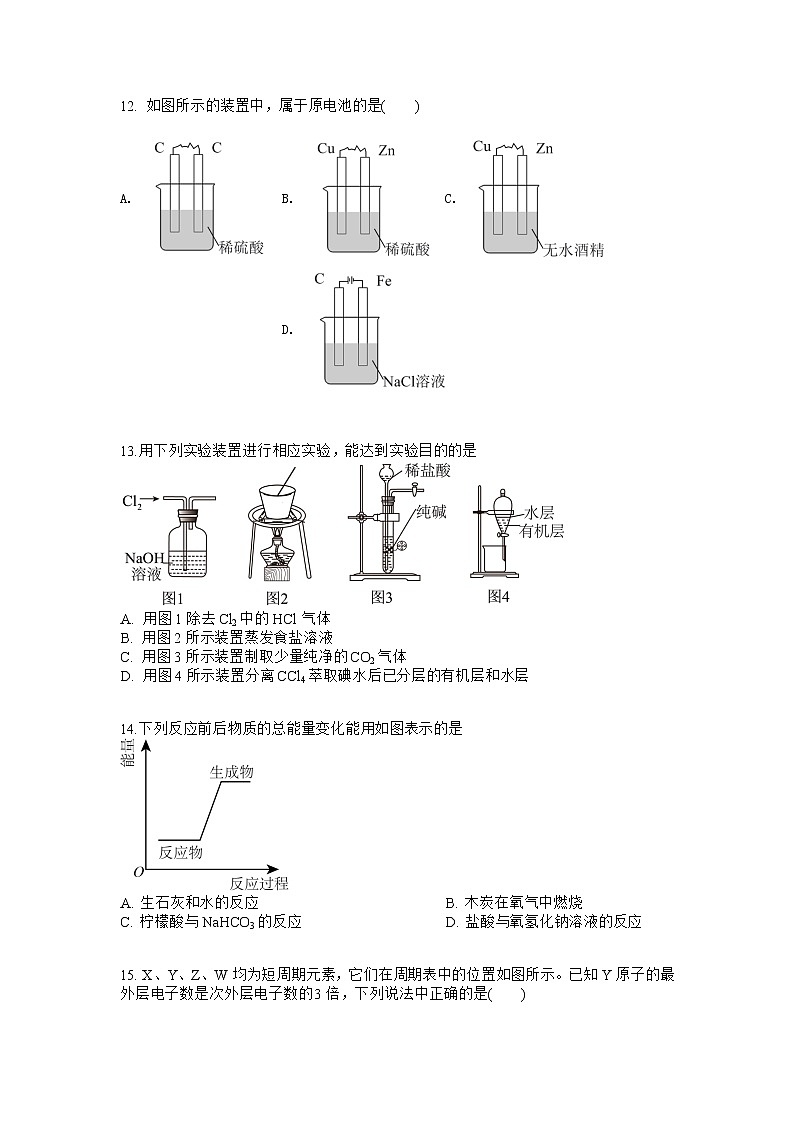
尤溪县2022-2023学年高一下学期4月第一次阶段检测化学试题(试卷满分100分,考试时间:75分钟)可能用到的相对原子质量:H—1 C—12 O—16 Al—27 Zn—65 第I卷 (选择题,共48分) 一、选择题(本题共16小题,每小题只有一个选项符合题意,小题3分,共48分)1.科技改变生活。下列说法错误的是A. 碳中和是指特定时期内全球人为CO2排放量与CO2消除量相当B. “雷霆之星”速滑服采用银离子抗菌技术,可有效防护细菌侵入C. “天机芯”是全球首款异构融合类脑计算芯片,其主要成分和光导纤维相同D. “天问一号”火星车的热控保温材料——纳米气凝胶,可产生丁达尔效应 2. X元素最高价氧化物对应水化物的化学式为H2XO4,该元素的气态氢化物的化学式是()A. HX B. H2X C. XH3 D. XH4 3.下列每组物质中含有的化学键类型相同的是A. NaCl、HCl、H2O、NaOHB. Cl2、Na2S、HCl、SO2C. HBr、CO2、H2O、CS2D. Na2O2、H2O2、H2O、O3 4.用化学用语表示 NH3+ HCl = NH4Cl中的相关微粒,其中正确的是A. NH3的结构式: B. HCl 的电子式:C. 中子数为8的氮原子: D. Cl-的结构示意图: 5.下列结论错误的是①微粒半径:K+>Al3+>S2->Cl-②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4③离子的还原性:S2->Cl->Br->I-④氧化性:Cl2>S>Se⑤酸性:HCl>HFA. 只有① B. ①③ C. ②④⑤ D. ③⑤ 6.下列关于反应能量的说法中正确的是A. 化学反应中的能量变化,都表现为热量的变化B. 化学键的断裂和形成是化学反应中能量变化的主要原因C. 已知反应:Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)为放热反应,则反应物总能量<生成物总能量D. 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子的能量为E2,则2E1=E2 7.“神舟七号”的燃料是氢化锂三兄弟-LiH、 LiD.、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是A. 质子数之比为1:2:3 B. 中子数之比为4:5:6C. 摩尔质量之比为7:8:9 D. 化学性质不相同 8.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是A. In是第五周期第ⅢA族元素B. 11549In的中子数与电子数的差值为17C. 原子半径:In>AlD. 碱性:In(OH)3>RbOH 9.Al遇到极稀的硝酸发生反应:8Al+30HNO3=3NH4NO3+8Al(NO3)3+9H2O。设NA为阿伏加德罗常数的值。下列说法正确的是A. 反应中每消耗2.7g金属Al,转移的电子数为3NAB. 1molNH含有的质子数为10NAC. 1.0g由H218O与D2O组成的混合物中所含有的中子总数为0.5NAD. 0.1mol·L-1Al(NO3)3溶液中,所含阳离子数目为0.1NA 10.在核反应中用α粒子(即氦核He)轰击金属原子X,得到核素Y,开创了人造放射性核素的先河:X+He→Y+n。其中元素X、Y的最外层电子数之和为8。下列叙述正确的是A. X的相对原子质量为26B. α粒子轰击金属原子X发生了化学反应C. X的原子半径小于Y的原子半径D. X、Y均可形成三氯化物 11.已知A2-核内有x个中子,A原子的质量数为m,则ngA2-所含电子的总物质的量是(单位:mol)A. B. C. D. 12. 如图所示的装置中,属于原电池的是( ) A. B. C. D.
13.用下列实验装置进行相应实验,能达到实验目的的是A. 用图1除去Cl2中的HCl气体B. 用图2所示装置蒸发食盐溶液C. 用图3所示装置制取少量纯净的CO2气体D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 14.下列反应前后物质的总能量变化能用如图表示的是A. 生石灰和水的反应 B. 木炭在氧气中燃烧C. 柠檬酸与NaHCO3的反应 D. 盐酸与氧氢化钠溶液的反应 15. X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )A. 原子半径:W>Z>Y>XB. 最高价氧化物对应水化物的酸性:Z>W>XC. 氢化物的稳定性:X>Y>ZD. 四种元素的单质中,Z单质的熔、沸点最高 16.探究是培养创新精神和实践能力的手段。用如下装置探究氯气的性质,图中三支试管口均放置浸有NaOH溶液的棉花。下列对实验现象的分析错误的是
A. ①中淀粉KI试纸变蓝,说明氯气的氧化性强于碘B. ②中产生白色沉淀,说明氯气与水反应生成Cl—C. ③中的溶液变为棕黄色,说明氯气有氧化性D. ④溶液先变红后褪色,说明氯水有酸性和漂白性 第Ⅱ卷 (非选择题共52分)二、填空题(本题共有4小题,共52分)17. 碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用。(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是________ ____ ____ ____ ____ ____ ____ (用化学方程式表示)。(2)某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。实验操作步骤:Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。Ⅱ.A中看到白色沉淀时,…,关闭活塞a。请回答:①B中反应的离子方程式是________________________。②C装置的作用是____________________,X是______________。③为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是____________________,装置D中反应的化学方程是____________________________。 18. (1)下列反应中,属于放热反应的是___________,属于吸热反应的是_____________。①煅烧石灰石②木炭燃烧③炸药爆炸④酸碱中和⑤生石灰与水作用制熟石灰⑥食物因氧化而腐败(2)用铜、银与硝酸银设计一个原电池,此电池的负极是_______,负极的电极反应式是___________________________。(3)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25g,铜表面析出了氢气_______L(标准状况),导线中通过_______mol电子。 19.下表是元素周期表的一部分,表中所列字母分别代表某一元素。根据表中所列元素,回答下列问题:(1)A元素中子数为8的核素的符号:_______;(2)写出E的离子结构示意图:_______;(3)上表短周期元素中,金属性最强的是_______(填元素符号);最高价氧化物对应水化物中酸性最强的物质_______(填化学式);(4)表中E、F、G三元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小顺序是_______(用离子符号表示);(5)H是目前人类使用最广泛的金属元素。B的最高价含氧酸稀溶液与足量H单质发生反应的离子方程式为______________________;(6)用一个离子方程式说明元素E、F非金属性强弱______________________。 20. 从海水中可以获得淡水、食盐并可提取镁和溴等物质。实验(一)海水提溴:空方气吹出法是工业规模提溴的常用法,其流程如图: (1)步骤④反应的离子方程式为_______________________。除SO2外,步骤④还可以选用Na2CO3溶液吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收3molBr2时,转移电子的物质的量为________mol。实验(二)碘的制取:另取海带浸取原液,甲、乙两种实验方案如图:已知:3I2+6KOH=5NaI+NaIO3+3H2O;酸性条件下,I2在水中的溶解度很小。(2)“适量O2”中能代替O2的最佳物质是________。(3)步骤X中,萃取后分液漏斗内观察到的现象是____________。(4)步骤Y中提纯的方法称为________。(5)方案乙中,上层液体中加入H2SO4溶液,反应的离子方程式为________________,其中操作Z的名称是________.
相关试卷
这是一份福建省三明市2023-2024学年高一上学期期末质量检测化学试题(Word版附答案),共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份福建省三明市普通高中2022-2023学年高一下学期期末质量检测化学试题(解析版),共19页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份福建省三明市普通高中2022-2023学年高一下学期期末质量检测化学试题(扫描版含答案),共10页。








