

2023山东省新高考联合质量测评高一下学期3月联考试题化学含答案
展开试卷类型:A
山东新高考联合质量测评3月联考试题
高一化学
2023.3
注意事项:
1.答题前,考生先将自己的学校、班级、姓名、考号、座号填写在相应位置。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 As 75
一、选择题:本题共10小题,每小题2分,共20分,每小题只有1个选项符合题意。
1.化学与社会、科技、生活密切相关。下列说法错误的是
A.海水制盐业的副产物苦卤是提取溴的主要原料
B.漂白粉和明矾可以用于水处理,二者的作用原理相同
C.普通玻璃属于硅酸盐材料,盛放碱性溶液的试剂瓶不能用磨口玻璃塞
D.以钛、、钼、钨为原料制成的特种合金可用来制造飞机、宇宙飞船等
2.瑞德西韦是抗击新冠病毒肺炎重要药物之一,其化学式为,下列有关组成元素的叙述中正确的是
A.氢有三种常见的同素异形体:、、
B.C、N、O、P四种元素的最高化合价都等于它们对应原子的最外层电子数
C.0元素有一种核素,则0元素的相对原子质量为16
D.在P原子中,在离核较远的区域内运动的电子能量较高
3.2022年11月29日,神舟十五号载人飞船入轨后,于11月30日5时42分,成功对接于空间站“天和”核心舱前向端口。化学作为一门传统的理科,在神舟飞船的研制过程中不可缺少。下列说法错误的是
A.运载火箭的轨道舱壳体铝合金因其密度小、抗腐蚀性能好等优点成为关键材料
B.“天和”核心舱配置的霍尔发动机推进剂中含,该原子中子数为77
C.核心舱搭载的柔性太阳能电池,二氧化硅是太阳能电池板的核心材料
D.使用的热控材料是新型保温材料——纳米气凝胶,纳米气凝胶具有丁达尔效应
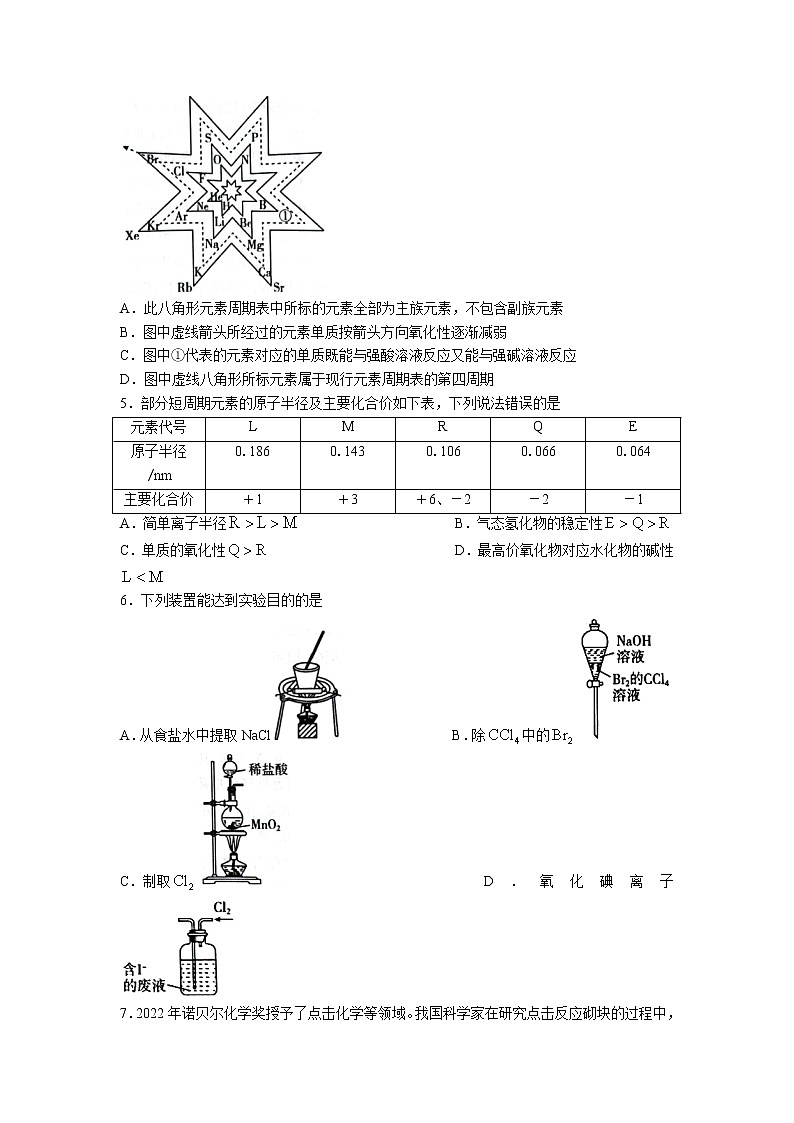
4.如图为某学术期刊上刊登的八角形元素周期表,八角形的每个顶角对应一种元素,下列说法不正确的是
A.此八角形元素周期表中所标的元素全部为主族元素,不包含副族元素
B.图中虚线箭头所经过的元素单质按箭头方向氧化性逐渐减弱
C.图中①代表的元素对应的单质既能与强酸溶液反应又能与强碱溶液反应
D.图中虚线八角形所标元素属于现行元素周期表的第四周期
5.部分短周期元素的原子半径及主要化合价如下表,下列说法错误的是
元素代号 | L | M | R | Q | E |
原子半径/nm | 0.186 | 0.143 | 0.106 | 0.066 | 0.064 |
主要化合价 | +1 | +3 | +6、-2 | -2 | -1 |
A.简单离子半径 B.气态氢化物的稳定性
C.单质的氧化性 D.最高价氧化物对应水化物的碱性
6.下列装置能达到实验目的的是
A.从食盐水中提取NaCl B.除中的
C.制取 D.氧化碘离子
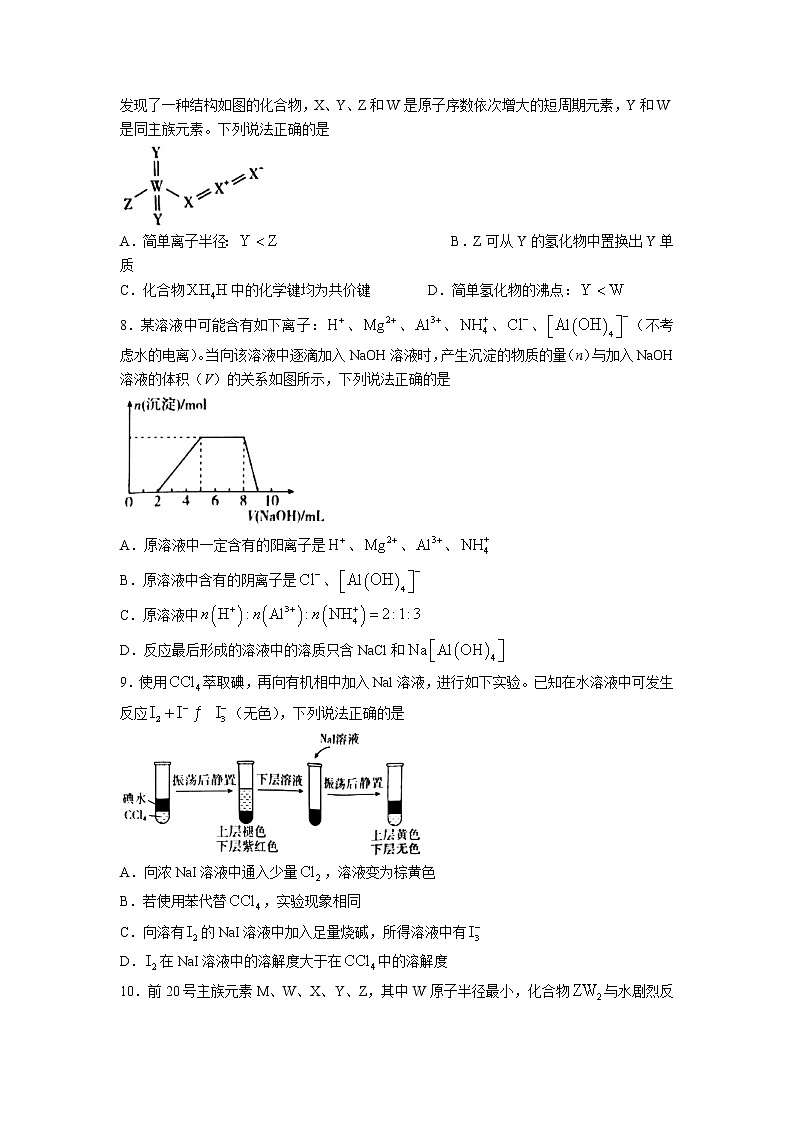
7.2022年诺贝尔化学奖授予了点击化学等领域。我国科学家在研究点击反应砌块的过程中,发现了一种结构如图的化合物,X、Y、Z和W是原子序数依次增大的短周期元素,Y和W是同主族元素。下列说法正确的是
A.简单离子半径: B.Z可从Y的氢化物中置换出Y单质
C.化合物中的化学键均为共价键 D.简单氢化物的沸点:
8.某溶液中可能含有如下离子:、、、、、(不考虑水的电离)。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
A.原溶液中一定含有的阳离子是、、、
B.原溶液中含有的阴离子是、
C.原溶液中
D.反应最后形成的溶液中的溶质只含NaCl和
9.使用萃取碘,再向有机相中加入Nal溶液,进行如下实验。已知在水溶液中可发生反应(无色),下列说法正确的是
A.向浓NaI溶液中通入少量,溶液变为棕黄色
B.若使用苯代替,实验现象相同
C.向溶有的NaI溶液中加入足量烧碱,所得溶液中有
D.在NaI溶液中的溶解度大于在中的溶解度
10.前20号主族元素M、W、X、Y、Z,其中W原子半径最小,化合物与水剧烈反应,生成一种强碱和一种可燃性气体单质,M与X同族,且X的最外层电子数是电子层数的3倍,常温下,Y的单质能溶于M的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A.化合物中既含有离子键又含有共价键
B.简单离子半径:
C.M与X形成的一种化合物可以与W与X形成的一种化合物生成强酸
D.工业上电解相应氯化物冶炼Y单质
二、选择题:本题共5小题,每小题4分,共20分,每小题有1个或2个选项符合题意。全部选对得4分,选对但不全的得2分,有选错的得0分。
11.短周期主族元素a、b、c、d,原子序数依次增大,a与氢元素形成的一种二元化合物是常用的绿色氧化剂,c元素在地壳中含量排第三位,d最外层电子数是K层电子数的3倍。下列叙述不正确的是
A.a和b形成的二元化合物只含离子键 B.b不一定是金属元素
C.c的最高价氧化物对应的水化物是强碱 D.简单阴离子的还原性a<d
12.某锂离子电池的正极材料为、碳粉及铝箔,某化学兴趣小组设计下列室温下的流程处理废旧锂离子电池的正极材料,下列离子反应方程式书写正确的是
A.加入过量NaOH溶液:
B.被氧化:
C.滤液Ⅱ加入饱和碳酸钠溶液:
D.滤液Ⅰ加入过量:;
13.某陶瓷颗粒增强材料()由原子序数依次增大的X、Y、Z、W四种短周期主族元素组成,其中X与Y同周期,X原子电子层数是最外层电子数的2倍,且X与Z的最外层电子数之和与W的最外层电子数相同,W的单质可用于制造太阳能电池板。下列说法错误的是
A.简单离子半径: B.最简单氢化物的热稳定性:
C.Z和Y形成的化合物可与强酸、强碱反应 D.X在空气中燃烧可形成型化合物
14.主要成分为、,还含有少量的高硫铝土矿可用来生产并获得,工艺流程如下,下列叙述中不正确的是
A.加入CaO可有效防止硫酸型酸雨的形成
B.加入NaOH溶液可溶解并使铁元素转化为实现铝、铁元素的分离
C.向滤液中通入足量的二氧化碳,可将铝元素转化为
D.烧渣分离可用磁选法
15.某离子化合物甲的结构如图所示,图中“—”代表一对共用电子,W、X、Y、Z为元素周期表中的短周期主族元素,且原子序数依次增大,W和Y、X和Z分别为同主族元素,且四种元素原子的最外层电子数之和为14。下列叙述不正确的是
A.化合物甲溶于水有离子键和共价键的断裂
B.W与X可形成多种10电子微粒
C.的电子式为
D.等物质的量的Y和Z的最高价氧化物对应的水化物之间反应生成化合物甲
三、非选择题:本题共5小题,共60分。
16.(12分)
下表是周期表的一部分,根据①至⑩元素在周期表中的位置,回答下列问题。
① |
|
| |||||||||||||||
|
|
|
| ⑥ |
|
|
|
| |||||||||
② | ③ |
| ⑦ | ⑧ |
| ⑨ |
| ||||||||||
| ④ |
|
|
|
|
|
|
|
|
|
|
|
|
|
| ⑩ |
|
(1)⑤在周期表中的位置为 ;①⑥两元素组成的简单化合物的分子空间结构为 形。
(2)②最高价氧化物对应水化物的电子式为 。
(3)③④⑥三种元素的原子半径由大到小的顺序为 (用元素符号表示)。
(4)用一个化学方程式证明⑥⑦的非金属性强弱 。
(5)⑦⑧⑨最高价氧化物对应水化物的酸性由强到弱的顺序为 。(用化学式表示)
(6)⑩的原子结构示意图为 。
17.(12分)
某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学用以下实验探究Mg、Al的金属性强弱,请填写完整实验操作和实验结论:
实验目的 | 比较Mg、Al金属性强弱 |
实验试剂 | 热水、酚酞 |
实验操作 | 将打磨好的镁片和铝片(1) |
实验现象 | Mg片表面逐渐产生气泡,溶液变为浅红色,铝片的表面和溶液无明显变化 |
实验结论 | 金属性:(2) |
Ⅱ.乙同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图的装置来一次性完成元素Cl、C、Si非金属性强弱比较的实验研究。
可选用的实验药品有:1.0 HCl、1.0 (挥发性强酸)、碳酸钙(固体)、1.0 溶液。
打开A处的活塞后,可看到有大量气泡产生,烧杯中可观察到有白色沉淀生成。
(1)图中B的仪器名称为 ,A中所装的试剂为 (只填化学式)。
(2)B中发生反应的离子方程式为 。
(3)乙同学认为甲同学设计的实验不够严谨,应在B和C之间增加一个装置,该装置中所盛试剂为 溶液。
18.(12分)
海带中既含有有机碘化合物又含有碘化钠等无机碘化合物。某课题组探究了海带提碘的优化条件,并用色度计测定了某海带样品中碘的含量。实验步骤:
Ⅰ.预处理:将干海带刷净,剪成1~2cm大小的方块,准确称量3.0g样品。
Ⅱ.灰化:选择合适的仪器用酒精灯加热干海带,并用玻璃棒不断搅拌,记录加热时间,停止加热,冷却。
Ⅲ.过滤:将冷却后的海带灰转移到50mL烧杯中,加入15mL蒸馏水,静置后过滤。
Ⅳ.氧化:向滤液中加入稀和溶液,充分反应后将滤液转移到分液漏斗中。
Ⅴ.萃取:向分液漏斗中加入,振荡,静置。待溶液完全分层后,取下层溶液。
Ⅵ.含量测定:用色度计测定出所得溶液中碘的含量。
Ⅶ.回收处理:蒸馏碘的溶液,回收
回答下列问题:
(1)第Ⅱ步选择使用的主要仪器是 。
(2)设计实验证明第Ⅲ步滤液中的存在 。
(3)第Ⅳ步氧化过程中发生反应的离子方程式为 。
(4)第Ⅴ步:萃取后分液时若打开玻璃活塞后发现液体流不出,原因可能是 。第Ⅴ步可得到的溶液,也可用如下流程从其中回收:
请写出步骤Ⅱ的离子方程式: 。
(5)碘浓度越大吸光度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度(μ)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的溶液,取出0.10mL加入3.90mL 中配得第一份碘的标准溶液。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是 μ。
(6)课题组在其他实验条件相同情况下,研究了不同灰化时间对碘提取效果的影响。其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是 。
19.(12分)
海洋中蕴含着丰富的资源,我们通过“浓缩、氧化、提取”等步骤提取其中的溴单质等资源。为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:苦卤含溴海水含溴空气溴水混合物溴蒸气液溴
乙:苦卤含溴海水溴蒸气液溴
(1)甲同学方案中步骤①硫酸酸化的目的是 。
(2)步骤③通入热空气或水蒸气吹出,利用了溴的 性。甲同学步骤④所发生反应的化学反应方程式为 。
(3)步骤④用水溶液吸收,吸收率可达95%,由此反应可知,除环境保护外,该工业生产还应解决的主要问题是 。
(4)步骤④中被氧化生成,写出检验的方法 。
(5)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是 (填“甲”或“乙”),理由是 。
20.(12分)
中药剂砒霜(主要成分为)可用于治疗急性白血病。工业上利用酸性高浓度含砷废水[主要成分是亚砷酸()和砷酸()]提取粗的工艺流程如图所示。
已知:As是第4周期VA族元素;微溶于水,难溶于水。回答下列问题:
(1)中As的化合价是 ;比较酸性强弱: (填“>”或“<”)。
(2)若试剂①选择,则“氧化”过程反应中氧化剂与还原剂的物质的量之比是 。
(3)写出“还原”过程发生反应的化学方程式 。
(4)从综合利用的角度看,“滤液②”的主要成分可返回 步骤中循环再利用。
(5)还原步骤之后一系列操作,分解为,结晶得到粗,在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。为了提高粗的沉淀率,结晶过程中应控制的条件为 。
(6)粗产品(含杂质)中质量分数的测定:称取m g粗产品溶于适量NaOH溶液,得到含、的混合溶液100mL。取20.00mL上述溶液与0.02000的溶液进行反应(碱性环境中可将氧化为),消耗8.000mL溶液,粗产品中的质量分数为 (用含有m的代数式表示)。
山东省新高考联合质量测评2023届高三3月联考化学试卷: 这是一份山东省新高考联合质量测评2023届高三3月联考化学试卷,共12页。试卷主要包含了5Cu 64,5g,则c电极产生 2,5倍,则此时v,65,8<n<6②>A等内容,欢迎下载使用。
2023届山东省新高考联合质量测评高三下学期3月联考化学试题含答案: 这是一份2023届山东省新高考联合质量测评高三下学期3月联考化学试题含答案,共17页。试卷主要包含了5Cu 64,5g,则c电极产生 2,5倍,则此时v,65,8<n<6②>等内容,欢迎下载使用。
山东省新高考2023届新高考联合质量测评高三3月联考 化学答案: 这是一份山东省新高考2023届新高考联合质量测评高三3月联考 化学答案,共1页。












