
河南省五年(2018-2022)中考化学真题分题型分层汇编-11身边的化学物质(填空题)
展开河南省五年(2018-2022)中考化学真题分题型分层汇编-11身边的化学物质(填空题)
一、填空题
1.(2022·河南·统考中考真题)铁是目前世界上年产量最高的金属。工业上用铁矿石炼铁的反应原理为_______(用化学方程式表示);铁制品锈蚀的过程是铁与空气中的_______同时发生化学反应的过程。
2.(2022·河南·统考中考真题)一百多年前,法国化学家拉瓦锡得出空气是由_______和氧气组成的结论。2022年,中国科学家用CO2和H2O为原料合成了葡萄糖,其化学式为_______。
3.(2022·河南·统考中考真题)金属的性质是化学学习和研究的重要内容。
(1)铝比较活泼,为什么铝制品却有良好的抗腐蚀性能?_____。
(2)古籍记载镍白铜(主要成分为铜、镍、锌)是中国古代发明和研制出的铜合金。为了探究铜、镍(Ni)、锌的金属活动性顺序,某化学小组设计了如下实验方案
实验步骤 | 实验现象 | 结论或化学方程式 |
①把镍片放入稀硫酸中 | 有气泡产生 | 化学方程式为____(镍显+2价) |
②把镍片放入_______溶液中 | 镍片表面无明显变化 | 锌的金属活动性大于镍 三种金属的活动性顺序为:Zn>Ni>Cu |
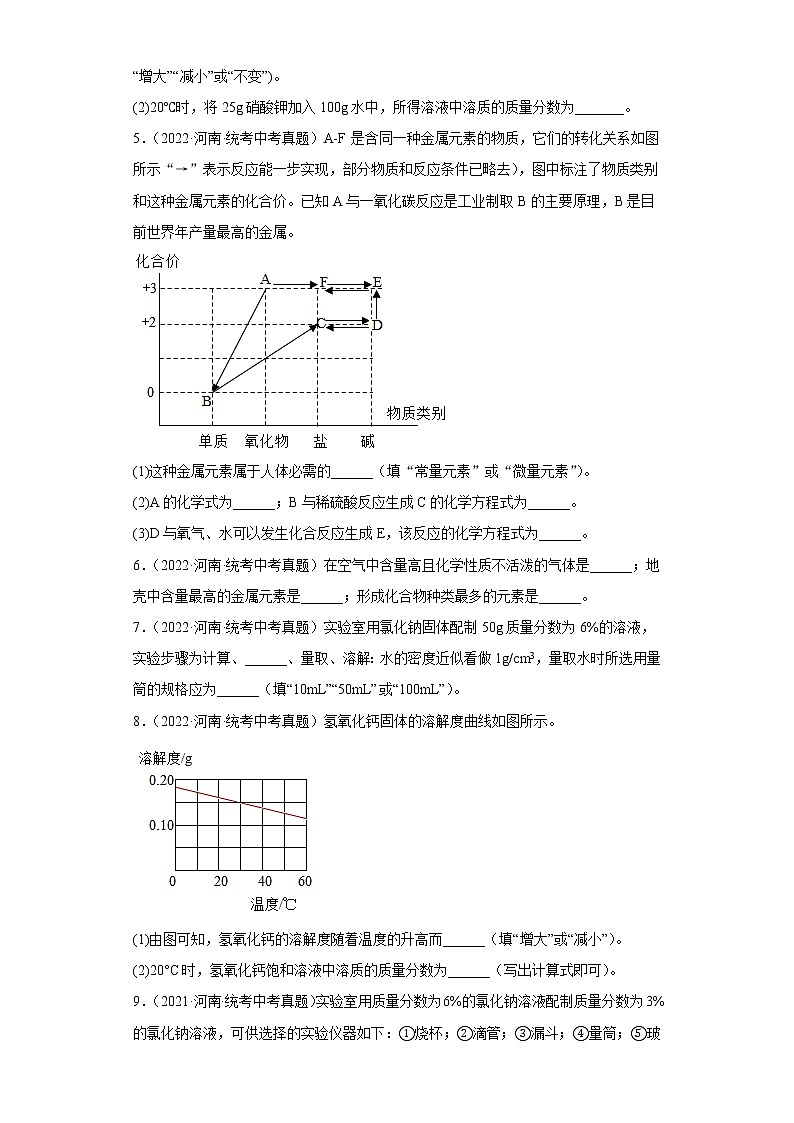
4.(2022·河南·统考中考真题)硝酸钾固体的溶解度曲线如图所示
(1)将40℃时一定质量的硝酸钾饱和溶液降温至20℃,该溶液中溶质的质量会_______(填“增大”“减小”或“不变”)。
(2)20℃时,将25g硝酸钾加入100g水中,所得溶液中溶质的质量分数为_______。
5.(2022·河南·统考中考真题)A-F是含同一种金属元素的物质,它们的转化关系如图所示“→”表示反应能一步实现,部分物质和反应条件已略去),图中标注了物质类别和这种金属元素的化合价。已知A与一氧化碳反应是工业制取B的主要原理,B是目前世界年产量最高的金属。
(1)这种金属元素属于人体必需的______(填“常量元素”或“微量元素”)。
(2)A的化学式为______;B与稀硫酸反应生成C的化学方程式为______。
(3)D与氧气、水可以发生化合反应生成E,该反应的化学方程式为______。
6.(2022·河南·统考中考真题)在空气中含量高且化学性质不活泼的气体是______;地壳中含量最高的金属元素是______;形成化合物种类最多的元素是______。
7.(2022·河南·统考中考真题)实验室用氯化钠固体配制50g质量分数为6%的溶液,实验步骤为计算、______、量取、溶解:水的密度近似看做1g/cm3,量取水时所选用量筒的规格应为______(填“10mL”“50mL”或“100mL”)。
8.(2022·河南·统考中考真题)氢氧化钙固体的溶解度曲线如图所示。
(1)由图可知,氢氧化钙的溶解度随着温度的升高而______(填“增大”或“减小”)。
(2)20°C时,氢氧化钙饱和溶液中溶质的质量分数为______(写出计算式即可)。
9.(2021·河南·统考中考真题)实验室用质量分数为6%的氯化钠溶液配制质量分数为3%的氯化钠溶液,可供选择的实验仪器如下:①烧杯;②滴管;③漏斗;④量筒;⑤玻璃棒;⑥酒精灯。
(1)配制过程中,上述不需要使用的仪器有_____(填序号)。
(2)若其他操作正确,量取氯化钠溶液时俯视量筒读数,请分析对结果造成的影响_____。
10.(2021·河南·统考中考真题)如图是氯化钠和硝酸钾两种固体的溶解度曲线。
(1)t℃时,两种物质的饱和溶液中溶质的质量分数_____(填“相等”或“不相等”)。
(2)若硝酸钾中含有少量氯化钠,提纯方法为_____。
(3)60℃时,将50g质量分数为20%的硝酸钾溶液变为饱和溶液,需要加入硝酸钾的质量为_____g。
11.(2021·河南·统考中考真题)如图为空气成分示意图(按体积计算),其中“X”代表的物质是_____;“Y”中含有稀有气体氦,其元素符号为_____。
12.(2021·河南·统考中考真题)空气中含量多且常用作保护气的是______,人体中含量最高的元素是______。
13.(2021·河南·统考中考真题)氢氧化钠溶液与盐酸反应的化学方程式为______,如图是该反应的微观示意图,则该反应前后没有发生变化的离子有______,从微观角度看,该化学反应的实质是______。
14.(2021·河南·统考中考真题)大米、面粉中含有的糖类物质主要是淀粉,淀粉的化学式为______(填“C2H5OH”、“C6H12O6”或“(C6H10O5)n”);施用化肥是农业增产的重要手段,尿素(CO(NH2)2)属于______(填“氮肥”“磷肥”或“钾肥”)。
15.(2021·河南·统考中考真题)开发利用清洁高效的新能源,减少CO2的排放,有利于实现“碳中和”。
(1)氢气是一种理想的新能源,氢气燃烧的化学方程式为______,实验室用锌与稀硫酸反应制取氢气的化学方程式为______。
(2)某有机物与N2O4反应释放能量,可做高能能源。该有机物18g与一定质量的N2O4恰好完全反应,可生成26.4gCO2、21.6gH2O和25.2gN2,实验测得其相对分子质量为60,该有机物的化学式为______。
16.(2020·河南·统考中考真题)某化学小组从孔雀石【主要成分CuCO3·Cu(OH)2】中提取金属铜的实验步骤如下:将孔雀石粉碎,加过量稀硫酸,充分反应后过滤,向滤液中加入一种金属粉末。
(1)请填空:____。
(2)写出可以加入的一种金属并说明理由______。
17.(2020·河南·统考中考真题)化学与人类社会生活密不可分,请回答下列问题。
(1)我们倡导“低碳”生活,“低碳”是指哪种物质的较低量排放____________?
(2)铝的化学性质活泼,为什么铝制品却有很好的抗腐蚀性能____________?
18.(2020·河南·统考中考真题)地壳中含量最多的元素是_______ ; 空气中体积分数约为78%的气体是____。
19.(2020·河南·统考中考真题)实验室配制一定溶质质量分数的氯化钠溶液时,所需氯化钠固体应放在托盘天平的____(填“左盘”或“右盘”)。上进行称量;若所配制溶质溶液的质量分数偏大,则可能是量取水时______( 填“俯视”或“仰视”)量筒读数所致。
20.(2019·河南·中考真题)如图是甲、乙固体的溶解度曲线。甲、乙溶解度相等时的温度为_____℃;将a1℃时等质量甲、乙饱和溶液升温到a2℃,溶质的质量为甲_____乙(填“大于”“小于”或“等于”); a2℃时,65g甲饱和溶液稀释到20%,需加水_____g。
21.(2019·河南·中考真题)天然气(主要成分为CH4)完全燃烧的化学方程式为_____;某种燃气灶的燃料由水煤气(CO和H2的混合气体)改为天然气后,灶具的进风口应_____(填“改大”“改小”或“不变”);氢气作为新能源的优点是_____(答出一条即可)。
22.(2019·河南·中考真题)质量相等的四种物质①H2O2②KMnO4③KClO3④H2O,完全分解后所制得氧气的质量由大到小的顺序为_____(填序号,下同);四种金属①Zn②Mg③Al④Fe分别投入质量相等且足量的稀硫酸中,充分反应后所得四种溶液的质量相等,则投入金属的质量由小到大的顺序为_____。
23.(2019·河南·中考真题)如图,将注射器中的溶液缓缓推入V形管,有关反应的化学方程式为_____;用80℃的热水加热盛有红磷和白磷的W形管时,发现白磷燃烧而红磷不燃烧,由此可说明燃烧需要的条件是_____。
24.(2018·河南·中考真题)人体中含量最高的金属元素是__________;在尿素、硫酸钾、磷酸二氢氨三种化肥中,属于复合肥料的是__________。
参考答案:
1.
氧气、水蒸气
【详解】工业上用铁矿石炼铁的反应原理为氧化铁和一氧化碳在高温条件下反应生成铁和二氧化碳,化学方程式为。
铁生锈是因为铁和氧气、水蒸气同时接触,发生了复杂的化学反应。
2. 氮气 C6H12O6
【详解】1774年法国化学家拉瓦锡通过实验得出了一个重要结论:空气是由氮气和氧气组成的;2022年,中国科学家用CO2和H2O为原料合成了葡萄糖,其化学式为C6H12O6。
3.(1)铝与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化
(2)
硫酸锌(合理即可)
【详解】(1)铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜,从而阻止铝进一步氧化,故铝具有很好的抗腐蚀性。
(2)将镍片放入稀硫酸中,有气泡产生,则说明镍能与硫酸反应生成硫酸镍和氢气,反应的化学方程式为;
②由于结论是镍的金属活动性比锌弱,则镍不能将锌从其化合物溶液中置换出来,故可将镍放入硫酸锌或硝酸锌等溶液中,无明显现象。
4.(1)减小
(2)20%
【详解】(1)从图中可知,硝酸钾溶解度随温度的降低而降低,则硝酸钾饱和溶液降温后硝酸钾溶解度降低,会有硝酸钾析出,则溶液中溶质质量会减少。
(2)20℃时硝酸钾的溶解度为30g,则25g硝酸钾全部溶解,所得溶液的溶质质量分数为。
5.(1)微量元素
(2) Fe2O3 Fe+H2SO4=FeSO4+H2↑
(3)4Fe(OH)2+2H2O+O2=4Fe(OH)3
【解析】(1)B是目前世界年产量最高的金属,B为铁,则这种金属元素是铁元素,属于人体必需的微量元素。
(2)A与一氧化碳反应是工业制取B的主要原理,则A的化学式为Fe2O3;B与稀硫酸反应生成C的反应是铁和稀硫酸反应生成硫酸亚铁和氢气,该反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑。
(3)根据题给信息可知,D是氢氧化亚铁,则D与氧气、水可以发生化合反应生成E,E为氢氧化铁,该反应的化学方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3。
6. 氮气##N2 铝元素##铝##Al 碳元素##碳##C
【详解】氮气约占空气体积的78%,含量高,且化学性质比较稳定,故填:氮气或N2;
地壳中元素含量由多到少依次是(前四位):O、Si、Al、Fe,故含量最高的金属元素是铝元素;
人类已经发现的物质中,绝大部分属于有机物,有机物中都含有碳元素,所以形成化合物种类最多的元素是碳元素。
7. 称量 50mL
【详解】用固体配制一定溶质质量分数的溶液,实验步骤为:计算、称量、量取、溶解;
所需氯化钠的质量为:50g×6%=3g,所需水的质量为:50g-3g=47g,即47mL,量筒量程的选择应遵循“大而近”的原则,故应选择50mL的量筒。
8.(1)减小
(2)
【详解】(1)由图可知,氢氧化钙的溶解度随着温度的升高而减小;
(2)由图可知,20℃时,氢氧化钙的溶解度约为为0.17g,该温度下,氢氧化钙饱和溶液中溶质的质量分数为:。
9.(1)③⑥
(2)会导致所配溶液的质量分数偏小,因俯视读数使所取溶液偏少
【解析】(1)
用质量分数为6%的氯化钠溶液配制质量分数为3%的氯化钠溶液,量筒和滴管用于准确量取6%的氯化钠溶液和水;烧杯用于完成稀释过程;玻璃棒用于搅拌,无需用到漏斗和酒精灯,故填:③⑥;
(2)
使用量筒时仰视读数,读数结果偏小,俯视读数,读数结果偏大,因此实际量取的质量分数为6%的氯化钠少于本该量取的量,故最终制得的氯化钠溶液质量分数小于3%。
10.(1)相等
(2)冷却热饱和溶液
(3)34
【解析】(1)
根据氯化钠和硝酸钾两种固体的溶解度曲线图可以看出,t℃时,两种物质的饱和溶液中溶质的溶解度相等。
t℃时,两种物质的饱和溶液中溶质的质量分数=
因此t℃时,两种物质的饱和溶液中溶质的质量分数相等。
(2)
根据氯化钠和硝酸钾两种固体的溶解度曲线图可以看出,硝酸钾的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响不大,所以若硝酸钾中含有少量氯化钠,可用冷却热饱和溶液(降温结晶)法提纯。
(3)
根据氯化钠和硝酸钾两种固体的溶解度曲线图可以看出,60℃时硝酸钾的溶解度是110g。
设:60℃时,将50g质量分数为20%的硝酸钾溶液变为饱和溶液需要加入硝酸钾的质量为x。
需要加入硝酸钾的质量为34g。
11. 氧气(或者O2) He
【分析】空气中,氮气约占空气体积的这78%,氧气约占空气体积的21%,稀有气体约占空气体积的0.94%。
【详解】根据分析可知,“X”代表的物质是氧气,其化学式为O2;根据元素周期表,氦的元素符号是He。
12. 氮气(或N2) 氧元素(或O)
【详解】空气中含量多且常用作保护气的是氮气,氮气约占空气体积分数的78%,且化学性质稳定,可作保护气;
人体中含量最高的元素是氧元素。
13. Na+、C1- 氢离子与氢氧根离子结合生成水(或)
【详解】氢氧化钠溶液与盐酸反应生成氯化钠和水,反应的化学方程式为:NaOH+HC1=NaC1+H2O,如图是该反应的微观示意图,则该反应前后没有发生变化的离子Na+、C1-,从微观角度看,该化学反应的实质是氢离子与氢氧根离子结合生成水或者H++OH-=H2O 。
14. (C6H10O5)n 氮肥
【详解】大米、面粉中含有的糖类物质主要是淀粉,淀粉的化学式为(C6H10O5)n;
尿素含氮元素,属于氮肥。
15. C2H8N2
【详解】(1)氢气和氧气在点燃的条件下生成水,反应的化学方程式为:,锌和硫酸反应生成硫酸锌和氢气,反应的化学方程式为: ;
(2)根据质量守恒等量可知,参与反应的N2O4的质量为26.4g+21.6g+25.2g-18g=55.2g,则N2O4中氮元素的质量为55.2g××100%=16.8g、氧元素质量为55.2g-16.8g=38.4g;生成物二氧化碳中碳元素的质量为26.4g× ×100%=7.2g、氧元素质量为26.4g-7.2g=19.2g;生成物水中氢元素的质量为21.6g××100%=2.4g、氧元素的质量为21.6g-2.4g=19.2g;生成物N2的质量为25.2g;化学反应前后元素的质量不变,反应物N2O4中氮元素质量为16.8g小于生成物N2的质量25.2g,说明有机物中含有氮元素质量为25.2g-16.8g=8.4g;反应物N2O4中氧元素的质量为38.4g,生成物中氧元素的总质量为19.2g+19.2g=38.4g,质量相等,说明有机物中不含氧元素;反应前N2O4中不含氢元素,反应后生成物中氢元素的质量为2.4g,说明有机物中含有2.4g的氢元素;反应物N2O4不含碳元素,反应后生成物中碳元素的质量为7.2g,说明有机物中含有碳元素7.2g;所以有机物中含有碳、氢、氮三种元素,且三种元素的质量依次为7.2g、2.4g、8.4g,则该有机物中碳、氢、氮原子的原子个数比为 ::=1:4:1,又由于该有机物的相对分子质量为60,可求出该有机物的化学式为C2H8N2,故填:C2H8N2。
16. H2O 铁(合理即可) 在金属活动性顺序里,位于铜前面的金属能把铜从它的盐溶液中置换出来。
【详解】(1)根据质量守恒定律,反应前后原子的种类、数目不变,反应前有:Cu原子2个、S原子2个、C原子1个、O原子13个、H原子6个、,反应后有:Cu原子2个、S原子2个、C原子1个、O原子10个,所填的化学式前面的化学计量数是3,故化学式中含有H原子2个、O原子1个,化学式是H2O;
故填:H2O。
(2)充分反应后过滤,滤液中的溶质是硫酸铜,要把硫酸铜溶液中的铜置换出来,只要加入在金属活动性顺序里,位于铜前面的金属(除钾、钙、钠),如:铁(合理即可);
故填:铁(合理即可) 在金属活动性顺序里,位于铜前面的金属能把铜从它的盐溶液中置换出来。
17. 二氧化碳 铝与氧气在常温下反应生成一层致密的氧化铝薄膜
【详解】(1) “低碳”是指较低二氧化碳排放,二氧化碳气体排放过量会导致温室效应加剧等环境问题。
(2)铝的化学性质活泼,在常温下,铝就能与空气中的氧气反应生成一层致密的氧化铝薄膜,阻止了反应的进一步进行。
18. 氧元素(或O) 氮气(或N2)
【详解】地壳中含量最多的是氧元素(或O) ;空气中体积分数约为78%的气体是氮气(或N2)。
19. 左盘 俯视
【详解】实验室配制一定溶质质量分数的氯化钠溶液时,根据“左物右码”,所需氯化钠固体应放在托盘天平的左盘上进行称量;若所配制溶质溶液的质量分数偏大,则可能是量取水时俯视量筒读数所致,“俯视”造成量取水的体积偏小,所配制溶质溶液的质量分数偏大。
20. a1 等于 10
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【详解】通过分析溶解度曲线可知,甲、乙溶解度相等时的温度为a1℃,将a1℃时,等质量甲、乙饱和溶液升温到a2℃,溶解度增大,不会析出晶体,所以溶质的质量为甲等于乙,a2℃时,甲物质的溶解度是30g,所以65g甲饱和溶液中含有的溶质的质量为,稀释后溶液的质量为,故需要加水的质量为
。
【点睛】溶液稀释前后,溶质的质量不变。
21. 改大 来源广(或热值高、无污染等)
【分析】天然气的主要成分是甲烷,甲烷在点燃条件下燃烧生成二氧化碳和水。
【详解】天然气的主要成分是甲烷,甲烷在点燃条件下燃烧生成二氧化碳和水,反应的化学方程式为。由化学方程式为,;,由微观粒子个数比可知,燃烧相同体积的管道煤气和天然气时,天然气消耗的氧气多;燃烧管道煤气的灶具如需改燃天然气,灶具的改进方法是增大进风口。
氢气可以用水做原料来制取,地球上水资源丰富,来源广泛;燃烧相同质量的氢气和汽油,前者放出的热量是后者放出热量的3倍,氢气的燃烧热值高;氢气燃烧的产物只有水,不污染环境。
22. ④①③② ①④②③
【详解】根据所给物质写出这4个反应的化学方程式,按O2的化学计量数为1进行配平;计算每种物质与O2的质量比,然后比较得出答案。
生成32克的O2所需H2O2、KMnO4、KClO3、H2O 4种物质的质量分别为68g、316g、81.7g、36g,所以完全分解后所制得氧气的质量由大到小的顺序为④①③②。
Zn、Mg、Al、Fe分别投入质量相等且足量的稀硫酸中,充分反应后所得四种溶液的质量相等,说明溶液质量增加的质量相等,即加入的金属质量减去生成的氢气的质量相等,
设锌的质量为a,镁的质量为x,铝的质量为y,铁的质量为z,则:
则
即,故a<z<x<y,即m(Zn)<m(Fe)<m(Mg)<m(Al),
故投入金属的质量由小到大的顺序为①④②③。
23. 需要温度达到可燃物着火点
【分析】燃烧条件:物质是可燃物、有氧气参与、温度达到可燃物的着火点,过氧化氢在二氧化锰的催化作用下分解为水和氧气,磷和氧气点燃生成五氧化二磷。
【详解】过氧化氢在二氧化锰的催化作用下分解为水和氧气,反应的化学方程式为,用80℃的热水加热盛有红磷和白磷的W形管时,发现白磷燃烧而红磷不燃烧,二者都是可燃物,都接触氧气,但是由于着火点不同,所以现象不同,由此可说明燃烧需要温度达到可燃物着火点。
24. Ca(或钙) NH4H2PO4(或磷酸二氢氨)
【详解】根据人体中含量最高的金属元素是钙解答;根据含有N、P、K两种以上营养元素的肥料是复合肥解答。人体中含量最高的金属元素是Ca(或钙);NH4H2PO4(或磷酸二氢氨)中含有N、P,属于复合肥。
宁夏五年(2018-2022)中考化学真题分题型分层汇编-08填空题: 这是一份宁夏五年(2018-2022)中考化学真题分题型分层汇编-08填空题,共11页。试卷主要包含了填空题等内容,欢迎下载使用。
河南省五年(2018-2022)中考化学真题分题型分层汇编-11物质的构成(填空题): 这是一份河南省五年(2018-2022)中考化学真题分题型分层汇编-11物质的构成(填空题),共6页。试卷主要包含了填空题等内容,欢迎下载使用。
河南省五年(2018-2022)中考化学真题分题型分层汇编-10物质的化学变化(填空题): 这是一份河南省五年(2018-2022)中考化学真题分题型分层汇编-10物质的化学变化(填空题),共7页。试卷主要包含了填空题等内容,欢迎下载使用。












