
2023届高考化学二轮复习化学反应速率与化学平衡作业含解析
展开化学反应速率与化学平衡
一、选择题(本大题共12小题)
1.(2022·山东济南·二模)均相芬顿反应原理是高级氧化技术的经典工艺之一,如图所示(和为速率常数)。下列说法错误的是
A.相同条件下,基元反应Ⅰ比Ⅱ的活化能低
B.基元反应Ⅰ中氧元素的化合价没有发生变化
C.基元反应Ⅱ的化学方程式为
D.芬顿反应进行的过程中,整个体系的几乎不变(忽略体积变化)
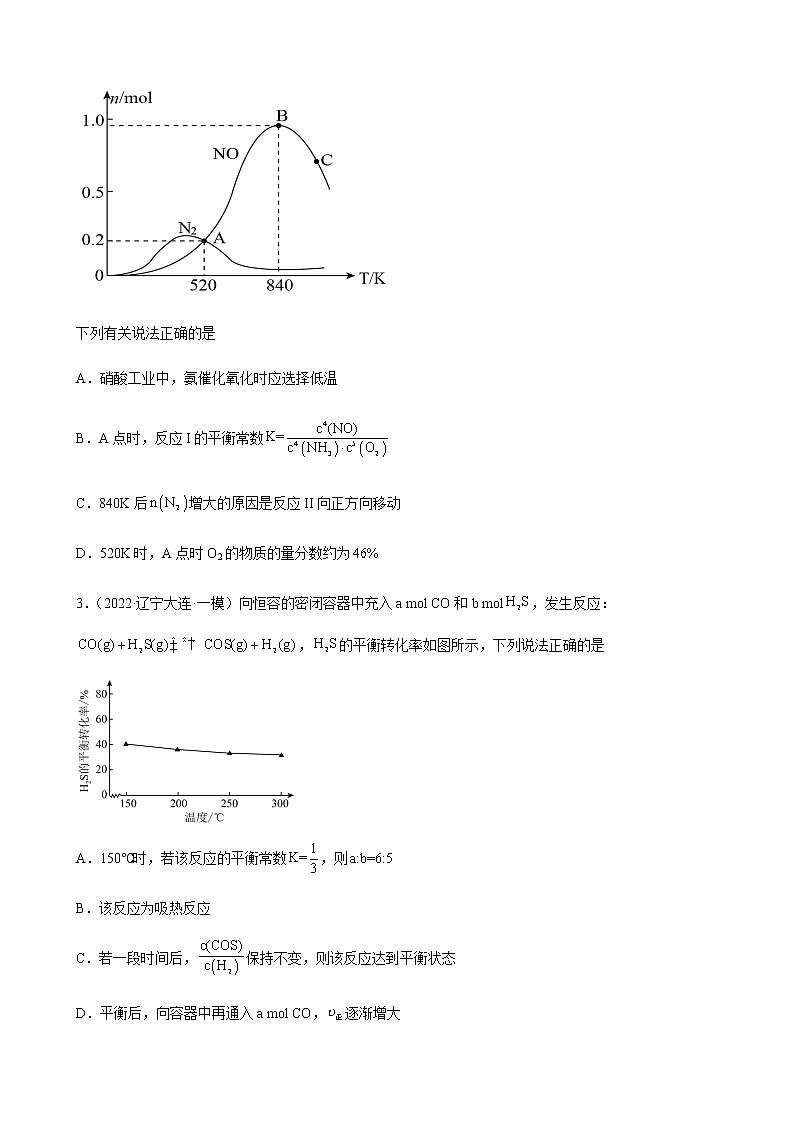
2.(2022·江苏扬州·一模)氨的催化氧化是工业制硝酸的基础,反应时会发生如下两个竞争反应I、II。
I
II
为分析催化剂对该反应的选择性,在密闭容器中充入和,测得有关产物的物质的量与温度的关系如图。
下列有关说法正确的是
A.硝酸工业中,氨催化氧化时应选择低温
B.A点时,反应I的平衡常数
C.840K后增大的原因是反应II向正方向移动
D.520K时,A点时O2的物质的量分数约为
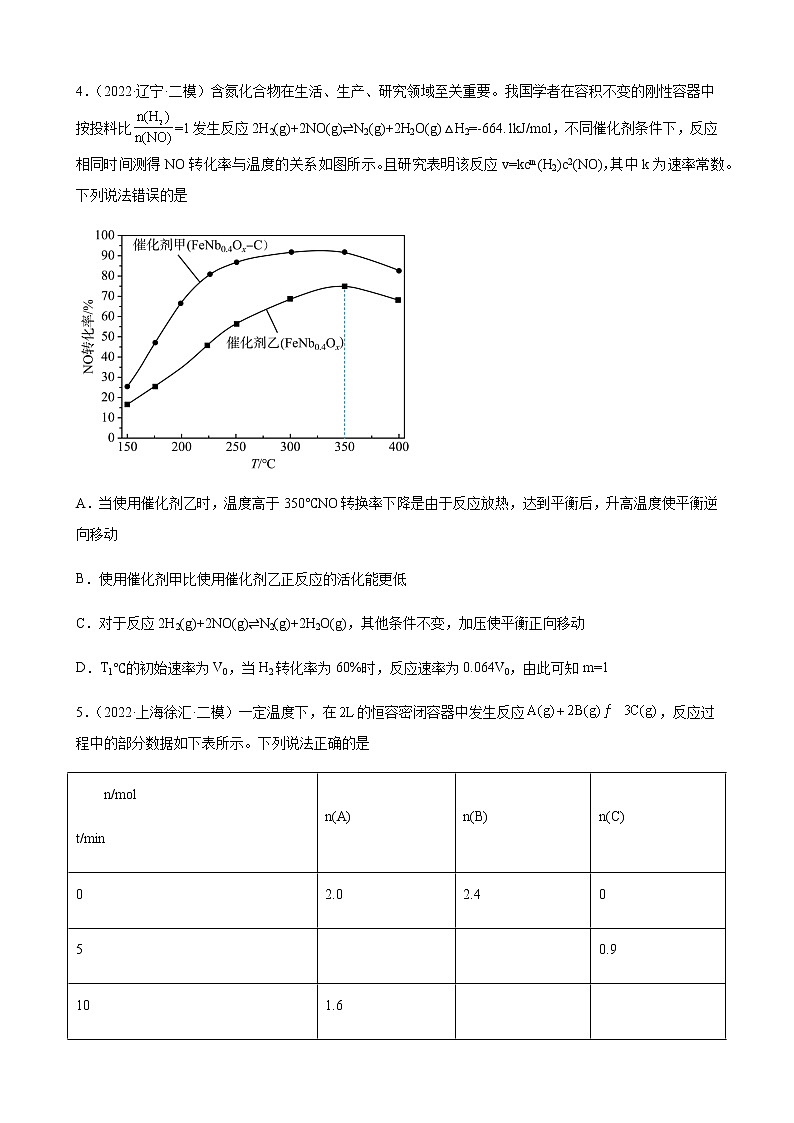
3.(2022·辽宁大连·一模)向恒容的密闭容器中充入a mol CO和b mol,发生反应:,的平衡转化率如图所示,下列说法正确的是
A.150℃时,若该反应的平衡常数,则
B.该反应为吸热反应
C.若一段时间后,保持不变,则该反应达到平衡状态
D.平衡后,向容器中再通入a mol CO,逐渐增大
4.(2022·辽宁·二模)含氮化合物在生活、生产、研究领域至关重要。我国学者在容积不变的刚性容器中按投料比=1发生反应2H2(g)+2NO(g)⇌N2(g)+2H2O(g) △H2=-664.1kJ/mol,不同催化剂条件下,反应相同时间测得NO转化率与温度的关系如图所示。且研究表明该反应v=kcm(H2)c2(NO),其中k为速率常数。下列说法错误的是
A.当使用催化剂乙时,温度高于350℃NO转换率下降是由于反应放热,达到平衡后,升高温度使平衡逆向移动
B.使用催化剂甲比使用催化剂乙正反应的活化能更低
C.对于反应2H2(g)+2NO(g)⇌N2(g)+2H2O(g),其他条件不变,加压使平衡正向移动
D.T1℃的初始速率为V0,当H2转化率为60%时,反应速率为0.064V0,由此可知m=1
5.(2022·上海徐汇·二模)一定温度下,在的恒容密闭容器中发生反应,反应过程中的部分数据如下表所示。下列说法正确的是
n/mol
t/min
n(A)
n(B)
n(C)
0
2.0
2.4
0
5
0.9
10
1.6
15
1.6
A.物质B的平衡转化率为
B.该反应在后才达到平衡
C.平衡状态时,
D.用A表示的平均反应速率为
6.(2022·辽宁大连·一模)某温度下,改变0.1mol/L溶液的pH时,各种含铬元素粒子及浓度变化如图所示(已知a是二元酸),下列有关说法正确的是
A.该温度下的
B.溶液中存在平衡,且该温度下此反应的平衡常数
C.E点溶液中存在:
D.向溶液中,加入一定量NaOH固体,溶液橙色加深
7.(2022·江苏·模拟预测)氮及其化合物在生产生活中具有广泛用途。是一种重要的化工原料,主要用于化肥工业,也广泛用于生产硝酸。 △H=-/mol;氮的氧化物对空气有污染,已知能被溶液吸收生成配合物。对于反应 △H=-/mol,下列说法正确的是
A.该反应只有在高温条件下能自发进行
B.升高温度,该反应的平衡常数减小
C.和充分反应放出的热量为
D.断裂键的同时生成键,说明反应达到平衡状态
8.(2022·上海·二模)某温度下,改变0.1mol/LK2Cr2O7溶液的pH时,各种含铬元素微粒及OH-浓度变化如图所示(已知H2CrO4是二元酸),下列有关说法中正确的是
A.该温度下的Kw=10-13
B.溶液中存在平衡+H2O⇌2+2H+,该温度下此反应的K=10-13.2
C.向0.1mol/LK2Cr2O7溶液中加入一定量NaOH固体,溶液橙色加深
D.E点溶液中存在:c(K+)<2c()+3c()
9.(2022·山东·模拟预测)卤代烃可以和乙醇反应生成醚,反应历程可表示如图:
能量变化如图所示,
下列说法正确的是
A.高温条件下有利于反应I的进行
B.反应II是决速步骤
C.反应III的中间体比反应IV的中间体稳定
D.各步反应都有共价键的断裂和生成
10.(2022·上海·模拟预测)为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如图所示。
查阅资料,平衡I:Cu(OH)2+4NH3[Cu(NH3)4]2++2OH-;
平衡II:Cu(OH)2+2OH-[Cu(OH)4]2−
下列说法不正确的是
A.废水中Cu2+处理的最佳pH约为9
B.b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,上层清液中铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,上层清液中铜元素含量下降
D.d点以后,随c(OH-)增加,上层清液中铜元素含量可能上升
11.(2022·上海·模拟预测)下图表示可逆反应:的化学反应速率与时间的关系曲线,下列叙述正确的是
A.时,反应逆向进行 B.时,一定为
C.时,在该条件下转化率达到最大 D.,反应停止
12.(2022·上海·二模)恒容密闭容器中充入amolCO和bmolH2S,发生CO(g)+H2S(g)⇌COS(g)+H2(g),H2S平衡转化率如图所示。下列说法中正确的是
A.150℃时,若该反应的平衡常数K=,则a:b=6:5
B.该反应为吸热反应
C.通入CO后,正反应速率逐渐增大
D.若一段时间后,保持不变,则该反应达到平衡状态
13.(2022·上海宝山·模拟预测)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g),在一定条件下生成甲醇的量如图所示。根据图像,计算在500℃时,从反应开始到平衡的氢气的平均反应速率
A.mol·L-1·min-1 B.mol·L-1·min-1
C.mol·L-1·min-1 D.mol·L-1·s-1
14.(2022·湖南省桂东县第一中学二模)铁触媒催化合成氨的反应可表示为N2(g)+ H2(g) NH3(g),该反应历程如下图所示,其中吸附在催化剂表面的物质用“ad”表示。下列说法错误的是
A.氨气在催化剂表面的脱附是放热过程
B.该反应的ΔH=-56 kJ/mol
C.历程中只涉及到共价键的断裂与形成
D.反应Nad+3HadNHad+2Had在历程中速率最慢
二、非选择题(本大题共8小题)
15.(2022·山东潍坊·二模)晶体硅材料是最主要的光伏材料,随当前信息工程的发展,硅主要用于微电子技术。工业上将粗硅氯化、精馏后得到SiCl4和SiHCl3的混合物然后用H2还原得到高纯硅。还原过程中发生的主要反应为:
i.SiCl4(g)+2H2(g)Si(s)+4HCl(g) △H1=akJ/mol
ii.SiHCl3(g)+H2(g)Si(s)+3HCl(g) △H2=bkJ/mol
回答下列问题:
(1)已知:2SiHCl3(g)SiCl4(g)+SiH2Cl2(g) △H3=48kJ/mol
H2(g)还原SiCl4(g)生成SiH2Cl2(g)的热化学方程式为_______。
(2)在T1、T2温度下,将1molSiCl4(g)、1molSiHCl3(g)和3molH2(g)加入体积固定的密团容器中,在催化条件下发生反应i、ii。测得H2的转化率及体系内的压强随时间的变化关系如图所示。
①T2温度下,反应达到平衡时SiHCl3(g)的转化率_______。
②T2温度下,反应i的标准平衡常数Kθ的计算式为_______。
(已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g)gG(g)+hH(g)的Kθ=,其中pθ=106Pa,pG、pH、pD、pE为各组分的平衡分压)。
③△H2_______0(填“>”或“<”),写出推理过程_______。
④要增大SiCl4(g)的转化率可以采取的措施有_______(写其中的一条即可)。
(3)研究发现,反应SiCl4(g)+SiH2Cl2(g)2SiHCl3(g)的活化能Ea=100kJ/mol。反应的活化能Ea、速率常数k、温度T满足关系:ln==-。
已知:R=8.3×10-3kJ/(mol·K);ln10=2.3
①若T1=300K,通过升高温度到595K,才能满足=108以加快反应速率;
②若T=300K,使用催化剂使活化能降低,满足=108以加快反应速率,Ea应减小。
上述②中Ea应减小_______kJ/mol(保留1位小数);对比①和②你得到的结论是_______。
16.(2022·河北唐山·二模)甲醇和甲醛是重要的化工原料。利用气态甲醇在催化剂条件下脱氢制备甲醛的主要反应为:,反应机理图示如下:(其中虚线部分为副反应)
回答下列问题:
(1)主要反应的最大能垒为_______。
(2)副反应的热化学方程式为_______。
(3)已知
则的_______。
(4)在体积的刚性容器中,投入气态,在一定催化剂作用下,反应时间时,分别测得甲醇转化率和甲醛的选择性与温度的关系,如下图所示:(甲醛的选择性:转化的中生成的百分比)。
①时内生成甲醛的平均反应速率是_______。
②若时恰好平衡,容器的初始压强为,甲醇的转化率为,甲醛的选择性为,主要反应的压强平衡常数为_______。
③以后,甲醛的选择性下降的可能原因为_______。
(5)利用甲醇、氯气和氢气为原料在℃及一定催化剂条件下制取一氯甲烷,反应原理如下:。现将等物质的量的反应物分别投入到温度相同,容积是1L、2L的甲乙两个恒温、恒容的容器中,达到平衡(不考虑副反应发生),下列说法正确的是_______(填字母代号)。
A.甲乙密度相同,的体积分数不同
B.甲乙正反应速率不同,放出的热量相同
C.甲乙压强不同,混合气体的平均相对分子质量相同
D.甲乙的转化率相同,混合气体的颜色相同
17.(2022·广东韶关·二模)氨气是重要的化工原料,广泛应用于化工、轻工、制药、合成纤维等领城。
(1)一定条件下,Haber法工业合成氨反应的能量变化如图所示(ad表示被催化剂吸附,反应历程中粒子均为气态):
①该条件下,N2(g)+3H2(g)⇌2NH3(g) △H=_______。
②写出一条既能加快反应速率又能提高N2平衡转化率的措施_______。
(2)工业上用NH3催化还原烟气中NOx可以消除氮氧化物的污染。烟气以一定的流速通过两种不同催化剂,测得烟气脱氮率(即氮氧化物转化率)与温度的关系如图。
反应原理为:NO(g)+NO2(g)+2NH3(g)⇌2N2(g)+3H2O(g)。
下列说法正确的是_______(填序号)。
A.相同条件下,改变压强对脱氮率没有影响
B.在交叉点P处,不管使用哪种催化剂,上述反应都未达平衡
C.催化剂a、b分别适合于250℃和450℃左右脱氮
D.由曲线a温度升高到一定程度后脱氮率下降可推知该反应为放热反应
(3)温度为T时,在恒容的密闭容器中充入0.5molNH3(g)和1molNO(g),发生反应:4NH3(g)+6NO(g)⇌ 5N2(g)+6H2O(1)。起始压强为pkPa,10min时达到平衡,测得压强为pkPa。则10min内N2的反应速率v(N2)=_______kPa/min。T时,该反应的平衡常数Kp=_______(列出含p的计算式即可;分压=总压×物质的量分数)。
(4)我国科学家合成了一种新型的Fe-SnO2催化剂,用该催化剂修饰电极,可实现室温条件下电催化固氮生产氨和硝酸,原理如图所示:
①电解时双极膜中的H2O解离为H+和OH-,H+向_______室(填“a”或“b”)移动。
②写出阳极的电极反应式_______。
18.(2022·新疆昌吉·二模)含氮化合物在生活、生产、研究领域至关重要。回答下列问题。已知:
Ⅰ. 2H2(g)+O2(g) 2H2O(g) ΔH1= -483.6 kJ·mol-1
Ⅱ.N2(g)+O2(g) 2NO(g) ΔH2 = +180.5 kJ·mol-1
Ⅲ.2H2(g)+ 2NO(g) N2(g)+ 2H2O(g) ΔH3
(1)若已知反应III的正反应活化能为Ea kJ·mol-1, 则逆反应活化能为_______kJ·mol -1(用含Ea的式子表示)。
(2)在刚性容器中按投料比 =1发生反应Ⅲ,不同催化剂条件下,反应相同时间时,测得NO转化率与温度的关系如图1。
①下列能够说明该反应已达到化学平衡状态的是_______
A.2v逆 (NO)=v 正(N2)
B.混合气体的密度不再变化
C.容器内总压强不再变化
D.混合气体的平均相对分子质量不再变化
②使用催化剂乙、温度高于350℃时,NO 转化率降低的原因可能是_______。
③研究表明该反应v= kcm(H2)c2(NO),其中k为速率常数,与温度、活化能有关。T1℃的初始速率为v0,当H2转化率为50%时,反应速率为,由此可知m=_______。设此时反应的活化能为Ea',不同温度T1、T2条件下对应的速率常数分别为k1、k2,存在关系:(R为常数)。据此推测:活化能越大,升高温度,速率常数增大倍数_______。 (填“越大”“越小”或“不变”)
(3)工业上常利用反应N2(g)+ 3H2(g) 2NH3(g) ΔH<0合成氨气,在30 MPa、不同物质的量分数(75%的H2和25%的N2; 67.5%的 H2、22.5%的 N2和10%的惰性气体)条件下进行实验,测得平衡时,NH3体积分数与温度的关系如图2。
①物质的量分数为: 75%的H2和25%的N2所对应的曲线是_______。 (填“a”或“b”)
②M点时,N2的转化率为_______;该 反应的压强平衡常数Kp= _______(MPa)-2(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
19.(2022·山东日照·模拟预测)将转化为高附加值碳基燃料,可有效减少碳的排放。在催化剂作用下甲烷化分两步完成。
分步反应:
Ⅰ.
Ⅱ.
总反应(Ⅲ):
回答下列问题:
(1)在两种不同催化剂条件下反应相同时间,测得转化率和生成选择性随温度的变化如图所示。
对比上述两种催化剂的催化性能,工业上应选择的催化剂是_______,使用的合适温度为_______。
(2)一定温度范围内对上述反应的平衡常数进行计算,得的线性关系如图所示。
①时,_______。
②反应Ⅰ中,正反应的活化能_______(填“>”、“<”或“=”)逆反应的话化能。对于反应Ⅱ,图中_______(填“>”、“<”或“=”)。
③时,上述体系达到平衡后,若,将容器的体积若压缩为原来的一半,的物质的量_______(填“增加”、“减小”或“不变”),平衡Ⅰ将_______(“正向”、“逆向”或“不”)移动。
(3)条件下,向某真空容器中充入和的混合气体(体积之比为1∶4),容器中初始压强为,在催化剂作用下反应经达到平衡,测得容器中、,试计算_______,_______。
20.(2022·山西临汾·三模)研究NOx、SO2和CO等气体的相关反应对治理大气污染、建设生态文明具有重要意义。请回答下列问题:
(1)已知:①NO2(g)+CO(g)⇌CO2(g)+NO(g)△H1=-233kJ·mol-1
②N2(g)+O2(g)⇌NO(g)△H2=+179kJ·mol-1
③2NO(g)+O2(g)⇌2NO2(g)△H3=-111.9kJ·mol-1
则2NO2(g)+4CO(g)⇌4CO2(g)+N2(g)△H=_______。
(2)研究发现(1)中反应③分两步进行:
第一步:快反应2NO(g)⇌N2O2(g)△H<0
第二步:慢反应N2O2(g)+O2(g)⇌2NO2(g)△H<0
活化能大小比较:Ea(第一步)_______Ea(第二步)(填“大于”、“等于”或“小于”)。
(3)在混有NO2(g)和N2O4(g)的VL密闭容器中发生反应2NO2(g)⇌N2O4(g)△H<0,随着温度升高,体系中各物质平衡时的物质的量分数的变化关系如图1所示。曲线_____(填“a”或“b”)表示NO2的物质的量分数x%与温度的变化关系。若T1℃时,混合气体的物质的量为zmol,升温至T2℃,反应tmin达到平衡,该过程以N2O4表示的平均化学反应速率为v0mol·L-1·min-1,则T2℃时平衡体系中n(N2O4)=____mol(用含z、v0、t的式子表示),此时物质的量分数平衡常数Kx=____(用物质的量分数代替平衡浓度)。
(4)V2O5/炭基材料(活性炭、活性焦、活炭纤维)也可以脱硫脱硝。V2O5/炭基材料脱硫原理是:SO2在炭表面被吸附,吸附态SO2在炭表面被催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫时,通过红外光谱发现脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,该脱硫反应过程可表示为:SO2+V2O5+O2=VOSO4(配平方程式)_____、____(用化学方程式表示)。
②气体流速和温度一定时,烟气中O2浓度对V2O5/炭基材料催化剂脱硫脱硝活性的影响如图2所示。当O2浓度过高时,去除率下降的可能原因是_______。
21.(2022·黑龙江齐齐哈尔·二模)含氯化合物的反应在化学工业中具有重要的地位。回答下列问题:
(1)次氯酸钠氧化法可以制备Na2FeO4。
已知:2H2(g) +O2(g)=2H2O(l) ΔH=a kJ·mol-1
NaCl(aq)+H2O(l)=NaClO(aq)+ H2(g) ΔH =b kJ·mol-1
4Na2FeO4 (aq) + 10H2O(l)=4Fe(OH)3(s) +3O2 (g)十8NaOH(aq) ΔH=c kJ·mol-1
反应2Fe(OH)3(s)十3NaClO(aq) + 4NaOH(aq)=2Na2FeO4 (aq) + 3NaCl(aq) +5H2O(l)的 △H=_______kJ·mol-1。
(2)光气(COCl2)是重要的含氯化合物。常用于医药、农药制造,工业上利用一氧化碳和氯气反应制备,反应方程式为CO(g)+Cl2(g) COCl2(g)。在1 L恒温恒容密闭容器 中充入2.5molCO和1.5molCl2,在催化剂作用下发生反应,测得CO及COCl2的物质的量随时间变化如图1所示:
①0~15s内,Cl2的平均反应速率为_______mol· L-1·min-1
②第一次平衡时,CO的平衡转化率为_______;此温度下,该反应的平衡常数KC=_______(保留两位有效数字)。
③在第20 s时,改变的条件是_______。
(3)工业上常用氯苯(C6H5-Cl)和硫化氢(H2S)反应来制备一种用途广泛的有机合成中间体苯硫酚(C6H5-SH) ,但会有副产物苯(C6 H6)生成。
Ⅰ.C6H5-Cl(g)+H2S(gC6H5-SH(g)+HCl(g) ΔH1= -16.8 kJ·mol-1;
Ⅱ.C6H5- Cl(g)+ H2S(g)=C6H6(g)+HCl(g)+ S8(g) △H2= - 45.8 kJ·mol-1。
①将一定量的C6H5-Cl和H2S的混合气体充入恒容的密闭容器中,控制反应温度为T(假设只发生反应Ⅰ),下列可以作为反应Ⅰ达到平衡的判据是_______(填字母)。
A.气体的压强不变 B.平衡常数不变
C. v正(H2S)= v逆(HCl) D.容器内气体密度不变
②现将一定量的C6H5-Cl和H2S置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20 min测定生成物的浓度,得到图2和图3。
(R为H2S与C6H6-Cl的起始物质的量之比),图2显示温度较低时C6H5-SH浓度的增加程度大于C6H6,从活化能角度分析其主要原因是_______;结合图2和图3,该模拟工业生产制备C6H5 - SH的适宜条件为_______。
22.(2022·辽宁大连·一模)某化学实验小组发现镁和溶液可以反应生成气体,且比镁和水的反应速率快,通过实验探充速率加快取决于哪些粒子,同时分析气体的成分。
Ⅰ.探究加快速率的粒子
(1)甲同学推测加快速率的粒子有两种:
①能加快化学反应速率。
②能加快化学反应速率。
为验证猜想,进行了如下实验:
对照组
1mol/L溶液
持续产生大量气泡,溶液略显浑浊
实验组1
1mol/L溶液
持续产生大量气泡,溶液略显浑浊
实验组2
1mol/L溶液
镁表面有极微量气泡附着
已知:Mg和反应只能看到镁条表面有极微量气泡附着。用离子方程式解释对照组中溶液显碱性的原因_______;实验组1得到的结论是_______;为控制变量与对照组一致,实验组2应在1mo/L 溶液中_______。
Ⅱ.探究气体的成分。
(2)乙同学向反应容器中滴加几滴洗洁精,形成大量泡沫时点燃气泡,听到有爆鸣声;再将产生的气体通入澄清石灰水,溶液变浑浊。由此推测气体成分为_______。经查阅文献得知,溶液可以通过自耦电离产生,该反应的平衡常数为_______(保留3位有效数字)。(已知:电离常数,)
(3)丙同学认为乙同学的推测不够严谨,逸出的气体会带出少量溶液也能使澄清石灰水变浑浊,于是利用传感器检测放出的气体中是否含有。
实验组3
取6mL1mol/L 溶液加入250mL塑料瓶,塞紧传感器,采集数据15min,记录液面上方浓度的变化,重复实验2次。
实验组4
取6mLlmol/L溶液、0.1g打磨好的镁条加入250mL塑料瓶,实验操作同上。
实验组5
用上述同样方法采集15min空塑料瓶中浓度的数据。
由图像可知,加入Mg条后,释放受到抑制,原因是_______;实验时取少量溶液、少量镁条的原因是_______。
参考答案:
1.B
【解析】
A.由题干信息可知,k1>k2,说明相同条件下,基元反应Ⅰ比Ⅱ的反应速率更快,活化能越低反应速率越快,即基元反应Ⅰ比Ⅱ的活化能低,A正确;
B.由题干信息可知,基元反应Ⅰ为:H++H2O2+Fe2+=Fe3++·OH+H2O,故基元反应I中氧元素的化合价发生变化,B错误;
C.由题干信息可知,基元反应Ⅱ的化学方程式为,C正确;
D.由B、C分析可知,上述过程的总反应为:2H2O2HO+HO2·+H2O,H+参与反应,反应后又生成,反应前后不变,即芬顿反应进行的过程中,整个体系的几乎不变(忽略体积变化),D正确;
故答案为:B。
2.D
【解析】
A.由图可知温度较低的时候,氨气的氧化产物是氮气,因此应该选择较高温度,A错误;
B.根据反应I可知,反应I的平衡常数,B错误;
C.对于反应I温度升高,催化剂活性降低,反应II,温度升高,反应速率加快,故增大;另外反应II为放热反应,升高温度,平衡逆向移动,C错误;
D.反应I中,A点,一氧化氮为0.2mol,则H2O(g)=0.3mol,消耗了0.25molO2和0.2moINH3,反应II中, A点,氮气为0.2mol,则H2O(g)=0.6mol,消耗了0.3mol O2和0.4moINH3,由此可以计算出O2的物质的量分数,D正确;
故选D。
3.A
【解析】
A.由题干信息可知,150℃时,H2S的平衡转化率为40%,根据三段式分析可知:,若该反应的平衡常数,即=,解得,A正确;
B.由题干图示信息可知,随着温度的升高,H2S的平衡转化率减小,即升高温度平衡逆向移动,则该反应为放热反应,B错误;
C.反应从开始到达到平衡的过程中,始终不变为1,则若一段时间后,保持不变,不能说明该反应达到平衡状态,C错误;
D.平衡后,向容器中再通入a mol CO,反应物浓度突然增大,故突然增大,逐渐增大,D错误;
故答案为:A。
4.A
【解析】
A.当使用催化剂乙时,温度低于350℃时,催化剂的活性随温度升高逐渐增强,反应速率加快,NO转化率也增大,温度高于350℃时,导致催化剂活性降低甚至失去活性,反应速率下降,导致NO转换率下降,A错误;
B.单位时间内,使用催化剂甲比使用催化剂乙反应速率快,NO转化率高,则使用催化剂甲比使用催化剂乙正反应的活化能更低,B正确;
C.对于反应2H2(g)+2NO(g)⇌N2(g)+2H2O(g),是一个反应前后气体分子数减小的反应,其他条件不变,增大压强,平衡正向移动,C正确;
D.设初始一氧化氮和氢气的物质的量均为1mol,容器体积为1L,则初始一氧化氮和氢气的浓度均为1mol/L,V0=k1m12=k,当H2转化率为60%时,c(H2)=0.4mol/L,c(NO)=0.4mol/L,此时的反应速率为0.064V0,则有0.064V0=k (0.4)m (0.4)2=V0 (0.4)m (0.4)2,解得m=1,D正确;
答案选A。
5.C
【解析】
发生的反应为: ,15min时,n(B)=1.6mol,与10min时数据一致,说明反应已经达到平衡,据此分析作答。
A.物质B的转化率为= ×100%=33.3%,A项错误;
B.反应在10min时,B变化了0.8mol,则此时B余下1.6mol,到15min时,B仍然是1.6mol,说明反应在10min已经达到平衡,B项错误;
C.15min时,n(B)=1.6mol,与10min时数据一致,说明反应在10min已经达到平衡,则平衡时,c(C)= =0.6mol/L,C项正确;
D.0~5 min内,△n(C)=0.9mol,根据方程式,则△n(A)=△n(C)=0.3mol,所以用A表示的平均反应速率为v(A)==== ,D项错误;
答案选C。
6.C
【解析】
根据图中G点的数据可以计算出该温度下的水的离子积 ,在pH逐渐增大的过程中存在着平衡移动的过程,其中铬酸根离子为黄色的,重铬酸根离子为橙色的,以此解题。
A.G点时,,此时,则Kw=,A项错误;
B.由图可知溶液中存在平衡,F点时,,则K=,B项错误;
C.E点时,,根据电荷守恒有:,即,此时溶液显酸性,即,则c(K+)<2c()+3c(),C项正确;
D.根据平衡+H2O⇌2+2H+,加入NaOH固体,平衡正向移动,溶液橙色变浅,D项错误;
故选C。
7.B
【解析】
A.为气体体积增大的放热反应,其ΔH<0、△S>0,始终满足△H-T△S<0,则任何条件下该反应均能自发进行,故A错误;
B.该反应为放热反应,升高温度平衡逆向移动,该反应的平衡常数减小,故B正确;
C.该反应为可逆反应,4molNH3和5molO2充分反应生成NO的物质的量一定小于4mol,则放出的热量小于904kJ,故C错误;
D.断裂1molN-H键的同时生成1molH-O键,表示的都是正反应速率,无法判断平衡状态,故D错误;
答案选B。
8.D
【解析】
A.G点时,,此时,则Kw=,A项错误;
B.F点时,,则K=,B项错误;
C.根据平衡+H2O⇌2+2H+,加入NaOH固体,平衡正向移动,溶液橙色变浅,C项错误;
D.E点时,,根据电荷守恒有:,即,此时溶液显酸性,即,则c(K+)<2c()+3c(),D项正确;
答案选D。
9.A
【解析】
A.从能量变化图可看出反应I是吸热反应,高温有利于提高反应速率和转化率,故A正确;
B.决速步骤应是活化能最大的步骤,从能量变化图可看出反应I活化能最大,故B错误;
C.从能量变化图可看出反应III的中间体比反应IV的能量高,能量越高越不稳定,故C错误;
D.从能量变化图可看出反应I只有共价键的断裂,故D错误;
故答案为:A
10.B
【解析】
A.根据图中曲线pH约为9时,废水中铜元素含量最低,因此废水中Cu2+处理的最佳pH约为9,故A正确;
B.b~c段:随pH升高,氢氧根浓度增大,平衡I逆向移动,Cu(OH)2的量增加,故B错误;
C.c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,因此上层清液中铜元素含量下降,故C正确;
D.d点以后,随c(OH-)增加,平衡II正向移动,因此上层清液中铜元素含量可能上升,故D正确。
综上所述,答案为B。
11.C
【解析】
A.由图像可知,在t1时刻,正逆反应都发生,A项错误;
B.时刻反应达到平衡,但起始浓度未知,故无法计算A、B、C三者浓度大小关系,B项错误;
C.时刻反应达到平衡,正逆反应速率相等,反应达到限度,反应物的转化率最大,反应体系中NH3的浓度达到最大值,C项正确;
D.~,反应达到平衡状态,=≠0,反应没有停止,D项错误;
答案选C。
12.A
【解析】
A.150℃时,由图中可知硫化氢的转化率为40%,恒容密闭容器中充入amolCO和bmolH2S可列出三段式:,
若该反应的平衡常数K=1/3,K=c(COS)c(H2)/c(CO)c(H2S)=(0.4b)2/[0.6b·(a-0.4b)]=1/3,a:b=6:5,A正确;
B.升高温度,硫化氢的转化率下降,为放热反应,B错误
(4)
A.该反应是只有气体参加等体积反应,反应物投入相等,容器体积不同,则甲乙密度不相同,压强改变平衡不移动,CH3Cl的体积分数不变,即两容器相同,故A错误;
B.由于两种情况反应物浓度不同,但是达到平衡状态相同,所以甲乙正反应速率不同,放出的热量相同,故B正确;
C.甲乙两种气体物质的量相同,但体积不同,故压强不同,该反应是只有气体参加等体积反应,混合气体的平均相对分子质量相同,故C正确;
D.甲乙两种情况平衡状态相同,故CH3OH的转化率相同,由于物质浓度不同混合气体的颜色相同,故D错误;
故答案为BC。
17.(1) -92kJ/mol 增大压强(或增大c(H2)
(2)BC
(3) 0.033p
(4) a N2-10e-+6H2O=2+12H+
【解析】
(1)
①根据图示,0.5molN2、1.5molH2的总能量比1molNH3的能量大46KJ,该条件下,N2(g)+3H2(g)⇌2NH3(g) △H=--92kJ/mol。
②增大压强,反应速率加快,平衡正向移动,既能加快反应速率又能提高N2平衡转化率;
(2)
A.反应前后气体系数和不同,相同条件下,改变压强,平衡移动,对脱氮率有影响,故A错误;
B.催化剂不能使平衡移动,在交叉点P处脱氮率低于最大值,所以反应没有达到平衡,故B正确;
C.催化剂a,250℃脱氮率最高;催化剂b,450℃脱氮率最高,所以a、b分别适合于250℃和450℃左右脱氮,故C正确;
D.由曲线a温度升高到一定程度后脱氮率下降,可能由于催化剂活性降低,故D错误;
选BC。
选BC。
(3)
起始压强为pkPa,10min时达到平衡,测得压强为pkPa。则 ,
x=0.1,平衡时N2的压强为kPa,则10min内N2的反应速率v(N2)=0.033pkPa/min。T时,该反应的平衡常数Kp= = 。
(4)
①a电极氮气得电子生成氨气,a是阴极,b电极氮气失电子发生氧化反应生成硝酸,b是阳极,电解时双极膜中的H2O解离为H+和OH-,H+向a室移动。
②阳极氮气失电子发生氧化反应生成硝酸,电极反应式为N2-10e-+6H2O=2+12H+。
18.(1)Ea+ 664.1
(2) CD 催化剂失去活性、发生其它副反应等合理即可 1 越大
(3) a 50% Kp==5.9 ×10-3=
【解析】
(1)
Ⅰ. 2H2(g)+O2(g) 2H2O(g) ΔH1= -483.6 kJ·mol-1
Ⅱ.N2(g)+O2(g) 2NO(g) ΔH2 = +180.5 kJ·mol-1
根据盖斯定律Ⅰ-Ⅱ得2H2(g)+ 2NO(g) N2(g)+ 2H2O(g) ΔH3=-483.6 kJ·mol-1-180.5 kJ·mol-1=-664.1 kJ·mol-1,焓变=正反应活化能-逆反应活化能,若反应III的正反应活化能为Ea kJ·mol-1, 则逆反应活化能为(Ea+ 664.1)kJ·mol -1。
(2)
①A.反应达到平衡状态,正逆反应速率比等于系数比,2v逆 (NO)=v 正(N2)反应不平衡,故不选A;
B.反应前后气体总质量不变、容器体积不变,密度是恒量,混合气体的密度不再变化,反应不一定达到平衡状态,故不选B;
C.反应前后气体系数和不同,压强是变量,容器内总压强不再变化,反应一定达到平衡状态,故选C;
D.反应前后气体总质量不变,气体物质的量改变,混合气体的平均相对分子质量是变量,混合气体的平均相对分子质量不再变化,反应一定达到平衡状态,故选D;
选CD。
②使用催化剂乙、温度高于350℃时,NO 转化率降低的原因可能是催化剂失去活性或发生其它副反应。
③研究表明该反应v= kcm(H2)c2(NO),其中k为速率常数,与温度、活化能有关。T1℃的初始速率为v0,当H2转化率为50%时,NO的转化率也是50%,反应速率为, ,所以m=1。设此时反应的活化能为Ea',不同温度T1、T2条件下对应的速率常数分别为k1、k2,存在关系:(R为常数)。据此推测:活化能越大,升高温度,变大,速率常数增大倍数越大。
(3)
①恒压条件下,通入惰性气体,相当于减压,平衡逆向移动,氨气的体积分数减小,所以75%的H2和25%的N2所对应的曲线是a;
②M点时,
, ,N2的转化率为;该反应的压强平衡常数Kp==5.9 ×10-3 (MPa)-2。
19.(1)
(2) 1 > > 增加 正向
(3) 9 3.4
【解析】
(1)
由图可知,作催化剂时,CO2的转化率大、CH4的选择性高,所以工业上应选择的催化剂是,320℃时CO2的转化率最大,CH4的选择性高,即的催化效率最高,所以合适温度是320℃;
(2)
①根据盖斯定律,由Ⅰ+Ⅱ=Ⅲ,则,,由图可知,当温度为时,,则。
②由图可知,横坐标为,则横坐标越大,温度越低,反应Ⅱ和Ⅲ的随着温度的降低而增大,反应Ⅲ的增大的幅度小于反应Ⅱ,降低温度,减小,则反应Ⅰ为吸热反应,因此正反应的活化能>逆反应的话化能;AB两点都是平衡点,温度越高反应速率越大,A点温度高于B点,因此对于反应Ⅱ>;
③将容器的体积压缩为原来的一半,压强增大,反应Ⅱ平衡均正向移动,则的物质的量增加;CO2浓度增大、CO浓度减小,所以平衡Ⅰ将正向移动;
(3)
条件下,向某真空容器中充入和的混合气体(体积之比为1∶4),容器中初始压强为,反应初始、,在催化剂作用下反应经达到平衡,测得容器中、,反应Ⅱ生成的,反应Ⅰ消耗的,所以反应Ⅰ生成的9;反应Ⅰ消耗的、反应Ⅱ消耗的 , 3.4。
20.(1)-1222.9kJ/mol
(2)小于
(3) a 2
(4) 4SO2+2V2O5+O2=4VOSO4 4VOSO4+O2=2V2O5+4SO3 氧气浓度过高,SO2、NO分子不能很好地被吸附
【解析】
(1)
由①NO2(g)+CO(g)⇌CO2(g)+NO(g)△H1=-233kJ·mol-1,②N2(g)+O2(g)⇌2NO(g)△H2=+179kJ·mol-1,
③2NO(g)+O2(g)⇌2NO2(g)△H3=-111.9kJ·mol-1
根据盖斯定律,反应2NO2(g)+4CO(g)⇌4CO2(g)+N2(g)可由①×4-②+③得到,因此△H=△H1×4-△H2+△H3=-233kJ·mol-1×4-179kJ·mol-1+(-111.9kJ·mol-1)=-1222.9kJ/mol。
(2)
活化能越大反应速率越慢,第一步反应为快反应,反应的活化能小,则Ea(第一步)小于Ea(第二步)。
(3)
由反应iii.可知,升高温度,反应iii的化学平衡逆向移动,平衡时NO2的物质的量分数随温度升高而增大,N2O4的物质的量分数随温度升高而减小,则曲线表示NO2的物质的量分数与温度的变化关系,若时,混合气体的物质的量为,温度升高至,反应进行至时,恰好达到平衡,该过程以表示的平均化学反应速率为,根据三段式分析可得:,则条件下,由图可知,(a+2V0Vt)=Z-a-V0Vt,解得:a=,平衡时的的物质的量Z-a-V0Vt=mol,此时摩尔分数平衡常数==2,故答案为:NO2;mol;2;
(4)
①V2O5/炭基材料脱硫时,通过红外光谱发现,脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,说明VOSO4是中间体,反应过程中生成了VOSO4、又消耗了VOSO4,因此该脱硫反应过程可描述为:SO2与V2O5作用形成具有VOSO4结构的中间体;VOSO4中间体与气相的O2反应生成SO3和,或者用化学方程式表示为:4SO2+2V2O5+O2=4VOSO4,4VOSO4+O2=2V2O5+4SO3。
②若氧气浓度过高,O2、SO2和NO分子会产生竞争吸附的局势,当O2分子占据催化剂过多的活性位时,剩余的SO2、NO分子就不能很好地被吸附,从而导致脱硫脱硝率下降。
21.(1)-a-3b-
(2) 3 30% 0.57 增大CO的物质的量
(3) C 反应Ⅰ的活化能小于反应Ⅱ的活化能,反应Ⅰ的反应速率快于反应Ⅱ,相同时间内获得的产物的浓度自然反应Ⅰ比反应Ⅱ多 温度590K,R=2.5
【解析】
(1)
①2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1
②NaCl(aq)+H2O(l)=NaClO(aq)+H2(g) ΔH=b kJ·mol-1
③4Na2FeO4(aq)+10H2O(l)=4Fe(OH)3(s)+3O2(g)+8NaOH(aq) ΔH=c kJ·mol-1
根据盖斯定律,-③-②×3-①×得2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(l)的ΔH=-a-3b-c kJ·mol-1。
(2)
①0~15 s时CO的变化物质的量为2.5mol-1.75mol=0.75mol,则Cl2的变化物质的量也为0.75mol,Cl2的平均反应速率为=0.05mol/(L·s)=3mol·L-1·min-1;
②反应进行到15s时达到第一次平衡,CO的平街转化率为=30%;此时平衡体系内CO为1.75mol/L、Cl2为0.75mol/L、COCl2为0.75mol/L,该反应的平衡常数K==0.57;
③在第20 s时,CO的物质的量瞬间迅速增大,然后平衡正向进行,说明此时改变的条件是增大CO的物质的量;
(3)
①A.反应前后气体分子总数不变,总物质的量不变,利用相同条件下,压强之比等于气体物质的量之比,即气体压强始终保持不变,压强不变不能说明该反应达到平衡,故A不符合题意;
B.平衡常数只与温度有关,温度不变平衡常数始终不变,因此平衡常数不变不能说明反应达到平衡,故B不符合题意;
C.正(H2S)表示正反应速率,逆(HCl)表示逆反应速率,化学反应速率之比等于化学计量数之比,因此正(H2S)=逆(HCl)说明反应达到平衡,故C符合题意;
D.组分都是气体,则气体总质量始终不变,容器为恒容状态,气体总体积保持不变,根据密度的定义,气体密度始终不变,气体密度不变,不能说明反应达到平衡,故D不符合题意;
故答案为C;
②C6H5-Cl由反应Ⅰ生成,C6H6由反应Ⅱ生成,图2显示温度较低时C6H5-Cl浓度的增加程度大于C6H6,说明反应Ⅰ的活化能小于反应Ⅱ的活化能,反应Ⅰ的反应速率快于反应Ⅱ,相同时间内获得的产物的浓度自然反应Ⅰ比反应Ⅱ多;根据图2和图3的数据信息,该模拟工业生产制备C6H5-Cl的适宜条件为温度590K,R=2.5。
22.(1) 对实验无影响 滴加NaOH溶液至
(2) 和
(3) Mg和溶液反应使溶液中的被消耗,反应体系的碱性增强,不利于释放 当容器中反应物量大时,产生的热量会加速溶液分解
【解析】
(1)
碳酸氢钠溶液呈碱性,原因是碳酸氢根水解,离子方程式为:;实验组1中用的是溶液,实验现象与对照组一样,则说明对实验无影响;为了控制变量与对照组一致,实验组2应在1mo/L 溶液中滴加NaOH溶液至;故答案为:;对实验无影响;滴加NaOH溶液至;
(2)
同学向反应容器中滴加几滴洗洁精,形成大量泡沫时点燃气泡,听到有爆鸣声,说明该气体可燃,应该含有氢气,再将产生的气体通入澄清石灰水,溶液变浑浊,应该含有二氧化碳,由此推测气体成分为和;
溶液可以通过自耦电离产生,该反应的平衡常数为:,故答案为:和;;
(3)
由图像可知,加入Mg条后,释放受到抑制,原因是Mg和溶液反应使溶液中的被消耗,反应体系的碱性增强,不利于释放;实验时取少量溶液、少量镁条的原因是当容器中反应物量大时,产生的热量会加速溶液分解;故答案为:Mg和溶液反应使溶液中的被消耗,反应体系的碱性增强,不利于释放;当容器中反应物量大时,产生的热量会加速溶液分解。
新高考化学二轮复习精选练习专题09 化学反应速率与化学平衡 (含解析): 这是一份新高考化学二轮复习精选练习专题09 化学反应速率与化学平衡 (含解析),共15页。
新高考化学二轮复习检测卷专题09 化学反应速率与化学平衡(含解析): 这是一份新高考化学二轮复习检测卷专题09 化学反应速率与化学平衡(含解析),共15页。试卷主要包含了25倍,5和pH = 8等内容,欢迎下载使用。
新高考化学二轮复习精品讲义专题09 化学反应速率与化学平衡(含解析): 这是一份新高考化学二轮复习精品讲义专题09 化学反应速率与化学平衡(含解析),共14页。












