

五年2018-2022高考化学真题按知识点分类汇编76-分子结构与性质-配合物(含解析)
展开五年2018-2022高考化学真题按知识点分类汇编76-分子结构与性质-配合物(含解析)
一、单选题
1.(2022·北京·高考真题)利用下图装置进行铁上电镀铜的实验探究。
装置示意图
序号
电解质溶液
实验现象
①
阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有
②
阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无元素
下列说法不正确的是A.①中气体减少,推测是由于溶液中减少,且覆盖铁电极,阻碍与铁接触
B.①中检测到,推测可能发生反应:
C.随阴极析出,推测②中溶液减少,平衡逆移
D.②中生成,使得比①中溶液的小,缓慢析出,镀层更致密
2.(2022·湖北·统考高考真题)和的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是
A.与都能在水中与氨形成配合物
B.和的熔点都比的低
C.和均可表现出弱酸性
D.和的氢化物都不能在酸中稳定存在
3.(2021·辽宁·统考高考真题)某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是
A.氢化物沸点: B.原子半径:
C.第一电离能: D.阴、阳离子中均有配位键
4.(2021·海南·统考高考真题)关于性质的解释合理的是
选项
性质
解释
A
比容易液化
分子间的范德华力更大
B
熔点高于
键的键能比大
C
能与以配位键结合
中氮原子有孤电子对
D
氨水中存在
是离子化合物
A.A B.B C.C D.D
5.(2021·江苏·高考真题)N2是合成氨工业的重要原料,NH3不仅可制造化肥,还能通过催化氧化生产HNO3;HNO3能溶解Cu、Ag等金属,也能与许多有机化合物发生反应;在高温或放电条件下,N2与O2反应生成NO,NO进一步氧化生成NO2。2NO(g)+O2(g)=2NO2(g) ΔH=-116.4kJ·mol-1。大气中过量的NOx和水体中过量的NH、NO均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2,也可将水体中的NO3-转化为N2。下列有关NH3、NH、NO的说法正确的是
A.NH3能形成分子间氢键
B.NO的空间构型为三角锥形
C.NH3与NH中的键角相等
D.NH3与Ag+形成的[Ag(NH3)2]+中有6个配位键
6.(2020·海南·高考真题)向CuSO4溶液中滴加氨水至过量,下列叙述正确的是
A.先出现沉淀,后沉淀溶解变为无色溶液
B.离子方程式为Cu2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 4H2O
C.Cu2+与 NH3中的氮原子以π键结合
D.NH3分子中∠HNH为109º28ˊ
二、结构与性质
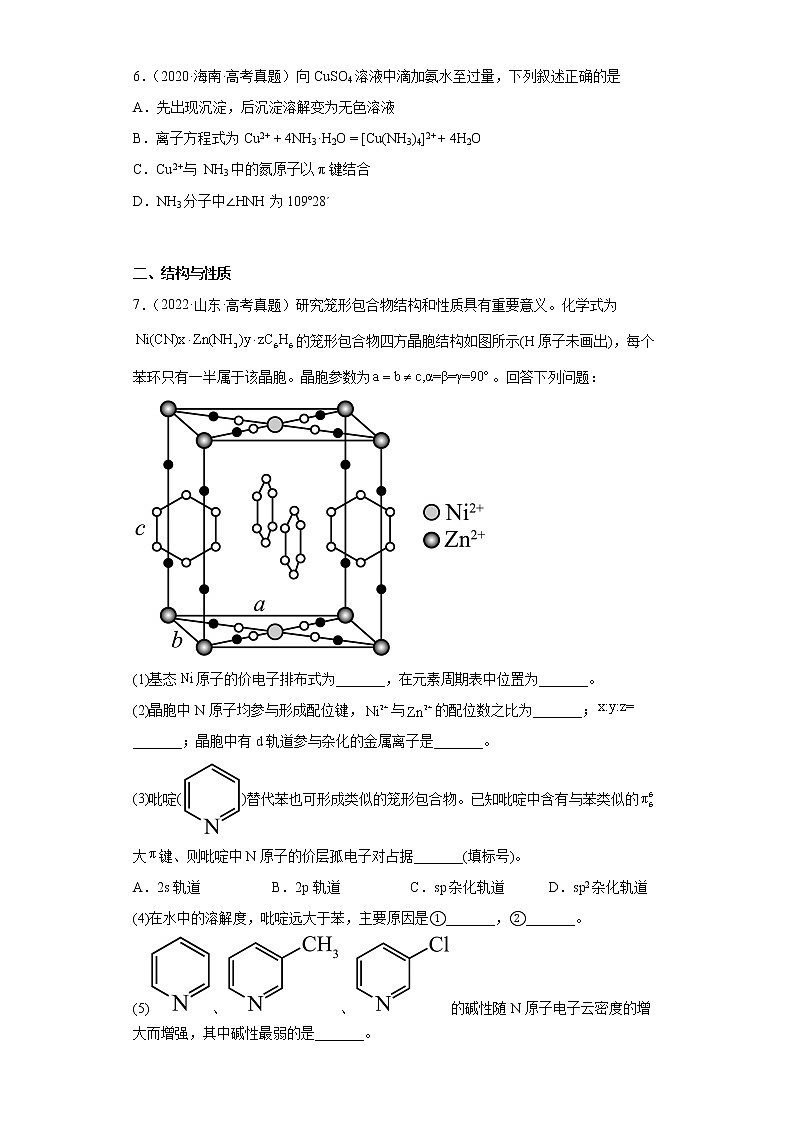
7.(2022·山东·高考真题)研究笼形包合物结构和性质具有重要意义。化学式为的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为。回答下列问题:
(1)基态原子的价电子排布式为_______,在元素周期表中位置为_______。
(2)晶胞中N原子均参与形成配位键,与的配位数之比为_______;_______;晶胞中有d轨道参与杂化的金属离子是_______。
(3)吡啶()替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大键、则吡啶中N原子的价层孤电子对占据_______(填标号)。
A.2s轨道 B.2p轨道 C.sp杂化轨道 D.sp2杂化轨道
(4)在水中的溶解度,吡啶远大于苯,主要原因是①_______,②_______。
(5)、、的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是_______。
8.(2022·湖南·高考真题)铁和硒()都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
①基态原子的核外电子排布式为_______;
②该新药分子中有_______种不同化学环境的C原子;
③比较键角大小:气态分子_______离子(填“>”“<”或“=”),原因是_______。
(2)富马酸亚铁是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中键与键的数目比为_______;
②富马酸亚铁中各元素的电负性由大到小的顺序为_______。
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化,将转化为,反应过程如图所示:
①产物中N原子的杂化轨道类型为_______;
②与互为等电子体的一种分子为_______(填化学式)。
(4)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
①该超导材料的最简化学式为_______;
②Fe原子的配位数为_______;
③该晶胞参数、。阿伏加德罗常数的值为,则该晶体的密度为_______(列出计算式)。
9.(2022·北京·高考真题)失水后可转为,与可联合制备铁粉精和。
I.结构如图所示。
(1)价层电子排布式为___________。
(2)比较和分子中的键角大小并给出相应解释:___________。
(3)与和的作用分别为___________。
II.晶胞为立方体,边长为,如图所示。
(4)①与紧邻的阴离子个数为___________。
②晶胞的密度为___________ 。
(5)以为燃料,配合可以制备铁粉精和。结合图示解释可充分实现能源和资源有效利用的原因为___________。
10.(2020·山东·高考真题)CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为_____________,其固体的晶体类型为_____________。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为_____________(填化学式,下同),还原性由强到弱的顺序为____________,键角由大到小的顺序为_____________。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有_________mol,该螯合物中N的杂化方式有__________种。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标
原子
x
y
z
Cd
0
0
0
Sn
0
0
0.5
As
0.25
0.25
0.125
一个晶胞中有_________个Sn,找出距离Cd(0,0,0)最近的Sn_________(用分数坐标表示)。CdSnAs2
晶体中与单个Sn键合的As有___________个。
11.(2020·江苏·高考真题)以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵【(NH4)3Fe(C6H5O7)2】。
(1)Fe基态核外电子排布式为___________;中与Fe2+配位的原子是________(填元素符号)。
(2)NH3分子中氮原子的轨道杂化类型是____________;C、N、O元素的第一电离能由大到小的顺序为_______________。
(3)与NH互为等电子体的一种分子为_______________(填化学式)。
(4)柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为_________mol。
12.(2019·全国·高考真题)在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是____________(填标号)。
A. B. C. D.
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物
Li2O
MgO
P4O6
SO2
熔点/°C
1570
2800
23.8
−75.5
解释表中氧化物之间熔点差异的原因__________。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=__________pm,Mg原子之间最短距离y=__________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是__________g·cm−3(列出计算表达式)。
13.(2019·江苏·高考真题)A.[物质结构与性质]
Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu₂O。
(1)Cu2+基态核外电子排布式为____。
(2)的空间构型为____(用文字描述);Cu2+与OH−反应能生成[Cu(OH)4]2−,[Cu(OH)4]2−中的配位原子为____(填元素符号)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为____;推测抗坏血酸在水中的溶解性:____(填“难溶于水”或“易溶于水”)。
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为____。
参考答案:
1.C
【分析】由实验现象可知,实验①时,铁做电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,一段时间后,铜离子在阴极得到电子发生还原反应生成铜;实验②中铜离子与过量氨水反应生成四氨合铜离子,使得溶液中铜离子浓度比①中要小,电解速率减慢,铜离子在阴极得到电子缓慢发生还原反应生成铜,在铁表面得到比实验①更致密的镀层。
【详解】A.由分析可知,实验①时,铁会先与溶液中的氢离子、铜离子反应,当溶液中氢离子浓度减小,反应和放电生成的铜覆盖铁电极,阻碍氢离子与铁接触,导致产生的气体减少,故A正确;
B.由分析可知,实验①时,铁做电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,可能发生的反应为,故B正确;
C.由分析可知,铜离子在阴极得到电子发生还原反应,在阴极析出铜,但阳极发生Cu-2e-=Cu2+的反应,铜离子浓度不变,平衡不移动,故C错误;
D.由分析可知,实验②中铜离子与过量氨水反应生成四氨合铜离子,使得溶液中铜离子浓度比①中要小,电解速率减慢,铜离子在阴极得到电子缓慢发生还原反应生成铜,在铁表面得到比实验①更致密的镀层,故D正确;
故选C。
2.A
【详解】A.半径小,不能容纳6个氮原子和它配位,则不能在水中与氨形成配合物,A项错误;
B.和属于分子晶体,而属于离子晶体,则和的熔点都比的低,B项正确;
C.和均为两性氢氧化物,则均可表现出弱酸性,C项正确;
D.和的氢化物与酸反应,生成对应的盐和氢气,则都不能在酸中稳定存在,D项正确;
答案选A。
3.D
【分析】由题干信息可知,基态Z原子的电子填充了3个能级,其中有2个未成对电子,故Z为C或者O,根据多孔储氢材料前驱体结构图可知Y周围形成了4个单键,再结合信息M、W、X、Y、Z五种元素原子序数依次增大,故Y为N,故Z为O,M只形成一个单键,M为H,X为C,则W为B,据此分析解题。
【详解】A.由分析可知,X、Y的氢化物分别为:CH4和NH3,由于NH3存在分子间氢键,故氢化物沸点:,A错误;
B.根据同一周期从左往右主族元素的原子半径依次减小,同一主族从上往下依次增大,故原子半径:,B错误;
C.根据同一周期从左往右元素的第一电离能呈增大趋势,IIA与IIIA,VA与VIA反常,故第一电离能:,C错误;
D.由于阳离子中的Y原子是N原子,形成了类似于铵根离子的阳离子,故存在配位键,阴离子中的W为B,最外层上只有3个电子,能形成3个共价键,现在形成了4个共价键,故还有一个配位键,D正确;
故答案为:D。
4.C
【详解】A.和都属于同一主族是氢化物,分子晶体的沸点与其相对分子质量成正比,但氨气中含有氢键, PH3不含氢键,氢键的存在导致氨气的沸点升高,故A错误;
B.熔点高于,是因为氨气中含有氢键,氢键的存在导致氨气的熔点升高,不是键的键能比大,故B错误;
C.中氮原子有孤电子对,使和以配位键结合形成[Ag(NH3)2]+,故C正确;
D.是共价化合物,是弱碱,在水溶液中部分电离出和OH-,故D错误;
答案选C。
5.A
【详解】A.NH3能形成分子间氢键,氨分子是一个极性分子,氮原子带有部分负电荷,氢原子带有部分正电荷,当氨分子互相靠近时,由于取向力的作用,带有部分正电荷的氢原子与另外一个氨分子中的带有部分负电荷的氮原子发生异性电荷的吸引进一步靠拢,A正确;
B.硝酸根离子的空间构型是个标准的正三角形,N在中间,O位于三角形顶点,N和O都是sp2杂化,B错误;
C.NH3和NH都是sp3杂化,但NH3中存在一个孤电子对,是三角锥结构,而NH为标准的正四面体,所以键角是不一样的,NH3中每两个N—H键之间夹角为107°18',正四面体为109°28',C错误;
D.N-H为σ键,配位键也为σ键,则[Ag(NH3)2]+中含有8个σ键,2个配位键,D错误;
答案选A。
6.B
【详解】A. 向CuSO4溶液中滴加氨水至过量,先生成氢氧化铜蓝色沉淀,后溶解形成铜氨溶液,为深蓝色溶液,故A错误;
B. 离子方程式为Cu2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 4H2O,故B正确;
C. Cu2+提供空轨道, NH3中的氮原子提供孤电子对,形成配位键,故C错误;
D. NH3分子为三角锥形,键角∠HNH为107º18ˊ,故D错误。
故答案选:B。
7.(1) 3d84s2 第4周期第VIII族
(2) 2:3 2:1:1 Zn2+、Ni2+
(3)D
(4) 吡啶能与H2O分子形成分子间氢键 吡啶和H2O均为极性分子相似相溶,而苯为非极性分子
(5)
【详解】(1)已知Ni是28号元素,故基态Ni原子的价电子排布式为:3d84s2,在周期表中第四横行第10纵列即位于第4周期第VIII族,故答案为:3d84s2;第4周期第VIII族;
(2)由题干晶胞示意图可知,,Ni2+周围连接四个原子团,形成的配位键数目为:4,空间结构为正方形,VESPR模型为平面四边形,采用dsp2杂化; Zn2+周围形成的配位键数目为:6,VESPR模型为正八面体,采用sp3d2杂化,所以与的配位数之比为4:6=2:3;
含有CN-(小黑球N+小白球C)为:=4,含有NH3(棱上小黑球)个数为:=2,晶胞中苯环在四个侧面且每个苯环只有一半属于该晶胞,所以苯环个数为:=2,则该晶胞的化学式为:,即4:2:2=2:1:1;故答案为:2:3;2:1:1;Zn2+、Ni2+;
(3)吡啶()替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大π键,则说明吡啶中N原子也是采用sp2杂化,杂化轨道只用于形成σ键和存在孤电子对,则吡啶中N原子的价层孤电子对占据sp2杂化轨道,故答案为:D;
(4)已知苯分子为非极性分子,H2O分子为极性分子,且吡啶中N原子上含有孤电子对能与H2O分子形成分子间氢键,从而导致在水中的溶解度,吡啶远大于苯,故答案为:吡啶能与H2O分子形成分子间氢键;吡啶和H2O均为极性分子相似相溶,而苯为非极性分子;
(5)已知-CH3为推电子基团,-Cl是吸电子基团,则导致N原子电子云密度大小顺序为:>>,结合题干信息可知,其中碱性最弱的为:,故答案为:。
8.(1) [Ar] 3d104s24p4 8
> SeO3的空间构型为平面三角形,SeO的空间构型为三角锥形
(2) 11:3 O>C>H>Fe
(3) sp3杂化 H2O
(4) KFe2Se2 4
【详解】(1)①硒元素的原子序数为34,基态原子的电子排布式为[Ar] 3d104s24p4,故答案为:[Ar] 3d104s24p4;
②由结构简式可知,乙烷硒啉的分子结构对称,分子中含有8种化学环境不同的碳原子,故答案为:8;
③三氧化硒分子中硒原子的价层电子对数为3,孤对电子对数为0,分子的空间构型为平面三角形,键角为120°,亚硒酸根离子中硒原子的价层电子对数为4,孤对电子对数为1,离子的空间构型为三角锥形,键角小于120°,故答案为:>;SeO3的空间构型为平面三角形,SeO的空间构型为三角锥形;
(2)①由球棍模型可知,富马酸的结构式为HOOCCH=CHCOOH,分子中的单键为σ键,双键中含有1个σ键和1个π键,则分子中σ键和π键的数目比为11:3,故答案为:11:3;
②金属元素的电负性小于非金属元素,则铁元素的电负性最小,非金属元素的非金属性越强,电负性越大,氢碳氧的非金属性依次增强,则电负性依次增大,所以富马酸亚铁中四种元素的电负性由大到小的顺序为O>C>H>Fe,故答案为:O>C>H>Fe;
(3)①由结构简式可知,产物中氮原子的价层电子对数为4,原子的杂化方式为sp3杂化,故答案为:sp3杂化;
②水分子和氨基阴离子的原子个数都为3、价电子数都为8,互为等电子体,故答案为:H2O;
(4)①由平面投影图可知,晶胞中位于顶点和体心的钾原子个数为8×+1=2,铁原子位于面心,原子个数为8×=4,位于棱上和体心的硒原子的个数为8×+2=4,则超导材料最简化学式为KFe2Se2,故答案为:KFe2Se2;
②由平面投影图可知,位于棱上的铁原子与位于面上的硒原子的距离最近,所以铁原子的配位数为4,故答案为:4;
③设晶体的密度为dg/cm3,由晶胞的质量公式可得:=abc×10—21×d,解得d=,故答案为:。
9.(1)3d6
(2)SO的键角大于H2O,SO中S原子的价层电子对数为4、孤对电子对数为0,离子的空间构型为正四面体形,H2O分子中O原子的价层电子对数为4、孤对电子对数为2,分子的空间构型为V形
(3)配位键、氢键
(4) 6 ×1021
(5)由图可知,FeS2与O2生成FexOy的反应为放热反应,FeSO4·H2O分解生成FexOy的反应为吸热反应,放热反应放出的热量有利于吸热反应的进行,有利于反应生成的SO3与H2O反应生成H2SO4
【解析】(1)
铁元素的原子序数为26,基态亚铁离子的价电子排布式为3d6,故答案为:3d6;
(2)
硫酸根离子中硫原子的价层电子对数为4、孤对电子对数为0,离子的空间构型为正四面体形,水分子中氧原子的价层电子对数为4、孤对电子对数为2,分子的空间构型为V形,所以硫酸根离子的键角大于水分子,故答案为:SO的键角大于H2O,SO中S原子的价层电子对数为4、孤对电子对数为0,离子的空间构型为正四面体形,H2O分子中O原子的价层电子对数为4、孤对电子对数为2,分子的空间构型为V形;
(3)
由图可知,具有空轨道的亚铁离子与水分子中具有孤对电子的氧原子形成配位键,硫酸根离子与水分子间形成氢键,故答案为:配位键;氢键;
(4)
①由晶胞结构可知,晶胞中位于顶点的亚铁离子与位于棱上的阴离子S离子间的距离最近,则亚铁离子紧邻的阴离子个数为6,故答案为:6;
②由晶胞结构可知,晶胞中位于顶点和面心的亚铁离子个数为8×+6×=4,位于棱上和体心的S离子个数为12×+1=4,设晶体的密度为dg/cm3,由晶胞的质量公式可得:==10—21a3d,解得d=×1021,故答案为:×1021;
(5)
由图可知,FeS2与O2生成FexOy的反应为放热反应,FeSO4·H2O分解生成FexOy的反应为吸热反应,放热反应放出的热量有利于吸热反应的进行,有利于反应生成的SO3与H2O反应生成H2SO4,所以以FeS2为燃料,配合FeSO4·H2O可以制备铁粉精和H2SO4可充分实现能源和资源有效利用,故答案为:由图可知,FeS2与O2生成FexOy的反应为放热反应,FeSO4·H2O分解生成FexOy的反应为吸热反应,放热反应放出的热量有利于吸热反应的进行,有利于反应生成的SO3与H2O反应生成H2SO4。
10. 正四面体形; 分子晶体 NH3、AsH3、PH3 AsH3、PH3、NH3 NH3、PH3、AsH3 6 1 4 (,0,)、(,,0) 4
【分析】(1)利用价层电子对数确定SnCl4的分子构型;由于常温下SnCl4为液体,故SnCl4为分子晶体;
(2)结构相似的分子,相对分子质量越大物质的熔沸点越高,另外分子间能形成氢键的物质,熔沸点则较高,键角的大小取决于中心原子的杂化类型、孤电子对数、成键电子对与成键电子对之间的斥力大小;
(3)由该物质的结构简式可知,螯合作用配位成环,故1个该配合物中通过螯合作用形成的配位键有6个,Cd—NO2那个不算;该螯合物中N原子的杂化方式为sp2杂化;
(4)结合部分原子的分数坐标,结合晶胞结构图,确定各原子在晶胞中位置,找出相应原子。
【详解】(1)Sn为第ⅣA族元素,由于常温下SnCl4为液体,故SnCl4为分子晶体;SnCl4分子中中心原子的孤电子对数==0,键电子对数为4,价层电子对数为4,故SnCl4分子的空间构型为正四面体形;
(2)NH3、PH3、AsH3的结构相似,结构相似的物质,相对分子质量越大,范德华力越强,物质的沸点越高,但是NH3分子间能形成氢键,故这三种物质的沸点NH3>AsH3>PH3;N、P、As这三种元素位于元素周期表中第ⅤA族,原子序数依次增大,同一主族从上到下,随着核电荷数的增加,原子半径逐渐增大,非金属性逐渐减弱,氢化物的还原性逐渐增强,故这三种物质的还原性由强到弱的顺序为AsH3>PH3>NH3;NH3、PH3、AsH3中中心原子都是sp3杂化,都有1对孤电子对,中心原子的电负性越小,成键电子对之间的斥力越小,成键电子对之间的斥力越小,键角越小,所以这三种物质 键角由大到小的顺序为NH3>PH3>AsH3;
(3)由该物质的结构简式和分析,根据题意“含有多个配位原子的配体与同一中心离子或原子通过螯合配位成环而形成的配合物为螯合物”,故该配合物中通过螯合作用形成的配位键有6mol,Cd—NO2那个不算;该螯合物中N原子的杂化方式都是sp2杂化,故该物质中N的杂化方式有1种;
(4)由部分Cd原子的分数坐标为(0,0,0),可知8个Cd在晶胞的顶点,4个Cd在晶胞的面心,1个在晶胞的体心;部分Sn原子的分数坐标为(0,0,),4个Sn在晶胞的棱上,6个Sn在晶胞的面心;部分As原子的分数坐标为(,,),8个As在晶胞的体心;所以1个晶胞中Sn的个数为 ;距离Cd(0,0,0)最近的Sn是(,0,)、(,,0);由晶胞结构图可知,CdSnAs2晶体中与单个Sn结合的As有4个。
【点睛】本题考查轨道杂化类型的判断,分子构型,物质熔沸点大小比较,键角大小的比较,配位数的计算,晶胞的计算等知识,立足课本进行适当拓展,但整体难度不大。难点仍然是晶胞的有关判断与计算,晶胞中原子的数目往往采用均摊法:①位于晶胞顶点的原子为8个晶胞共用,对一个晶胞的贡献为1/8;②位于晶胞面心的原子为2个晶胞共用,对一个晶胞的贡献为1/2;③位于晶胞棱心的原子为4个晶胞共用,对一个晶胞的贡献为1/4;④位于晶胞体心的原子为1个晶胞共用,对一个晶胞的贡献为1。
11. 1s22s22p63s23p63d64s2或[Ar]3d64s2 O sp3 N>O>C CH4或SiH4 7
【分析】
(1)Fe核外有26个电子,H2O中O原子有孤对电子,提供孤对电子。
(2)先计算NH3分子中氮原子价层电子对数,同周期,从左到右,第一电离能呈增大的趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族。
(3)根据价电子数Si=C=N+的关系得出互为等电子体的分子。
(4)羧基的结构是 ,一个羧基中有碳原子与氧原子分别形成两个σ键,一个羟基与碳原子相连形成一个σ键。
【详解】
(1)Fe核外有26个电子,其基态核外电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2;由于H2O中O原子有孤对电子,因此[Fe(H2O)6]2+中与Fe2+配位的原子是O;故答案为:1s22s22p63s23p63d64s2或[Ar]3d64s2;O。
(2)NH3分子中氮原子价层电子对数为,因此氮杂化类型为sp3,同周期,从左到右,第一电离能呈增大的趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族,因此C、N、O元素的第一电离能由大到小的顺序为N>O>C;故答案为:sp3;N>O>C。
(3)根据价电子数Si=C=N+,得出互为等电子体的分子是CH4或SiH4;故答案为:CH4或SiH4。
(4)羧基的结构是,一个羧基中有碳原子与氧原子分别形成两个σ键,三个羧基有6个,还有一个羟基与碳原子相连形成一个σ键,因此1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为7mol;故答案为:7。
【点睛】物质结构是常考题型,主要考查电子排布式,电离能、电负性、共价键分类、杂化类型、空间构型等。
12. A sp3 sp3 乙二胺的两个N提供孤对电子给金属离子形成配位键 Cu2+ Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O,分子间力(分子量)P4O6>SO2
【详解】(1)A.[Ne]3s1属于基态的Mg+,由于Mg的第二电离能高于其第一电离能,故其再失去一个电子所需能量较高; B. [Ne] 3s2属于基态Mg原子,其失去一个电子变为基态Mg+; C. [Ne] 3s13p1属于激发态Mg原子,其失去一个电子所需能量低于基态Mg原子; D.[Ne] 3p1属于激发态Mg+,其失去一个电子所需能量低于基态Mg+,综上所述,电离最外层一个电子所需能量最大的是[Ne]3s1,答案选A;
(2)乙二胺中N形成3个单键,含有1对孤对电子,属于sp3杂化;C形成4个单键,不存在孤对电子,也是sp3杂化;由于乙二胺的两个N可提供孤对电子给金属离子形成配位键,因此乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子;由于铜离子的半径较大且含有的空轨道多于镁离子,因此与乙二胺形成的化合物稳定性相对较高的是Cu2+;
(3)由于Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O,分子间力(分子量)P4O6>SO2,所以熔点大小顺序是MgO>Li2O>P4O6>SO2;
(4)根据晶胞结构可知Cu原子之间最短距离为面对角线的1/4,由于边长是a pm,则面对角线是,则x=pm;Mg原子之间最短距离为体对角线的1/4,由于边长是a pm,则体对角线是,则y=;根据晶胞结构可知晶胞中含有镁原子的个数是8×1/8+6×1/2+4=8,则Cu原子个数16,晶胞的质量是。由于边长是a pm,则MgCu2的密度是g·cm−3。
13. [Ar]3d9或1s22s22p63s23p63d9 正四面体 O sp3、sp2 易溶于水 4
【分析】考查物质结构与性质,涉及内容为电子排布式的书写、空间构型、配合物知识、杂化类型的判断、溶解性等知识,都属于基础性知识,难度系数不大;
【详解】(1)Cu位于第四周期IB族,其价电子排布式为3d104s1,因此Cu2+基态核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9;
(2)SO42-中S形成4个σ键,孤电子对数为(6+2-4×2)/2=0,因此SO42-空间构型为正四面体形;[Cu(OH)4]2-中Cu2+提供空轨道,OH-提供孤电子对,OH-只有O有孤电子对,因此[Cu(OH)4]2-中的配位原子为O;
(3)根据抗坏血酸的分子结构,该结构中有两种碳原子,全形成单键的碳原子和双键的碳原子,全形成单键的碳原子为sp3杂化,双键的碳原子为sp2杂化;根据抗环血酸分子结构,分子中含有4个-OH,能与水形成分子间氢键,因此抗坏血酸易溶于水;
(4)考查晶胞的计算,白球位于顶点和内部,属于该晶胞的个数为8×1/8+1=2,黑球全部位于晶胞内部,属于该晶胞的个数为4,化学式为Cu2O,因此白球为O原子,黑球为Cu原子,即Cu原子的数目为4;
【点睛】有关物质结构与性质的考查,相对比较简单,考查点也是基本知识,这就要求考生在《物质结构与性质》的学习中夯实基础知识,同时能够达到对知识灵活运用,如考查抗坏血酸分子溶解性,可以从乙醇极易溶于水的原因分析。
五年2018-2022高考化学真题按知识点分类汇编66-有机物的合成(含解析): 这是一份五年2018-2022高考化学真题按知识点分类汇编66-有机物的合成(含解析),共138页。试卷主要包含了单选题,有机推断题等内容,欢迎下载使用。
五年2018-2022高考化学真题按知识点分类汇编50-有机物的分类(含解析): 这是一份五年2018-2022高考化学真题按知识点分类汇编50-有机物的分类(含解析),共39页。试卷主要包含了单选题,多选题,有机推断题等内容,欢迎下载使用。
五年2018-2022高考化学真题按知识点分类汇编24-铜及其化合物(含解析): 这是一份五年2018-2022高考化学真题按知识点分类汇编24-铜及其化合物(含解析),共13页。试卷主要包含了单选题,填空题,计算题,实验题,元素或物质推断题等内容,欢迎下载使用。












