






高考化学二轮专题培优课件——专题九:s区元素 (含解析)
展开§9.1 s区元素概述
§9.5 锂 、铍的特殊性 和对角线规则
§9.2 单质的化学性质
§9.3 氧化物和氢氧化合物
碱金属(IA ):ns1 Li, Na, K, Rb, Cs, Fr碱土金属(IIA ):ns2 Be, Mg, Ca, Sr, Ba, Ra 都是活泼金属。
易与H2直接化合成MH、MH2离子 型化合物;与O2形成正常氧化物、过氧化物、 超氧化物;易与H2O反应(除Be、Mg外), 与非金属作用形成相应的化合物。
注:它们的活泼性有差异
原子半径增大金属性、还原性增强电离能、电负性减小
IA IIALi BeNa MgK Ca Rb SrCs Ba
原子半径减小金属性、还原性减弱电离能、电负性增大
9.2.1 单质的物理性质
9.2.2 单质的化学性质
单质在空气中燃烧,形成相应的氧化物:
Li2O Na2O2 KO2 RbO2 CsO2BeO MgO CaO SrO BaO2
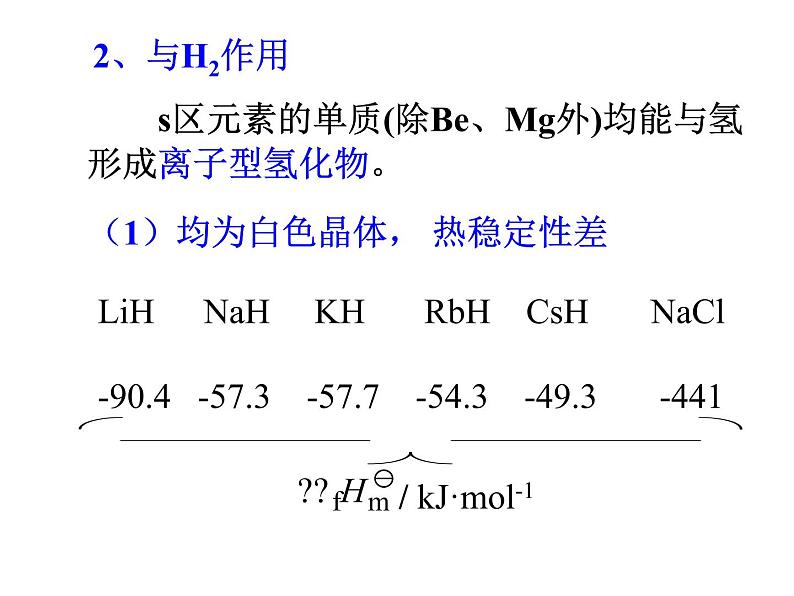
s区元素的单质(除Be、Mg外)均能与氢形成离子型氢化物。
LiH NaH KH RbH CsH NaCl-90.4 -57.3 -57.7-54.3 -49.3 -441
(1)均为白色晶体, 热稳定性差
(2)氢化物具强还原性
碱金属被水氧化的反应为:2 M(s) + 2 H2O (l) → 2 M+(aq) + 2 OH-(aq) + H2(g)
远不如相邻碱金属那样剧烈, 镁和铍在水和空气中因生成致密的氧化物保护膜而显得十分稳定。
碱土金属被水氧化的反应为: M(s) + 2 H2O (l)→ M+(aq) + 2 OH-(aq) + H2(g)
9.3.2 氢氧化物
9.3.1 氧化物
9.3.2 氢氧化物
碱金属和碱土金属的氢氧化物都是白色固体。
MOH易溶于水,放热。
碱土金属溶解度(20℃)
LiOH NaOH KOH RbOH CsOH 中强 强 强 强 强 Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2 两性 中强 强 强 强
碱性增强,溶解度增大。
9.4.3 含氧酸盐的热稳定性
晶体类型: 绝大多数是离子晶体,但碱土金属卤化物有一定的共价性。
例:Be2+极化力强, BeCl2为共价化合物。
重要盐类:卤化物、硝酸盐、硫酸盐、碳酸盐。
BeCl2 MgCl2 CaCl2 SrCl2 BaCl2熔点/ ℃ 415 714 775 874 962
新高考化学二轮总复习 专题突破课件 专题九 化学实验基础及综合实验(含解析): 这是一份新高考化学二轮总复习 专题突破课件 专题九 化学实验基础及综合实验(含解析),共60页。PPT课件主要包含了垫石棉网加热,4常用计量仪器,冷凝管,干燥仪器,6作容器,7其它,⑨减压过滤,玻璃棒,变色稳定,常见有机物的检验等内容,欢迎下载使用。
新高考化学二轮复习精品课件专题九有机化学基础(含解析): 这是一份新高考化学二轮复习精品课件专题九有机化学基础(含解析),共60页。PPT课件主要包含了内容索引,核心考点聚焦,专项热考突破,专题体系构建,答案A,酮羰基醚键,Sp2等内容,欢迎下载使用。
高考化学二轮专题培优课件——专题四:解离平衡 (含解析): 这是一份高考化学二轮专题培优课件——专题四:解离平衡 (含解析),共1页。












