高考化学必背知识与解题秘籍手册模块2.2 中学化学中的“量”、“化”、“剂”
展开模块二 中学化学中的“量”、“化”、“剂”
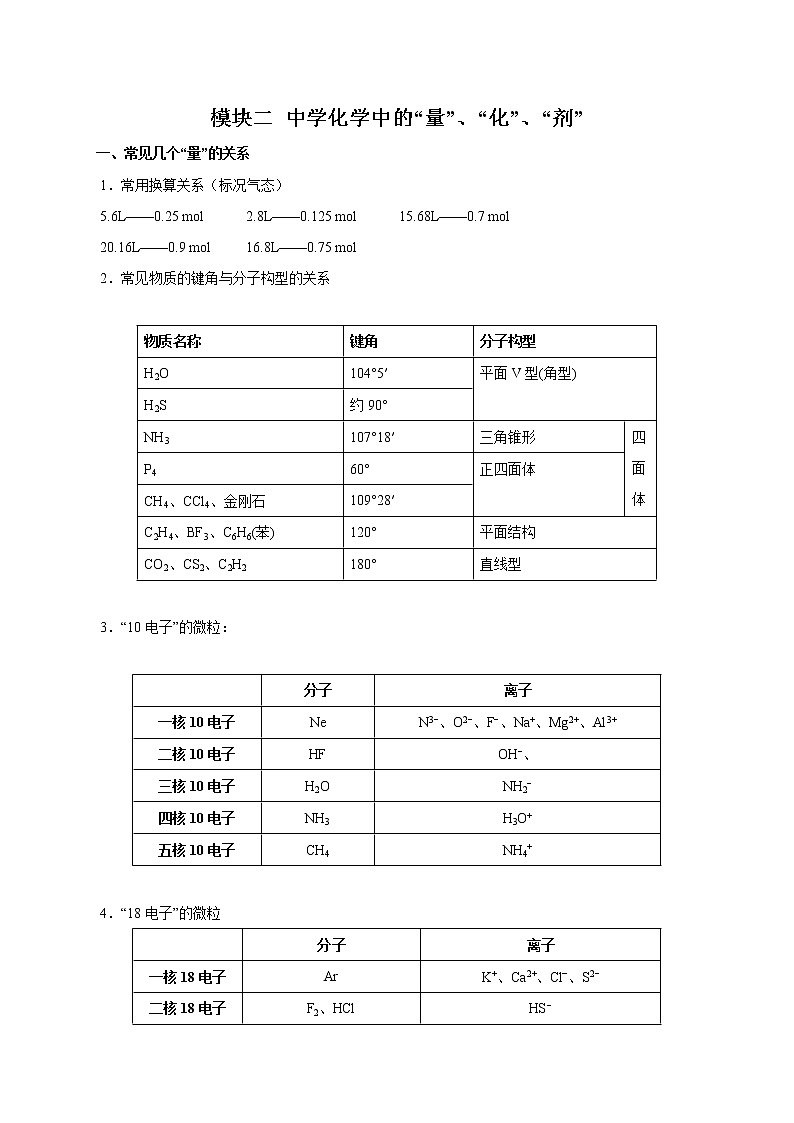
一、常见几个“量”的关系
1.常用换算关系(标况气态)
5.6L——0.25 mol 2.8L——0.125 mol 15.68L——0.7 mol
20.16L——0.9 mol 16.8L——0.75 mol
2.常见物质的键角与分子构型的关系
物质名称 | 键角 | 分子构型 | |
H2O | 104°5′ | 平面V型(角型) | |
H2S | 约90° | ||
NH3 | 107°18′ | 三角锥形 | 四 面 体 |
P4 | 60° | 正四面体 | |
CH4、CCl4、金刚石 | 109°28′ | ||
C2H4、BF3、C6H6(苯) | 120° | 平面结构 | |
CO2、CS2、C2H2 | 180° | 直线型 | |
3.“10电子”的微粒:
| 分子 | 离子 |
一核10电子 | Ne | N3−、O2−、F−、Na+、Mg2+、Al3+ |
二核10电子 | HF | OH−、 |
三核10电子 | H2O | NH2− |
四核10电子 | NH3 | H3O+ |
五核10电子 | CH4 | NH4+ |
4.“18电子”的微粒
| 分子 | 离子 |
一核18电子 | Ar | K+、Ca2+、Cl‾、S2− |
二核18电子 | F2、HCl | HS− |
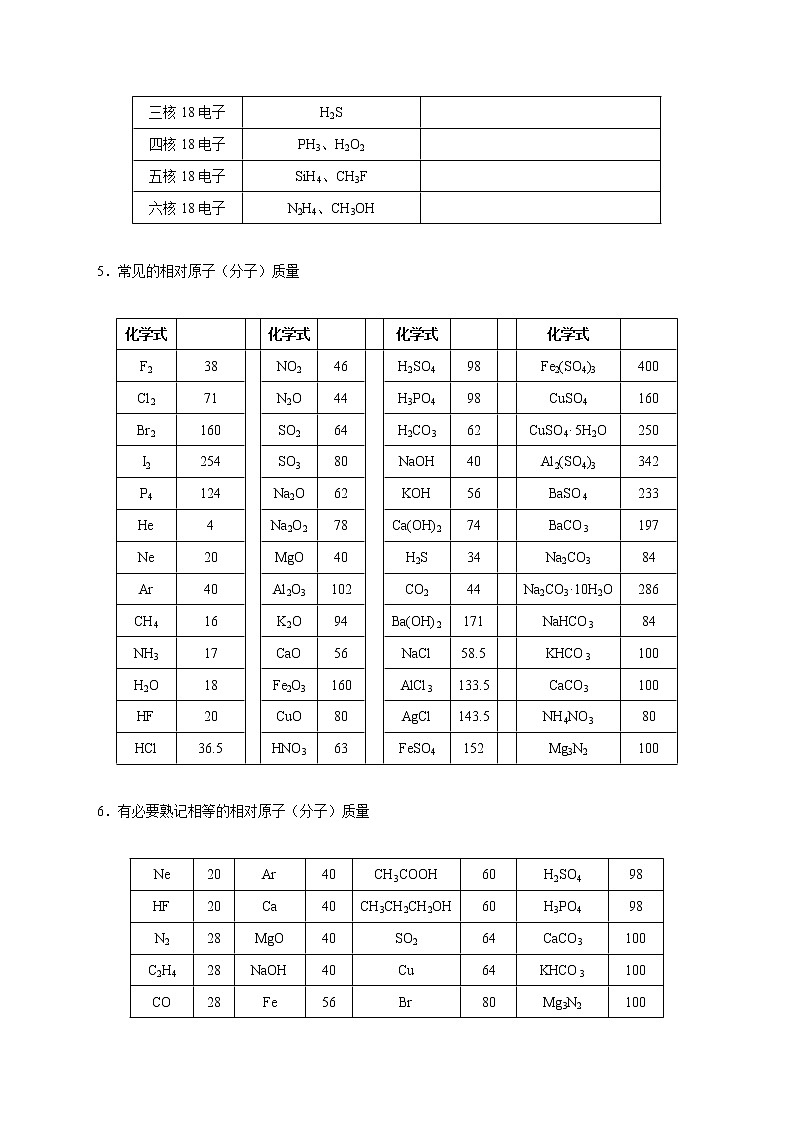
三核18电子 | H2S |
|
四核18电子 | PH3、H2O2 |
|
五核18电子 | SiH4、CH3F |
|
六核18电子 | N2H4、CH3OH |
|
5.常见的相对原子(分子)质量
化学式 |
|
| 化学式 |
|
| 化学式 |
|
| 化学式 |
|
F2 | 38 |
| NO2 | 46 |
| H2SO4 | 98 |
| Fe2(SO4)3 | 400 |
Cl2 | 71 | N2O | 44 | H3PO4 | 98 |
| CuSO4 | 160 | ||
Br2 | 160 | SO2 | 64 | H2CO3 | 62 |
| CuSO4· 5H2O | 250 | ||
I2 | 254 | SO3 | 80 | NaOH | 40 |
| Al2(SO4)3 | 342 | ||
P4 | 124 | Na2O | 62 | KOH | 56 |
| BaSO4 | 233 | ||
He | 4 | Na2O2 | 78 | Ca(OH)2 | 74 |
| BaCO3 | 197 | ||
Ne | 20 | MgO | 40 | H2S | 34 |
| Na2CO3 | 84 | ||
Ar | 40 | Al2O3 | 102 | CO2 | 44 |
| Na2CO3·10H2O | 286 | ||
CH4 | 16 | K2O | 94 | Ba(OH)2 | 171 |
| NaHCO3 | 84 | ||
NH3 | 17 | CaO | 56 | NaCl | 58.5 |
| KHCO3 | 100 | ||
H2O | 18 | Fe2O3 | 160 | AlCl3 | 133.5 |
| CaCO3 | 100 | ||
HF | 20 | CuO | 80 | AgCl | 143.5 |
| NH4NO3 | 80 | ||
HCl | 36.5 | HNO3 | 63 | FeSO4 | 152 |
| Mg3N2 | 100 |
6.有必要熟记相等的相对原子(分子)质量
Ne | 20 | Ar | 40 | CH3COOH | 60 | H2SO4 | 98 |
HF | 20 | Ca | 40 | CH3CH2CH2OH | 60 | H3PO4 | 98 |
N2 | 28 | MgO | 40 | SO2 | 64 | CaCO3 | 100 |
C2H4 | 28 | NaOH | 40 | Cu | 64 | KHCO3 | 100 |
CO | 28 | Fe | 56 | Br | 80 | Mg3N2 | 100 |
CO2 | 44 | CaO | 56 | SO3 | 80 | CuSO4 | 160 |
C3H8 | 44 | KOH | 56 | CuO | 80 | Fe2O3 | 160 |
N2O | 44 |
|
|
|
| Br2 | 160 |
二、中学常见的物理变化和化学变化
| 物理变化 | 化学变化 |
三馏 | 蒸馏、分馏 | 干馏 |
四色 | 焰色反应 | 显色反应、颜色反应、指示剂变色反应 |
五解 | 潮解 | 分解、裂解、水解、电解 |
十八化 | 熔化、汽化、 液化、酸化 | 氧化、氢化、水化、风化、钝化、皂化、炭化、催化、硫化、酯化、硝化、裂化、卤化、油脂硬化 |
1、氧化。化学反应中元素化合价升高(或失去电子)的反应。
2、风化。结晶水合物在室温和干燥的空气中失去部分或全部结晶水的过程。结晶水合物属于纯净物(不含其它杂质时)。结晶水合物在一定条件下会失去结晶水,如CuSO4·5H2O在加热时失去结晶水,Na2CO3 ·10H2O能风化。风化是指结晶水合物在干燥的空气中,常温下自动失去结晶水的现象。失去结晶水的过程属于化学变化。注意:风化为自然条件。硫酸铜加热失水不属于风化。
3、催化。能改变化学反应速率,催化剂本身一般参与反应而其质量和化学性质在反应前后不变,通常作为条件写在方程式中。
4、歧化。同一种物质中,同一种元素且为同一价态原子间发生的氧化还原反应。
5、酸化。向某物质中加入稀酸使之呈酸性的过程。注意:酸化时加入的酸不能与原物质发生化学反应。
6、钝化。常温下,铝、铁等金属与强酸(如浓H2SO4、浓HNO3)接触,金属表面生成一薄层致密氧化物保护膜的过程。
7、硬水软化。通过物理、化学方法除去硬水中较多的Ca2+、Mg2+的过程。
8、水化。烯、炔与水发生加成反应,生成新的有机物。
9、氢化(硬化)。液态油脂在一定条件下与氢气发生加成反应生成固态油脂的过程。作用:植物油变成硬化油后,稳定而不易变质,便于运输等。
10、皂化。油脂在碱性条件下,发生水解反应的过程。产物为高级脂肪酸和甘油。
11、老化。橡胶、塑料等制品露置在空气中,因受空气氧化,目光照射而使之变硬发脆的过程。
12、硫化。向橡胶中加硫,以改变其结构(双键变单键,形成交联)来改善橡胶的性能,减缓其老化速度的过程。
13、裂化。在一定条件下,分子量大、沸点高的烃断裂为分子量小、沸点低的烃的过程。如石油通过热裂化或催化裂化,用来提高汽油的质量和产量。
14、酯化。醇与酸生成酯和水的过程。
15、硝化(磺化)。苯环上的H被—NO2(或—SO3H)取代的过程。
16、卤化。烃与卤素在光照或催化条件下生成卤代烃的过程。
17、异构化。从一个异构体转变成另一个异构体的反应,通常指正链和支链少的烷烃在适当的条件下,可异构化为支链多的烷烃。
18、烷基化和酰基化。芳烃在催化剂作用下,与卤烷和酰卤(R-CO-X)等作用,环上的氢原子被烷基和酰基(-CO—R)取代的反应。
19、焦化。将煤隔绝空气加强热使其分解的过程,叫做煤的干馏,也叫煤的焦化。
20、煤的气化和液化。煤的气化是把煤中的有机物转化为可燃性气体的过程。煤气化的主要化学反应是碳和水蒸气的反应。煤的液化是把煤转化成液体燃料的过程,把煤与适当的溶剂混合后,在高温、高压下(有时需使用催化剂)把煤与氢气作用生成液体燃料。或先把煤气化成一氧化碳和氢气,然后再经过催化合成,得到液体燃料。
三、 中学化学中的20“剂”
1、催化剂。能够改变化学反应速度而自身的化学性质、质量在反应前后均无改变的物质。
2、干燥剂。能够吸收水分,而使其它物质被干燥的物质。常见的干燥剂有:①酸性干燥剂。如浓H2SO4、P2O5等;不能用来干燥碱性物质,如NH3。但浓H2SO4不能用来干燥还原性较强的气体,如H2S、IH等。②碱性干燥剂。如碱石灰、CaO、NaOH固体等,不能干燥酸性气体,如HCl、SO2、H2S、CO2等。③中性干燥剂。如无水CaCl2、Mg(NO3)2、硅胶等,应注意不能用CaCl2.来干燥NH3,因为能生成CaCl2·8NH3。
3、指示剂。能在一定溶液中显示出其酸性、中性或碱性的物质。常见的有:①紫色石蕊试液。中间色为紫色,遇酸性溶液显红色,遇碱性溶液显蓝色,变色范围为5~8。②无色酚酞试液。中间色为浅红色,遇碱性溶液显红色,变色范围为8~10。③甲基橙试液。中间色为橙色,遇酸性溶液显红色,遇碱性溶液显黄色,变色范围为3.1~4.4。④品红试液。遇SO2、Cl2、Na2O2、H2O2、Ca(ClO)2、HNO3等具有漂白性物质红色褪去。
4、漂白剂。能使含有有机色素的物质颜色消失的物质。根据褪色的原因不同,主要类型有:①氧化型。如漂白粉、氯水、过氧化钠、浓硝酸、臭氧等,能将有机色素氧化而使之褪色,此过程是不可逆的。②还原型。如二氧化硫,因与有色物质结合生成不稳定的无色化合物而漂白,该过程是不可逆的。③吸附型。如活性炭,能吸附色素而使物质漂白,该过程属于物理过程。
5、净水剂。能除去水中泥沙等悬浮物而使水变洁净的物质。如KAl(SO4)2·12H2O、FeSO4·7H2O、FeCl3等,它们均能水解生成表面积大、具有强吸附性的胶体分散质微粒,把水中悬浮物凝聚沉于水底,使水得以净化。
6、脱水剂。能使化合物中的氢氧原子按2:1比例脱出的物质。如浓H2SO4、P2O5等。
7、铝热剂。某些金属氧化物(Fe2O3、V2O5、Cr2O3、MnO2等)和铝粉的混合物。
8、收敛剂。可使有机体组织收缩、减少腺体分泌的物质。如ZnSO4、Na2SO4·10H2O(缓泻剂)等。
9、消毒剂。能使细菌和病毒变性,而杀死细菌和病毒的物质。如氯水、酒精、甲醛等。
10、防腐剂。能防止物质腐烂的物质。如苯甲酸钠、CH3COOH、NaNO2等。
11、凝固剂。能使胶体或蛋白质溶液中的分散质发生凝聚的物质。如(NH4)2SO4、MgCl2、CaSO4等。
12、灭火剂。能灭火的物质。如H2O(降低温度使燃烧物不能达到着火点)、CO2、CCl4干粉灭火器(隔绝空气,使燃烧物缺氧而不能继续燃烧)等。
13、吸附剂。能除去水溶液中各种小分子杂质或有机色素,以及能净化气体中的有毒物质的物质。如活性炭、硅藻土等。
14、致冷剂。通过物质状态的变化降低环境温度的物质。如液氨、氟里昂、干冰等。
15、抗冻剂。能使其它物质凝固点降低的物质。如甘油(丙三醇)、乙二醇等。
16、离子交换剂。能与溶液中其它离子发生相互交换的物质。如硬水软化过程中,常用磺化煤(NaR)中的Na+与硬水中的Ca2+、Mg2+进行交换使水得以软化。
17、熔剂。能够降低其它物质的熔点的物质。如冰晶石(NaAlF6),它能降低Al2O3的熔点,使Al2O3在较低温度下电解。
18、硝化剂。硝酸在硝化反应过程中所起的作用。如制硝基苯。
19、磺化剂。硫酸在磺化反应过程中所起的作用。如制苯磺酸。
20、引爆剂。能够使其它物质引起爆炸的物质。如雷酸汞,在TNT爆炸时作引爆作用。








