

2020高考化学一轮复习第六章化学反应与能量第3节检测(含解析)
展开这是一份2020高考化学一轮复习第六章化学反应与能量第3节检测(含解析),共8页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
化学反应与能量
一、选择题
1.用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是( )
甲 乙
A.甲是原电池,乙是电解池
B.甲中铁棒比乙中铁棒更易腐蚀
C.d电极上的电极反应是Fe-2e-===Fe2+
D.b电极上的电极反应是O2+2H2O+4e-===4OH-
【答案】C
2.(2019·四川成都一诊)港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是( )
A.防腐原理主要是避免发生反应2Fe+O2+2H2O===2Fe(OH)2
B.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池
C.采用外加电流的阴极保护时需外接镁、锌等作辅助阳极
D.钢构件可采用不锈钢材料以减缓电化学腐蚀
【答案】C
3.四个电解装置都以Pt作电极,它们分别盛有如下电解质溶液进行电解,电解一段时间后,测定其pH变化,所记录的结果正确的是( )
选项 | A | B | C | D |
电解质溶液 | HCl | AgNO3 | KOH | BaCl2 |
pH变化 | 减小 | 增大 | 增大 | 不变 |
【答案】C
【解析】电解盐酸,溶质HCl的量会减小,溶剂的量不变,所以酸性减弱,pH增大,故A项错误;电解硝酸银溶液生成硝酸、金属银和氧气,溶液酸性增强,pH减小,故B项错误;电解氢氧化钾的实质是电解水,溶质的量不变,溶剂的量减小,碱性增强,pH增大,故C项正确;电解氯化钡溶液得到的是氢氧化钡、氢气和氯气,溶液碱性增强,pH增大,故D项错误。
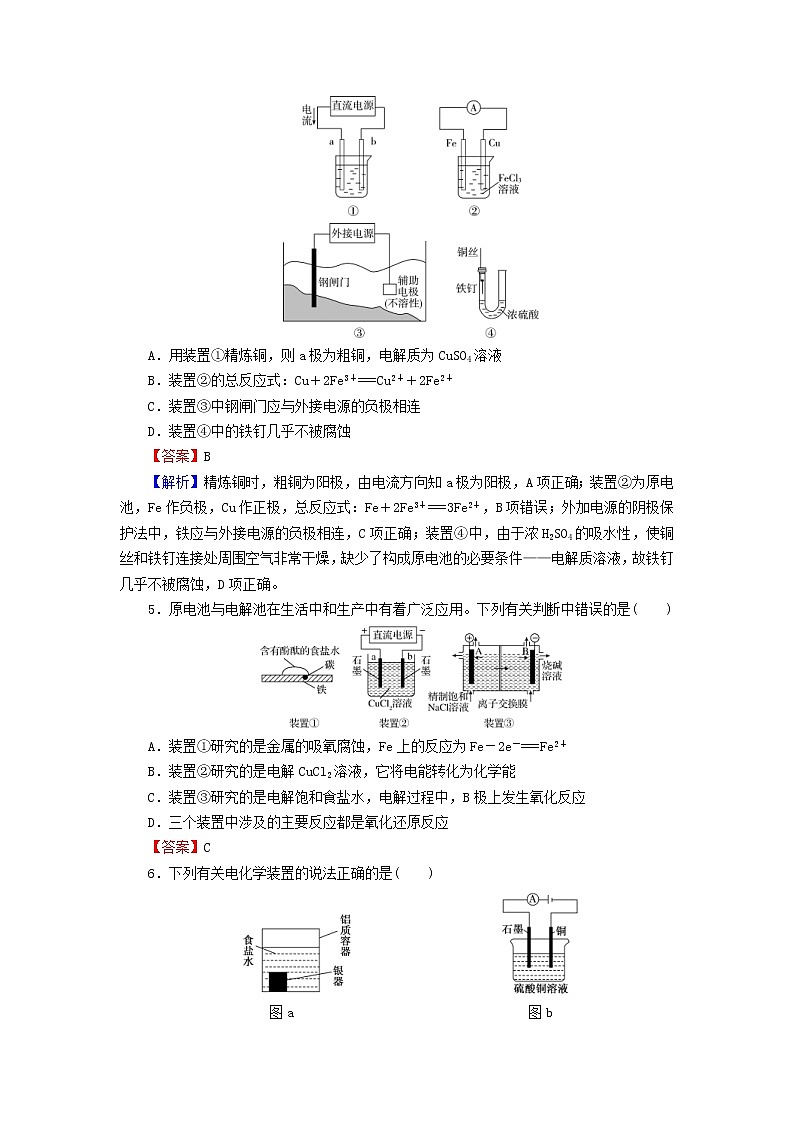
4.下列关于各装置图的叙述,不正确的是( )
A.用装置①精炼铜,则a极为粗铜,电解质为CuSO4溶液
B.装置②的总反应式:Cu+2Fe3+===Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎不被腐蚀
【答案】B
【解析】精炼铜时,粗铜为阳极,由电流方向知a极为阳极,A项正确;装置②为原电池,Fe作负极,Cu作正极,总反应式:Fe+2Fe3+===3Fe2+,B项错误;外加电源的阴极保护法中,铁应与外接电源的负极相连,C项正确;装置④中,由于浓H2SO4的吸水性,使铜丝和铁钉连接处周围空气非常干燥,缺少了构成原电池的必要条件——电解质溶液,故铁钉几乎不被腐蚀,D项正确。
5.原电池与电解池在生活中和生产中有着广泛应用。下列有关判断中错误的是( )
A.装置①研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e-===Fe2+
B.装置②研究的是电解CuCl2溶液,它将电能转化为化学能
C.装置③研究的是电解饱和食盐水,电解过程中,B极上发生氧化反应
D.三个装置中涉及的主要反应都是氧化还原反应
【答案】C
6.下列有关电化学装置的说法正确的是( )
图a 图b
图c 图d
A.利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-===2Ag+S2-
B.图b电解一段时间,铜电极溶解,石墨电极上有光亮的红色物质析出
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
【答案】A
【解析】形成原电池反应,Al为负极,被氧化,Ag2S为正极,被还原,正极反应式为Ag2S+2e-===2Ag+S2-,A项正确;铜为阴极,发生还原反应,不能溶解,石墨电极上生成氧气,B项错误;图c中的X极若为负极,粗铜为阴极,而电解精炼铜时,粗铜作阳极,纯铜作阴极,不能进行粗铜的精炼,C项错误;该装置有外接电源,属于“外加电源的阴极保护法”,D项错误。
7.(2019·安徽宿州模拟)关于下列装置的说法正确的是( )
A.装置①中盐桥内的K+移向CuSO4溶液
B.装置①将电能转变为化学能
C.若装置②用于铁棒镀铜,则N极为铁棒
D.若装置②用于电解精炼铜,溶液中的Cu2+浓度保持不变
【答案】A
【解析】装置①是原电池,Zn是负极,Cu是正极,K+移向CuSO4溶液,A项正确,B项错误;装置②是电解池,N是阳极,M是阴极,铁棒镀铜时M极应为铁棒,C项错误;电解精炼铜时,溶液中的Cu2+浓度降低,D项错误。
8.(2018·四川绵阳中学二模)我国科研人员研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如下图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是( )
A.“吸入”CO2时,钠箔为正极
B.“吸入”CO2时的正极反应:4Na++3CO2+4e-===2Na2CO3+C
C.“呼出”CO2时,Na+向多壁碳纳米管电极移动
D.标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol
【答案】B
【解析】 “吸入”CO2时是原电池装置,钠箔失电子为负极,正极发生还原反应,电极反应式:4Na++3CO2+4e-===2Na2CO3+C,选项A错误,选项B正确; “呼出”CO2时是电解池,阳离子Na+向阴极钠箔电极移动,选项C错误;标准状况下,每“呼出”22.4 L CO2,物质的量为1 mol,结合阳极电极反应式2Na2CO3+C-4e-===4Na++3CO2,所以每“呼出”22.4 L CO2,转移电子数为 mol,选项D错误。
9.(2019届四川达州一诊)铅蓄电池是重要的化学电源,该电池在放电过程的总反应:
Pb(s)+PbO2(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l)
现以铅蓄电池为外电源,在钢制品上电镀铝。电镀时以室温熔融盐(有机阳离子、Al2Cl和AlCl组成的离子液体)作电解液(非水体系)。下列说法不正确的是( )
A.钢制品应与铅蓄电池的PbO2极相接
B.电镀时Al2Cl、AlCl离子浓度保持不变
C.铅蓄电池正极的电极反应为PbO2(s)+4H+(aq)+SO(aq)+2e-===PbSO4(s)+2H2O
D.电镀时阳极的电极反应:Al+7AlCl-3e-===4Al2Cl
【答案】A
10.(2018·福建福州模拟)某科研小组用图示装置处理污水,方法如下:保持污水的pH在5.0~6.0,工作时产生胶体和气体,胶体吸附污物形成沉淀,气体把污水中悬浮物带到水面形成浮渣层。下列有关污水处理过程的说法不正确的是( )
A.甲装置为电解池,且铁电极为阳极
B.乙池正极反应式O2+2H2O+4e-===4OH-
C.乙池工作时,循环的物质A为CO2
D.消耗1.6 g CH4时,碳电极生成8.96 L气体(标况)
【答案】B
二、非选择题
11.(2018·北京东城区期末)某课外小组分别用图中所示装置对原电池和电解原理进行实验探究。
甲 乙
请回答:
Ⅰ.用甲图装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是________(填字母)。
A.铝 B.石墨
C.银 D.铂
(2)N极发生反应的电极反应式为________________________________________。
(3)实验过程中,SO__________(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有________________________________________。
Ⅱ.用乙图装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料得知,高铁酸根离子(FeO)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-===FeO+4H2O和________________________________________________________________________。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn===Fe2O3+ZnO+2K2ZnO2。该电池正极发生的反应的电极反应式为___________________。
【答案】(1)A (2)2H++2e-===H2↑(或2H2O+2e-===H2↑+2OH-)
(3)从右向左 滤纸上有红褐色斑点产生(答出“红褐色斑点”或“红褐色沉淀”即可)
(4)增大 (5)4OH--4e-===2H2O+O2↑ (6)0.28
(7)2FeO+6e-+5H2O===Fe2O3+10OH-
【解析】Ⅰ.(1)甲图中左侧是原电池装置,Zn为负极,Cu为正极,Cu电极也可以换成比Zn活泼性弱的金属或石墨。
(2)甲图中右侧是电解池装置,则M为阳极,N为阴极,H+在阴极得电子,发生还原反应。
(3)在原电池中阴离子移向原电池的负极,甲图中M电极(Fe)被腐蚀,故滤纸上最后会出现Fe(OH)3。
Ⅱ.(4)乙图为电解NaOH溶液的装置,在此装置中X(C)为阴极,Y(Fe)为阳极,电解过程中,溶液中的H+在X极上放电,故c(H+)降低,pH增大。
(5)由题干知,Y电极上有气体生成,应为OH-放电得到O2。
(6)电解池中电子守恒,H+得到的电子等于OH-与铁失去的电子之和,列出方程式即可求解。
12.如图所示的是探究金属腐蚀条件的实验装置图,请分析实验并回答下列问题:
甲 乙 丙
(1)若起始时甲、乙、丙3套装置的导管中液面高度相同,过一段时间后液面最高的是________。
(2)通过甲、乙装置的对比说明钢铁中碳的含量越__________(填“高”或“低”),钢铁越易腐蚀。
(3)乙装置中发生电化学腐蚀时正极的电极反应式为____________________________。
【答案】(1)乙 (2)高 (3)2H2O+O2+4e―===4OH―
【解析】(1)甲、乙、丙3套装置中的乙装置形成了原电池,铁作负极失电子,炭粉作正极,氧气得电子,使试管内压强降低,所以乙装置导管中液面上升最高。(2)通过甲、乙装置的对比说明钢铁中碳的含量越高,越易形成原电池造成钢铁的腐蚀。(3)乙装置形成了原电池,碳作正极,氧气得电子,电极反应式:2H2O+O2+4e-===4OH―。
13.(1)(2017·湖北襄阳四市2月联考)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见价态有+3、+4,铈的合金耐高温,可以用来制造喷气推进器零件。可采用电解法将吸收液中的NO转化为无毒物质,同时再生Ce4+,其原理如图甲所示。
甲
①Ce4+从电解槽的________(填字母序号)口流出。
②写出阴极的电极反应式:__________________。每消耗1 mol NO,阴极区H+物质的量减少______mol。
(2)(2017·深圳三模节选)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图乙所示,阳极的电极反应式为____________________;其中可循环使用的物质是__________。(填化学式)
乙
【答案】(1)①a ②2NO+8H++6e-===N2↑+4H2O 4
(2)Fe+8OH--6e-===FeO+4H2O NaOH溶液
【解析】(2)阳极是铁,故阳极上铁放电生成FeO,由于是碱性环境,故电极方程式为Fe+8OH--6e-===FeO+4H2O。在电解时,水电离的H+在阴极放电:2H++2e-===H2↑,c(OH-)增大,Na+通过阳离子交换膜进入阴极区,使阴极区c(NaOH)增大,故NaOH可以循环使用。
14.铁元素及其化合物与人类的生产、生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为____________________________________________________。
(2)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2。
①石墨Ⅰ电极上的电极反应式为________________________。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法正确的是__________(填字母)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作为电解质溶液
C.阴极发生的反应是2H2O+2e-===H2↑+2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为________________________,该反应的化学方程式为____________________________________________________。
【答案】(1)2Fe3++Cu===2Fe2++Cu2+
(2)①H2-2e-+CO===CO2+H2O ②B、C
③由白色迅速变成灰绿色,最终变成红褐色
4Fe(OH)2+O2+2H2O===4Fe(OH)3
【解析】(1)Fe3+具有较强的氧化性,能够氧化Cu:2Fe3++Cu===2Fe2++Cu2+。
(2)①石墨Ⅰ电极上氢气发生氧化反应,石墨Ⅰ电极为负极,电极反应式为H2-2e-+CO===CO2+H2O。②制取Fe(OH)2则应使铁生成Fe2+,故铁电极应与电源的正极相连,故Y极必须是Fe,X极可以选石墨棒等作电极,A项错误;若选用NaOH溶液作电解质溶液,白色沉淀在阳极上产生,若选NaCl溶液作电解质溶液则沉淀在两极中间的溶液中产生,B项正确、D项错误;阴极反应为2H2O+2e-===H2↑+2OH-,C项正确。
相关试卷
这是一份2020高考化学一轮复习第六章化学反应与能量第1节真题检测(含解析),共5页。
这是一份2020高考化学一轮复习第六章化学反应与能量第3节真题检测(含解析),共5页。
这是一份2020高考化学一轮复习第六章化学反应与能量第2节真题检测(含解析),共4页。












