










高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素课文课件ppt
展开问题1:人在CO中毒之后需要转移至空旷通风氧气充足的地方(已知化学方程式(中毒原理):HbO2 + CO ⇌HbCO + O2),想一想这是什么原理呢?
1.认识浓度、温度等因素对化学平衡的影响,加深对平衡移动原理的理解。2.进一步学习控制变量、对比等科学方法,发展归纳和推理能力。
小烧杯、大烧杯、量筒、试管、试管架、玻璃棒、胶头滴管、酒精灯、火柴、装有NO2和N2O4混合气体的平衡球装置。 铁粉、0.05 ml·L-1 FeCl3溶液、0.15 ml·L-1 KSCN溶液、0.1 ml·L-1 K2Cr2O7溶液、6 ml·L-1 NaOH溶液、6 ml·L-1 H2SO4溶液、 热水、冰块、蒸馏水。
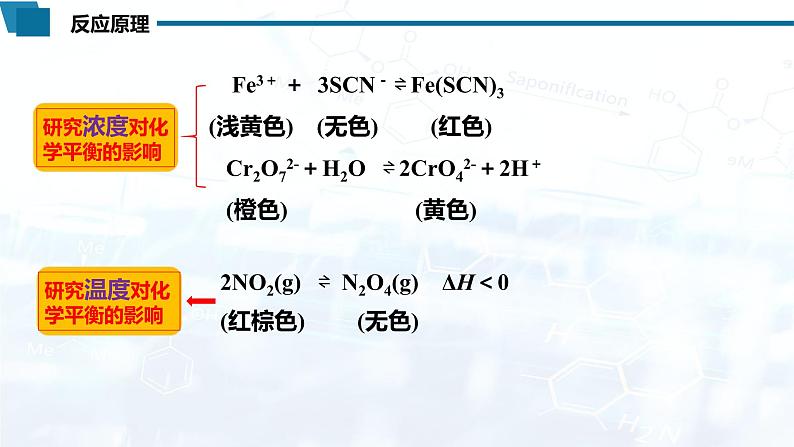
Fe3+ + 3SCN- ⇌ Fe(SCN)3 (浅黄色) (无色) (红色) Cr2O72-+H2O ⇌ 2CrO42-+2H+ (橙色) (黄色) 2NO2(g) ⇌ N2O4(g) ΔH<0 (红棕色) (无色)
研究温度对化学平衡的影响
研究浓度对化学平衡的影响
问题2:根据以上反应原理,如何设计实验探究浓度以对化学平衡移动的影响?在实验过程中怎样做到控制变量?
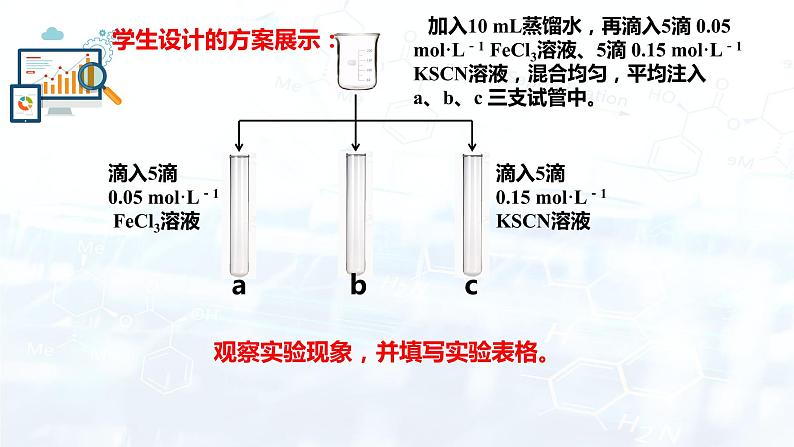
加入10 mL蒸馏水,再滴入5滴 0.05 ml·L-1 FeCl3溶液、5滴 0.15 ml·L-1 KSCN溶液,混合均匀,平均注入a、b、c 三支试管中。
滴入5滴 0.05 ml·L-1 FeCl3溶液
滴入5滴 0.15 ml·L-1 KSCN溶液
观察实验现象,并填写实验表格。
一、浓度对化学平衡的影响
1. FeCl3溶液与KSCN溶液的反应。 反应原理:Fe3++ 3SCN-⇌Fe(SCN)3 (浅黄色) (无色) (红色)
将上述试管a中溶液平均注入试管d和e中,向e中加入少量铁粉同样将上述试管c中溶液平均注入试管f和g中,向g中加入少量铁粉
学生设计的方案展示2:
Cr2O72-+H2O ⇌ 2CrO42-+2H+ (橙色) (黄色)
加入 2 mL 0.1 ml·L-1 K2Cr2O7溶液
滴加 5 滴6 ml·L-1NaOH溶液
继续滴加 5 滴6 ml·L-1HCl 溶液
问题3:根据以上反应原理,如何设计实验探究温度对化学平衡移动的影响?在实验过程中怎样设计方案进行对比?
二、温度对化学平衡的影响
取两个封装有NO2和N2O4混合气体的平衡球(编号分别为1、2和3、4),将第一个平衡球分别浸在盛有热水、常温水的大烧杯中,比较两个烧瓶里气体的颜色变化。将第二个平衡球分别浸在盛有冷水、常温水的大烧杯中,比较两个烧瓶里气体的颜色变化。。完成下表[2NO2(g)⇌N2O4(g) ΔH<0]。
1. 通过本节实验课的学习,我们掌握了浓度、温度对化学平衡移动的影响规律。2. 在实验过程中,我们学习了控制变量、对比归纳等科学方法,进一步提升了归纳和推理能力。
1.在进行浓度、温度对化学平衡影响的实验时,应注意哪些问题?
答案 注意控制变量法的运用,在研究温度对平衡移动的影响时,只能改变温度这一个条件,其他条件保持一致。还要注意对比法的运用。
2.结合实验内容,尝试归纳影响化学平衡移动的因素。
答案 浓度改变: 增加反应物的浓度或减少生成物的浓度,平衡向正反应方向移动;减少反应物的浓度或增加生成物的浓度,平衡向逆反应方向移动。 温度改变: 升高温度,平衡向吸热反应方向移动; 降低温度,平衡向放热反应方向移动。
1. 下列化学反应中:Ag++Fe2+ ⇌Ag(s)+Fe3+(正反应放热),为使平衡体系析出更多的银,可采取的措施是( )A. 常温下加压B. 增加Fe3+的浓度C. 增加Fe2+的浓度D. 移去一些析出的银
2.某同学利用如图1装置探究温度对化学平衡的影响,已知烧瓶中存在如下平衡:2NO2(g)⇌N2O4(g) ΔH<0,当进行图2实验后,以下结论正确的是( )A.图2中,B烧瓶颜色较深B.图2中,B烧瓶与A烧瓶相比有较多的NO2C.图2中B烧瓶的正反应速率比图1中B烧瓶的快D.图2中A烧瓶的正反应速率比图1中A烧瓶的快
3.已知反应2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6 kJ/ml。若反应达到平衡后,升高温度,下列说法中正确的是( )A. v正减小,v逆增大,平衡逆向移动B. v正增大,v逆减小,平衡正向移动C. v正、v逆同时增大,平衡正向移动D. v正、v逆同时增大,平衡逆向移动
4. 工业合成氨的反应原理为:N2(g)+3H2(g)⇌2NH3(g) ΔH<0,下列措施既能加快反应速率又能提高产率的是( )A. 升高温度 B. 分离出NH3C. 增大压强 D. 使用催化剂
高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素图片课件ppt: 这是一份高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素图片课件ppt,共25页。
高中化学实验活动1 探究影响化学平衡移动的因素精品课件ppt: 这是一份高中化学实验活动1 探究影响化学平衡移动的因素精品课件ppt,共16页。PPT课件主要包含了知识梳理,实验探究,实验反思,随堂检测等内容,欢迎下载使用。
高中实验活动1 探究影响化学平衡移动的因素图片免费ppt课件: 这是一份高中实验活动1 探究影响化学平衡移动的因素图片免费ppt课件,共15页。













