






2022年高考总复习 化学 模块2 第六单元 高考素能提升十 酸碱中和滴定的拓展应用课件PPT
展开素养说明:通过酸碱中和滴定原理的学习延伸为沉淀滴定和氧化还原滴定是近几年热点题型,通过分析建模,让考生形成解题程序,同时能够体现出考生对图形的识别及定量分析的能力。
(1)原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有
还原性或氧化性的物质。
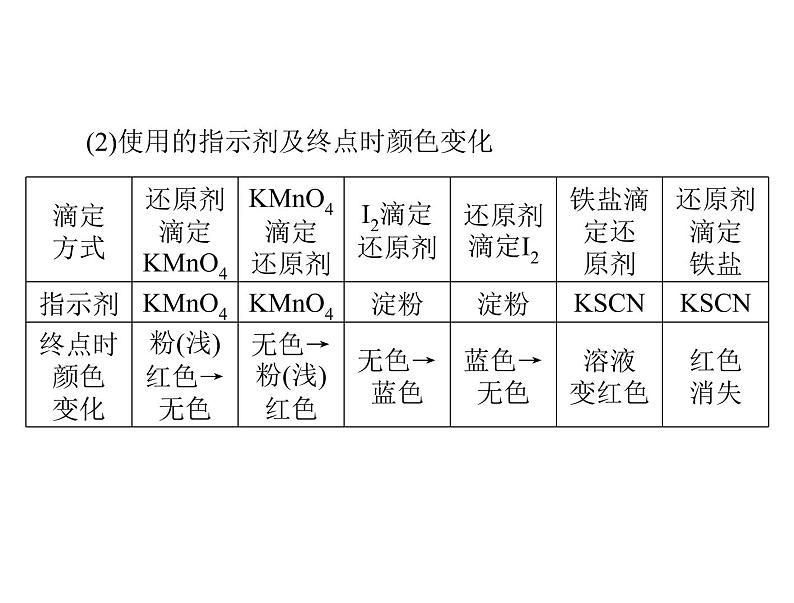
(2)使用的指示剂及终点时颜色变化
[典例1](2020 年江苏一模)过碳酸钠是一种多用途的新型漂白剂,化学式可表示为 aNa2CO3·bH2O2,过碳酸钠溶于水分解成 Na2CO3 和 H2O2。(1)FeOCl 常用作过碳酸钠使用时的催化剂。FeCl3·6H2O 在250 ℃时分解可得到 FeOCl,该反应的化学方程式为____________________________________。(2)测定某样品中过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
①步骤Ⅰ中,滴定终点的现象是____________________。②步骤Ⅱ中,若样品溶于水酸化后放置一段时间,然后再进行滴定,则过碳酸钠化学式中 a∶b 的测定结果将________(填“偏大”“偏小”或“无影响”)。
物料守恒,该反应的化学方程式为FeCl3·6H2O=======FeOCl
③通过计算确定该过碳酸钠化学式为______________。解析:(1)FeCl3·6H2O 在 250 ℃时分解可得到 FeOCl,根据
+2HCl↑+5H2O↑。(2)①步骤Ⅰ中,甲基橙作指示剂,终点时,最后一滴硫酸过量,甲基橙由黄色变为橙色,滴定终点的现象是加入最后一滴硫酸标准液,甲基橙由黄色变为橙色,且半分钟内不变色。②步骤Ⅱ中,样品溶于过碳酸钠分解成 Na2CO3和 H2O2,酸化后放置一段时间双氧水会发生分解生成水,双氧水的含量减少,再用 KMnO4 溶液进行滴定时,与双氧水发生反应,消耗标准溶液的体积减小,导致测得的双氧水的量减小,
a.取待测 NaI 溶液 25.00 mL 于锥形瓶中。
b.加入 25.00 mL 0.1000 ml·L-1AgNO3 溶液(过量),使 I-完
全转化为 AgI 沉淀。
c.加入 NH4Fe(SO4)2 溶液作指示剂。
d.用 0.1000 ml·L-1NH4SCN 溶液滴定过量的 Ag+,使其恰好完全转化为 AgSCN 沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
(1)将称得的 AgNO3 配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有______________________________________。(2)AgNO3 标准溶液放在棕色试剂瓶中避光保存的原因是_
__________________。
(3)滴定应在 pH<0.5 的条件下进行,其目的是____________
___________________。
(4)b 和 c 两步操作是否可以颠倒__________,说明理由_________________________________________________________。
测得c(I-)=________ml·L-1。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”“偏
(5)所消耗的 NH4SCN 标准溶液平均体积为________mL,
(6)在滴定管中装入 NH4SCN 标准溶液的前一步,应进行的
操作为__________________________。
①若在配制 AgNO3 标准溶液时,烧杯中的溶液有少量溅
出,则测定结果________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则
测定结果________。
NH4SCN 标准溶液润洗滴定管。(7)①在配制 AgNO3 标准溶液时,若烧杯中溶液有少量溅出,配制的 AgNO3 标准溶液的浓度偏低,则滴定时消耗的 NH4SCN 标准溶液的体积偏小,测得的c(I-)偏高。②滴定管 0 刻度在上,读数时从上往下读数,读取体积偏小,计算所用 NH4SCN 的物质的量偏低,测得的 c(I-)偏低。
答案:(1)250 mL(棕色)容量瓶、胶头滴管(2)避免 AgNO3 见光分解(3)防止因 Fe3+的水解而影响滴定终点的判断(或抑制 Fe3+的水解)
若颠倒,Fe3+与 I-反应,指示剂耗尽,无
(4)否(或不能)法判断滴定终点
(5)10.00 0.0600
(6)用 NH4SCN 标准溶液进行润洗
2024届高三化学一轮复习课件:酸碱中和滴定及拓展应用: 这是一份2024届高三化学一轮复习课件:酸碱中和滴定及拓展应用,共3页。PPT课件主要包含了滴定终点,⑦使用方法,是否漏水,3mL,“0”刻度,粉红色,甲基橙,浅红色,半分钟,标准液等内容,欢迎下载使用。
高考化学一轮复习课件第8章第3讲 酸碱中和滴定及拓展应用(含解析): 这是一份高考化学一轮复习课件第8章第3讲 酸碱中和滴定及拓展应用(含解析),共50页。PPT课件主要包含了考向1,甲基橙,锥形瓶,待装液,不恢复,考向2,训练四十等内容,欢迎下载使用。
热考题型特训13 酸碱中和滴定原理的拓展应用课件PPT: 这是一份热考题型特训13 酸碱中和滴定原理的拓展应用课件PPT,共45页。













