




2022天津市耀华中学高三上学期第三次月考化学试题含答案
展开天津市耀华中学2022届高三年级第三次月考化学试卷
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试时间60分钟。
相对原子质量:H-1 C-12 N-14 O-16
第Ⅰ卷(共36分)
本卷共12题,每题3分,共36分。在每题给出的四个选项中,只有一项是最符合题目要求的。
1. 2021年9月24日,主题为“智慧。健康。碳中和”的2021中关村论坛开幕。碳中和是指特定时期内全球人为CO2排放量与CO2消除量相等;我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。下列措施对实现“碳中和”不具有直接贡献的是
A. 推行生活垃圾分类 B. 植树造林增加绿色植被
C. 采取节能低碳生活方式 D. 创新CO2转化为碳燃料的技术
2. 下列物质应用正确的是
A. 泡沫灭火器可用于金属钠着火时灭火 B. 碳酸钡可用于胃肠X射线造影检查
C. 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 D. 用淀粉检验食盐中的碘元素
3. 下列有关实验装置进行的相应实验,能达到实验目的的是
A. 用图1配制0.10 mol·L−1NaOH溶液 B. 用图2装置除去Cl2中含有的少量HCl
C. 图3记录滴定终点读数为12.20mL D. 用图4装置制取并收集干燥纯净的NH3
4. 下列离子反应方程式正确的是
A. 向酸性高锰酸钾溶液中加入少量双氧水:2KMnO4+3H2O2+3H2SO4=K2SO4+2MnSO4+4O2↑+6H2O
B. CuSO4与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH
C. 向硫酸铝铵溶液滴加足量的氢氧化钡溶液:Al3++2SO+2Ba2++4OH—=AlO+2BaSO4↓+2H2O
D. Fe与稀硝酸反应,当n(Fe):n(HNO3)=1∶2时,3Fe+2NO+8H+=3Fe2++2NO↑+4H2O
5. 一种新催化剂,能在室温下催化空气氧化甲醛:HCHO+O2CO2+H2O,该反应
A. 反应物和生成物中都含极性分子和非极性分子
B. 生成1.8gH2O消耗2.24LO2
C. 反应时有极性键和非极性键的断裂和它们的生成
D. 为吸热反应
6. NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温下,pH=9的CH3COONa溶液中,水电离出的数目为10-5NA
B. 1mol K2Cr2O7被还原为Cr3+转移的电子数目为6NA
C. 常温下28g N2中σ键的个数为3NA
D. 1L 0.1mol·L-1 NH4Cl溶液中,的数目为0.1NA
7. 某有机物结构简式如图所示,其中X和Y是第二周期两种相邻的非金属元素,Z元素基态原子的M能层上有3对成对电子。下列说法正确的是
A. 原子半径:Z>Y>X
B. 电负性:X<Y
C. Z的含氧酸酸性均强于碳酸
D. Y氢化物的沸点低于X氢化物的沸点
8. 我国科学家以金属钠和石墨作为电极,在石墨电极通入制备成二次电池,有关该电池,下列说法错误是
A. 放电时发生还原反应 B. 放电时阴离子向Na电极移动
C. 充电时石墨电极与电源负极相连 D. 电解质不能是水溶液
9. 下列说法不正确的是
A. 用加热法可除去Na2CO3中的NaHCO3
B. Na2CO3的热稳定性大于NaHCO3
C. 可用石灰水区分Na2CO3与NaHCO3溶液
D. 小苏打可中和胃酸、热纯碱可除去油污
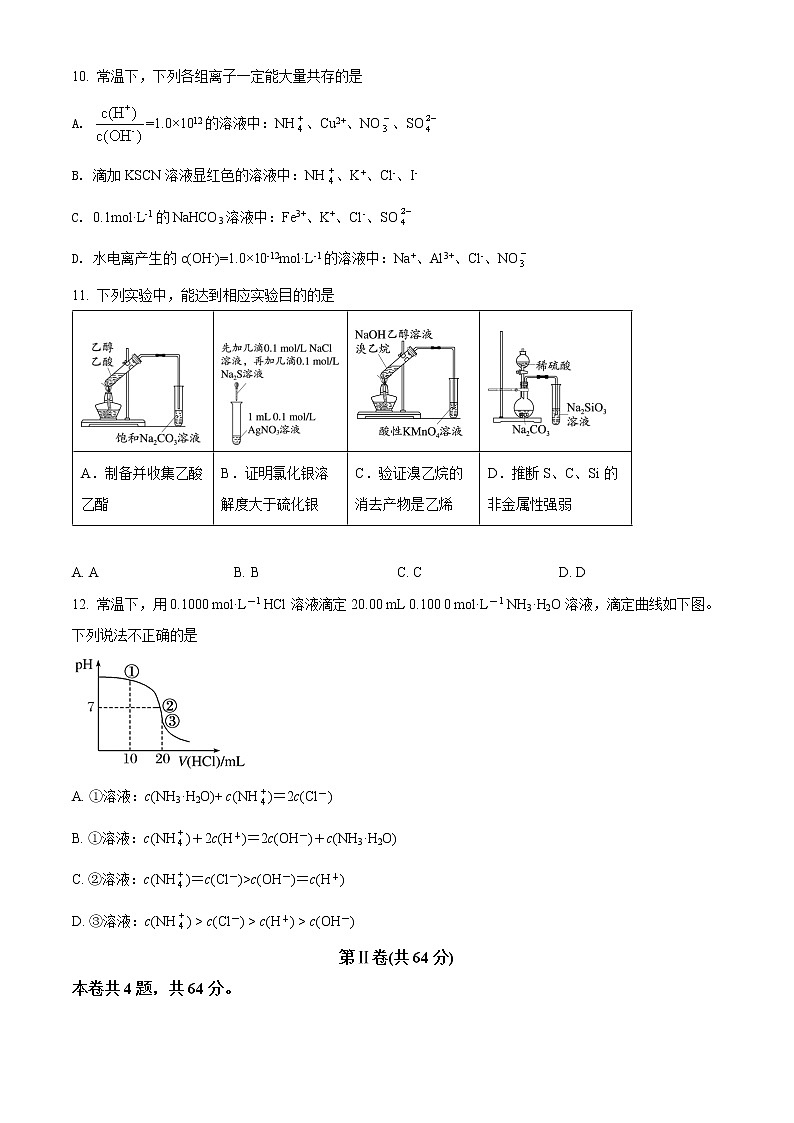
10. 常温下,下列各组离子一定能大量共存的是
A. =1.0×1012的溶液中:NH、Cu2+、NO、SO
B. 滴加KSCN溶液显红色的溶液中:NH、K+、Cl-、I-
C. 0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、Cl-、SO
D. 水电离产生的c(OH-)=1.0×10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO
11. 下列实验中,能达到相应实验目的的是
A.制备并收集乙酸乙酯 | B.证明氯化银溶解度大于硫化银 | C.验证溴乙烷的消去产物是乙烯 | D.推断S、C、Si的非金属性强弱 |
A. A B. B C. C D. D
12. 常温下,用0.1000 mol·L-1 HCl溶液滴定20.00 mL 0.100 0 mol·L-1 NH3·H2O溶液,滴定曲线如下图。下列说法不正确的是
A. ①溶液:c(NH3·H2O)+ c(NH)=2c(Cl-)
B. ①溶液:c(NH)+2c(H+)=2c(OH-)+c(NH3·H2O)
C. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
D. ③溶液:c(NH) > c(Cl-) > c(H+) > c(OH-)
第Ⅱ卷(共64分)
本卷共4题,共64分。
13. GaN凭借其出色的功率性能、频率性能以及散热性能,在光电领域和高频微波器件应用等方面有广阔的前景。
(1)基态Ga原子价电子排布图为_______,基态N原子最高能级的原子轨道形状为_______。
(2)与同族元素B比较,原子序数Ga比B大,第一电离能Ga_______B(填“<”或“>”),理由是_______。
(3)Johnson等人首次在1100℃下用镓与氨气制得氮化镓,该可逆反应每生成放出10.3kJ热量。该反应的热化学方程式是_______(已知金属镓的熔点是29.8℃,沸点是2403℃;氮化镓的熔点为1700℃)。
(4)GaN的一种晶胞结构如图所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的_______(填“正四面体形”或“正八面体形”)空隙。已知GaN的密度为ρ g/cm3,Ga和N的摩尔质量分别为a g/mol和b g/mol,则GaN晶胞的边长为_______pm(列出表达式,设NA表示阿伏加德罗常数的值)。
(5)电解精炼法提纯镓是工业上常用的方法。具体原理如图所示:已知:镓化学性质与铝相似。
M为电源的_______极,电解过程中阳极产生的离子迁移到达阴极并在阴极析出高纯镓。请写出电解过程的阴极的电极反应式_______。
14. 丹参素是一种具有抗菌消炎及增强机体免疫作用的药物。该药物的一种合成路线如下:
已知:Bn-代表苄基( )。
(1)丹参素的分子式为_______,丹参素分子中最多可能有_______个原子共平面。
(2)写出由A生成B的化学方程式_______,反应类型为_______。
(3)C中官能团名称为_______,E中采用杂化碳原子数目_______。
(4)N是C的同系物,相对分子质量比C大14。请写出同时符合下列条件的N的同分异构体的结构简式_______。
①能发生银镜反应;
②苯环上只有2个对位取代基;
③1molN消耗2molNaOH。
(5)设计以苯酚与A为原料制备抗细菌有机物 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)_______。
15. 二草酸合铜(Ⅱ)酸钾晶体,化学式为K2[Cu(C2O4)2]·xH2O,是一种工业化工原料。微溶于冷水和酒精,虽可溶于热水但会慢慢分解,干燥时较为稳定,在150℃时会失去结晶水,260℃以上会分解。
(1)实验室以胆矾和草酸为原料制备二草酸合铜(Ⅱ)酸钾晶体的流程如图甲回答下列问题:(已知:H2C2O4=CO↑+CO2↑+H2O)
①制取KHC2O4溶液过程中,不用KOH粉末代替K2CO3粉末的原因是_______。
②CuO与混合液中的KHC2O4水浴加热时,反应的化学方程式为_______。
③“系列操作”中用酒精洗涤而不用冷水洗涤的优点是_______。
(2)产品纯度的测定
已知:K2[Cu(C2O4)2]·xH2O的摩尔质量为Mg·mol-1。准确称取制得的晶体试样cg于小烧杯中,加入氨水使其溶解,再加入一定量的水,使其全部溶解,然后转移至250mL的容量瓶中,洗涤后加水定容。取试样溶液25.00mL,加入一定量稀硫酸酸化,用amol·L−1的KMnO4标准液滴定,消耗KMnO4标准液bmL
①滴定时,盛装KMnO4标准液的仪器为_______(填“a”或“b”)。
(2)该产品的纯度为_______。
(3)甲酸钠法是制草酸的主要方法,但易产生大量的含铅废水,主要有草酸铅、硫酸铅、草酸等成分。为中和废酸除去铅可采用氢氧化物沉降法。向其中加入NaOH,草酸中离子的有关数据与pH的变化关系如图(数据均为常温下测定):
图中表示lg与pH关系的是_______(填“K”或“L”),曲线m点溶液中,2c(C2O)+c(HC2O)-c(Na+)_______mol·L-1(填计算式),由图可知=_______。若向废水中加入过量的碱会使生成的Pb(OH)2沉淀转化为HPbO,使沉淀物溶解而影响处理效果,写出由Pb(OH)2生成HPbO的离子方程式_______。
16. CO和NO是汽车尾气中的主要污染物,易引起酸雨、温室效应和光化学烟雾等环境污染问题。随着我国机动车保有量的飞速发展,汽车尾气的有效处理变得迫在眉睫。其中的一种方法为2CO(g)+2NO(g)=N2(g)+2CO2(g),请回答下列问题:
(1)已知该反应为自发反应,则该反应反应热ΔH_______0(填“>”或“<”或“=”)。
(2)已知:N2(g) + O2(g)=2NO(g) ΔH= a kJ·mol-1
C(s) + O2(g)=CO2(g) ΔH= b kJ·mol-1
2C(s) + O2(g)=2CO(g) ΔH= c kJ·mol-1
则2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=_______kJ·mol-1 (用含a、b、c的表达式表示)。
(3)一定温度下,将2molCO、4molNO充入一恒压密闭容器。已知起始压强为1MPa,到达平衡时,测得N2的物质的量为0.5mol,则:
①该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=_______MPa-1。
②该条件下,可判断此反应到达平衡的标志是_______。
A.单位时间内,断裂2molC=O同时形成1mol N≡N。
B.混合气体的平均相对分子质量不再改变。
C.混合气体的密度不再改变。
D.CO与NO的转化率比值不再改变。
(4)某研究小组探究催化剂Ⅰ、Ⅱ对CO、NO转化的影响。将和NO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
①由图可知:要达到最大脱氮率,该反应应采取最佳实验条件为_______。
②若低于200℃,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因为_______。
(5)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质A,A是_______,理由是_______。
2024天津市耀华中学高三上学期开学检测化学试题含答案: 这是一份2024天津市耀华中学高三上学期开学检测化学试题含答案,共8页。
2022-2023学年天津市耀华中学高三上学期第三次月考化学试题含解析: 这是一份2022-2023学年天津市耀华中学高三上学期第三次月考化学试题含解析,共23页。试卷主要包含了单选题,结构与性质,有机推断题,实验题,原理综合题等内容,欢迎下载使用。
2023天津市耀华中学高三上学期第二次(11月)月考化学试题含答案: 这是一份2023天津市耀华中学高三上学期第二次(11月)月考化学试题含答案,共11页。试卷主要包含了一种新型合成氨的过程如图所示,某化学反应分两步进行等内容,欢迎下载使用。












