





2023届高中化学一轮复习课件:金属材料及金属矿物的开发利用
展开[高考评价要求]1.结合真实情境中的应用实例或通过实验探究,了解金属材料的主要性质,了解这些物质在生产、生活中的应用。2.结合实例认识金属及其化合物的多样性,了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在促进社会文明进步、自然资源综合利用和环境保护中的重要价值。
考点 镁、铝及其重要化合物
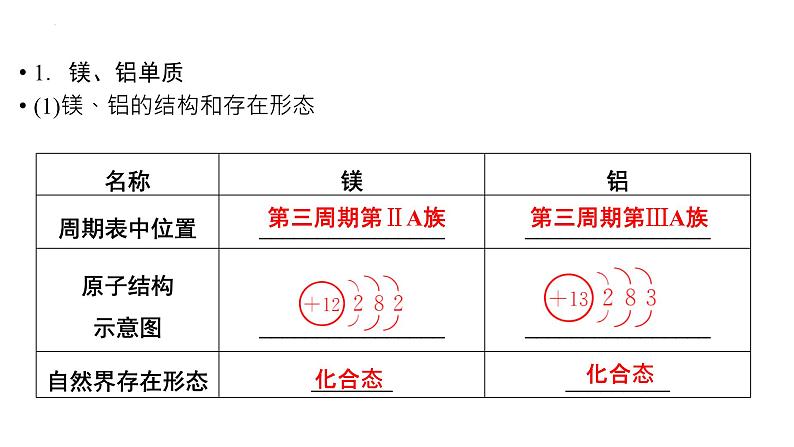
1.镁、铝单质(1)镁、铝的结构和存在形态
(2)金属铝的物理性质铝是银白色、有金属光泽的固体,具有良好的___________、__________和__________等,密度较小,质地柔软。
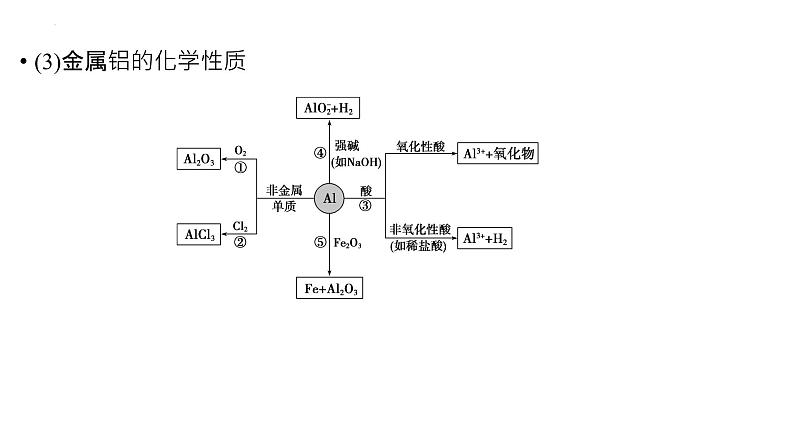
(3)金属铝的化学性质
写出图中有关反应的化学方程式:
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
①镁在二氧化碳中能够燃烧,所以金属镁着火不能用干冰灭火器和泡沫灭火器灭火。②镁也可在氮气中燃烧,生成氮化镁(Mg3N2),氮化镁能与水剧烈反应生成Mg(OH)2并放出NH3。
2.铝的重要化合物(1)氧化铝和氢氧化铝(能写离子方程式的写离子方程式)
Al(OH)3+3H+===Al3++3H2O
(2)常见的铝盐——明矾①明矾的化学式为____________________,属于复盐。②明矾净水的原理:明矾溶于水时发生电离,电离方程式为______________________________ ,其中Al3+发生水解反应,产生____________________,其吸附能力很强,可以吸附水中的悬浮杂质并形成沉淀,使水变得澄清。
KAl(SO4)2·12H2O
既能与酸反应,又能与碱反应的物质(1)金属单质,如Al。(2)两性化合物,如Al2O3、Al(OH)3、氨基酸、蛋白质。(3)多元弱酸的酸式盐,如NaHCO3、KHS、KHSO3等。(4)弱碱弱酸盐,如CH3COONH4、(NH4)2CO3等。
题组一 镁、铝单质的性质1.镁、铝单质的化学性质以相似性为主,但也存在某些较大差异性,下列物质能证明二者存在较大差异性的是( )①CO2 ②盐酸 ③NaOH溶液 ④醋酸A.①④ B.②③C.①③ D.②③④
2.将等物质的量的镁和铝混合,取四份等质量该混合物,分别加入足量的下列溶液,充分反应后,放出氢气最多的是( )A.3 ml·L-1 HCl B.4 ml·L-1 HNO3C.8 ml·L-1 NaOH D.18 ml·L-1 H2SO4
题组二 有关镁、铝的“微流程”3.利用菱镁矿(主要成分MgCO3,含杂质Al2O3、FeCO3)制取镁的工艺流程如图,下列说法正确的是( )A.“酸浸”时溶液中有电子转移B.“氧化”时用稀硝酸代替更好C.沉淀混合物为Al(OH)3和Fe(OH)3D.电解MgCl2溶液可得到金属镁
考点 铜及其重要化合物
1.铜单质(1)物理性质:________色固体,具有导电性、导热性和延展性,不能被磁体吸引。
2Cu+O2+CO2+H2O===Cu2(OH)2CO3
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
Cu+2AgNO3===Cu(NO3)2+2Ag
Cu+2FeCl3===CuCl2+2FeCl2
①铜为变价金属,与Cl2反应生成CuCl2,与S反应生成Cu2S,由此可知氧化性:Cl2>S。②Cu与稀硫酸不反应,但在通入O2的条件下,Cu可在稀硫酸中逐渐溶解:2Cu+O2+2H2SO4===2CuSO4+2H2O。
CuO+2H+===Cu2++H2O
3.氢氧化铜(1)物理性质:蓝色不溶于水的固体。(2)化学性质及应用反应①的化学方程式:____________________________。反应②的离子方程式:___________________________________。
Cu(OH)2+2H+===Cu2++2H2O
4.铜盐(1)碱式碳酸铜碱式碳酸铜的化学式为______________,是铜绿的成分,是铜在潮湿的空气中被锈蚀的结果,其受热分解的化学方程式为_________________________________________。
Cu2(OH)2CO3
(2)硫酸铜①CuSO4·5H2O为蓝色晶体,俗称_______或_______。②无水CuSO4为白色粉末,遇水变_______色(生成CuSO4·5H2O)。
①无水CuSO4能用作检验水的试剂,不能作为水蒸气的吸收试剂用于除杂或干燥。②铜盐溶液有毒,具有杀菌作用,这是因为Cu2+是一种重金属离子,能使蛋白质变性而失去生理活性。
2.(2022·江淮十校高三联考)某研究小组通过实验探究Cu及其重要化合物的性质,操作正确且能达到目的的是( )A.将铜丝插入浓硫酸中加热,反应完后把水加入反应器中,观察硫酸铜溶液的颜色B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体D.将表面有铜绿的铜器放入稀盐酸中浸泡,除去铜绿
题组二 铜及其化合物的制备3.实验室用含有少量氧化铁杂质的废铜粉制取无水硫酸铜的实验步骤如图所示:下列有关说法正确的是( )A.溶解废铜粉的“过量酸”指稀硝酸B.气体A是Cl2,将亚铁离子氧化为铁离子C.生成沉淀D的离子方程式可以为3CuO+2Fe3++3H2O===2Fe(OH)3↓+3Cu2+D.从溶液中得到无水硫酸铜的方法是冷却结晶
4.(双选)某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产CuCl2·2H2O晶体的工艺流程如图所示:下列说法正确的是( )A.焙烧过程中每消耗1 ml CuS则消耗3 ml O2B.焙烧后的废气能使酸性高锰酸钾溶液褪色C.滤渣中主要含铁的氢氧化物D.将获得的CuCl2·2H2O晶体直接加热可制得CuCl2固体
考点 金属材料及金属矿物的开发利用
①合金的物理性质相比于其成分金属有所改变,但合金中各成分金属的化学性质不变。②并非所有的金属都能形成合金,若一种金属的熔点大于另一种金属的沸点,则二者不能形成合金。
2.常见金属材料(1)金属材料包括_________________________。日常使用的金属材料,大多数属于_______。
3.金属矿物的开发利用(1)金属在自然界中的存在形态
(2)金属冶炼的实质:把金属从化合态还原为游离态。
①工业上用电解熔融Al2O3的方法冶炼铝,而不能用电解熔融AlCl3的方法,这是因为AlCl3为共价化合物,熔融时不导电。②工业上用电解熔融MgCl2的方法冶炼镁,而不用电解熔融MgO的方法,这是因为MgO的熔点高,熔融时耗费更多能源,增加生产成本,而MgCl2的熔点较低,更易熔融。
题组一 金属材料及其应用1.金属材料在日常生活以及生产中有着广泛的应用。下列关于金属材料的说法不正确的是( )A.合金的性质与其成分金属的性质不完全相同B.锈蚀后的铁制品没有回收价值C.金属冶炼的本质是金属阳离子得到电子变成金属原子D.越活泼的金属越难冶炼
2.下列关于新型合金材料的说法不正确的是( )A.镧镍合金能大量吸收H2形成金属氢化物,可作为储氢材料B.钛合金生物相容性好、强度大,可作为人造骨骼C.形状记忆合金可在使合金发生形变的作用力消失后恢复原状D.利用合金的熔点低于其成分金属的熔点这一特点可制得耐热合金
3.下列说法错误的是( )A.制饭勺、饭盒、高压锅等的不锈钢不是合金B.商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品C.铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业D.铝合金可大量用于高铁建设
题组二 金属冶炼方法的选择4.下列制备金属单质的方法或原理正确的是( )A.在高温条件下,用H2还原MgO制备单质MgB.在通电条件下,电解熔融Al2O3制备单质AlC.工业上金属Mg、Cu都是用热还原法制得的D.加强热,使CuO在高温条件下分解制备单质Cu
5.(双选)不同的金属在冶炼方法上也有所不同。下列说法正确的是( )A.钒、铬、锰等难熔金属通常采用铝热反应冶炼B.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单C.由于钠、镁、铝等金属化学性质太活泼,人们通常采用电解熔融状态下的氯化物的方式来获取它们的单质D.炼铁时加入的焦炭除了用来制造还原剂一氧化碳外,还提供热量
①钢铁是铁和碳的合金;②生铁和熟铁都属于合金。生铁含碳量为2%~4.3%,较熟铁硬度大、脆性强;③钢的含碳量介于生铁与熟铁之间,钢也属于铁碳合金。生铁先熔化,说明其熔点低于熟铁;④主要有赤铁矿(Fe2O3)和磁铁矿(Fe3O4)。
化学学科探索历史值得重视。本题以历史文献资料“灌钢法”设置情境,说明了化学对人类文明的伟大贡献。利用传统文化情境,不仅考查了合金的概念和性能、铁的冶炼等方面的知识,还能够培养将化学成果应用于生产、生活的意识。命题立意中华传统文化,厚植爱国主义情怀,激发考生为中华民族奋斗的责任感和使命感。
1.明末科学家宋应星出版的《天工开物》中记载了有关“五金”的内容:“……黄金美者,其值去黑铁(生铁)一万六千倍,然使釜、鬵(xín,一种炊具)、斤(这里指菜刀、镰刀、锄头等)、斧不呈效于日用之间……贸迁有无……”下列解释正确的是( )A.明代使用的釜、鬵一类的炊具都属于青铜合金B.添加了铬、镍的不锈钢菜刀和农具使用后即使不保养,也不会生锈C.金属的另一个用途就是铸成钱币作为贸易交往中的流通手段D.黑铁在空气中发生的腐蚀主要是化学腐蚀
2.(2022·抚州、赣州六校联考)《考工记》:金(青铜)有六齐,六分其金而锡居一,谓之钟鼎之齐;五分其金而锡居一,谓之斧斤之齐;四分其金而锡居一,谓之戈戟之齐;三分其金而锡居一,谓之大刃之齐;五分其金而锡居二,谓之削杀矢之齐;金锡半,谓之鉴燧之齐。下列有关说法错误的是( )A.六齐是铜锡合金6种配比B.大刃的硬度大于斧斤的硬度C.六齐之金,日久也会有铜绿生成D.依据铜锡不同比例可以配成黄铜
2.(2021·新高考湖北卷)“乌铜走银”是我国非物质文化遗产之一。该工艺将部分氧化的银丝镶嵌于铜器表面,艺人用手边捂边揉搓铜器,铜表面逐渐变黑,银丝变得银光闪闪。下列叙述错误的是( )A.铜的金属活动性大于银B.通过揉搓可提供电解质溶液C.银丝可长时间保持光亮D.用铝丝代替银丝铜也会变黑
3.(2020·浙江1月选考)下列关于铝及其化合物的说法,不正确的是( )A.明矾可用作净水剂和消毒剂B.利用铝热反应可冶炼高熔点金属C.铝可用作包装材料和建筑材料D.氢氧化铝可用作治疗胃酸过多的药物
4.铜是人类发现最早并广泛使用的一种金属。回答下列问题:(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为_________________________________________。(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式:_____________________________________。配制的FeCl3溶液应保持________(填“酸性”“碱性”或“中性”),原因是_________________________。
Cu+H2O2+H2SO4===CuSO4+2H2O
Cu+2Fe3+===Cu2++2Fe2+
防止Fe3+水解生成Fe(OH)3
2024届高三化学高考备考一轮复习专题:金属材料和金属矿物的开发利用课件: 这是一份2024届高三化学高考备考一轮复习专题:金属材料和金属矿物的开发利用课件,共49页。PPT课件主要包含了第ⅡA,第ⅢA,延展性,导电性,铝的重要化合物,AlOH3胶体,铜单质,2化学性质,商朝的政治制度,氧化铜和氧化亚铜等内容,欢迎下载使用。
2024届高考化学一轮复习课件 第三章 金属及金属材料 第3讲 金属材料 金属矿物的开发利用: 这是一份2024届高考化学一轮复习课件 第三章 金属及金属材料 第3讲 金属材料 金属矿物的开发利用,文件包含第3讲金属材料金属矿物的开发利用pptx、第3讲金属材料金属矿物的开发利用docx、第3讲金属材料金属矿物的开发利用课后作业docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
2020版高考化学一轮复习考点备考课件3.4.2金属材料与金属矿物的开发利用 (含解析): 这是一份2020版高考化学一轮复习考点备考课件3.4.2金属材料与金属矿物的开发利用 (含解析),共9页。PPT课件主要包含了速查速测,碳合金,离子放电顺序比较,典例剖析,应该用热还原法制备,乙醇被氧化为乙酸,反思归纳,试题备选等内容,欢迎下载使用。












