


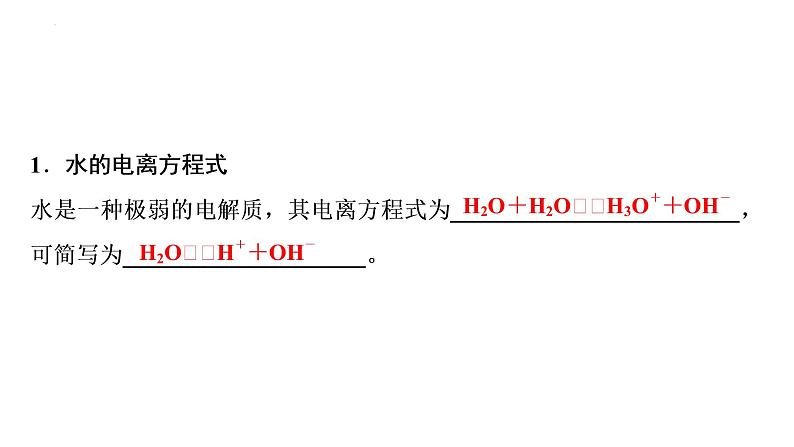


2023届高中化学一轮复习课件:水的电离和溶液的pH
展开高考评价要求1.认识水的电离,了解水的离子积常数,认识溶液的酸碱性及pH,掌握检测溶液pH的方法。2.能进行溶液pH的简单计算,能正确测定溶液pH,能调控溶液的酸碱性。能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
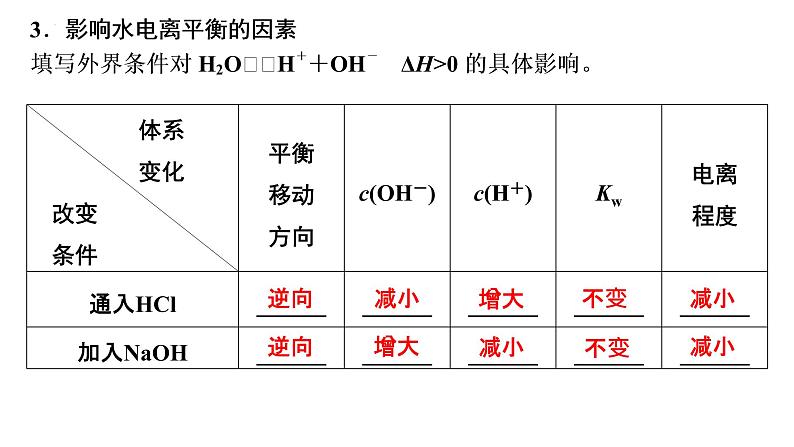
2.水的离子积常数(1)常温下:Kw=c(H+)·c(OH-)=____________。(2)影响因素:只与_______有关,升高温度,Kw_______。(3)适用范围:Kw不仅适用于纯水,也适用于稀的_________溶液。(4)Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw就不变。
题组二 水电离出的c(H+)和c(OH-)的计算3.(2022·湘潭一中模拟)在25 ℃时,某稀溶液中由水电离产生的H+浓度为1×10-13ml·L-1,下列有关该溶液的叙述正确的是( )A.该溶液可能呈酸性B.该溶液一定呈碱性C.该溶液的pH一定是1D.该溶液的pH不可能为13
4.25 ℃时,在等体积的①pH=0的H2SO4溶液、②0.05 ml·L-1的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5 的NH4NO3溶液中,发生电离的水的物质的量之比是( )A.1∶10∶1010∶109B.1∶5∶(5×109)∶(5×108)C.1∶20∶1010∶109D.1∶10∶104∶109
水电离出的c水(H+)或c水(OH-)的相关计算(1)当抑制水的电离时(如酸或碱溶液)在溶液中c(H+)、c(OH-)较小的数值是水电离出的。具体见下表:
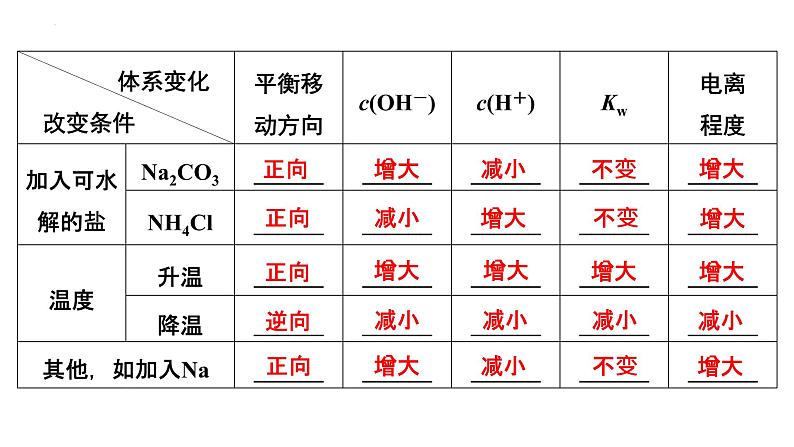
(2)当促进水的电离时(如盐的水解)在溶液中c(H+)、c(OH-)较大的数值是水电离出的。具体见下表:
考点 溶液的酸碱性与pH
1.溶液的酸碱性溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。(1)c(H+)____c(OH-),溶液呈酸性,常温下pH____7。(2)c(H+) ____c(OH-),溶液呈中性,常温下pH____7。(3)c(H+) ____c(OH-),溶液呈碱性,常温下pH____7。
2.pH及其测量(1)定义式:pH=-lg c(H+)。(2)溶液的酸碱性与pH的关系(常温下)
(3)测量方法①pH试纸法:把小片pH试纸放在一洁净的玻璃片或表面皿上,用________蘸取待测溶液点在干燥的pH试纸中央,试纸变色后,与____________对照即可确定溶液的pH。②pH计测量法。
①只有在常温下,pH=7的溶液为中性溶液,但c(H+)=c(OH-)在任何温度下都表示中性溶液。②pH试纸使用前不能用蒸馏水润湿,否则待测溶液因被稀释可能产生误差。广泛pH试纸只能测出整数值。
(4)酸碱溶液稀释时pH的变化
题组一 溶液酸碱性的判断1.判断溶液的酸碱性有多种方法。下列溶液中,一定呈碱性的是( )A.能够使甲基橙呈现黄色的溶液B.溶液的pH>7C.溶液中:c(H+)<c(OH-)D.溶液中:c(H+)>1×10-7 ml·L-1
2.判断常温下,两种溶液混合后溶液的酸碱性(填“酸性”“碱性”或“中性”)。(1)相同浓度的HCl和NaOH溶液等体积混合:________。(2)相同浓度的CH3COOH和NaOH溶液等体积混合:________。(3)相同浓度的NH3·H2O和HCl溶液等体积混合:________。 (4)pH=2的HCl和pH=12的NaOH溶液等体积混合:________。(5)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合:________。(6)pH=2的HCl和pH=12的NH3·H2O溶液等体积混合:________。
题组二 pH的计算3.已知在t ℃时水的离子积Kw=1×10-12。下列溶液的温度均为t ℃,其中说法正确的是( )A.0.005 ml·L-1的H2SO4溶液,pH=2B.0.001 ml·L-1的NaOH溶液,pH=11C.0.005 ml·L-1的H2SO4溶液与0.01 ml·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性D.完全中和pH=3的H2SO4溶液50 mL,需要pH=9的NaOH溶液100 mL
4.在某温度时,测得0.01 ml·L-1NaOH溶液的pH为11。(1)该温度下水的离子积常数Kw=________。
5.计算常温时下列溶液的pH (忽略溶液混合时体积的变化):(1)pH=2的盐酸与等体积的水混合。(2)pH=2的盐酸加水稀释1 000倍。(3)0.1 ml·L-1的CH3COOH溶液(已知CH3COOH的电离常数Ka=1.8×10-5)。(4)0.1 ml·L-1NH3·H2O溶液(NH3·H2O的电离度α=1%)。(5)将0.1 ml·L-1氢氧化钠溶液与0.06 ml·L-1硫酸溶液等体积混合。
答案: (1)2.3 (2)5 (3)2.9 (4)11 (5)2
7.常温下,已知H3PO3溶液中含磷物种的浓度之和为0.1 ml·L-1,溶液中各含磷物种的pc—pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=-lg c),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是( )
1.实验原理(1)用已知浓度的酸(或碱)滴定未知浓度的碱(或酸),根据中和反应的等量关系来测定酸(或碱)的浓度。
酸碱恰好完全反应,与反应至中性的说法不同,酸碱恰好完全反应所得溶液不一定呈中性,溶液的酸碱性取决于所得盐的特点。反应至中性,酸碱不一定恰好完全反应。
(2)利用酸碱指示剂明显的颜色变化,表示反应已完全,指示滴定终点。2.实验用品(1)仪器:______滴定管(如图A)、______滴定管(如图B)、滴定管夹、铁架台、烧杯、________。
(2)试剂:标准液、待测液、指示剂、蒸馏水。(3)滴定管的选择
3.实验操作(以标准盐酸滴定待测NaOH溶液为例)(1)滴定前的准备
(2)滴定操作(3)终点判断当______________________________________________________________________________,表示已经达到滴定终点,记录标准液的体积。
滴入最后半滴标准液,溶液由粉红色变为无色,且在半分钟内不恢复
5.拓展应用——氧化还原滴定(1)原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质,或者间接滴定一些本身并没有还原性或氧化性,但能与某些还原剂或氧化剂反应的物质。(2)试剂:常见用于滴定的氧化剂有KMnO4、K2Cr2O7等;常见用于滴定的还原剂有亚铁盐、草酸、维生素C、Na2S2O3等。
(3)三类氧化还原滴定的指示剂①氧化还原指示剂。②专用指示剂,如在碘量法滴定中,可溶性淀粉溶液遇碘单质变蓝。③自身指示剂,如酸性高锰酸钾标准溶液滴定草酸时,滴定终点颜色变化为溶液由无色变为粉红色。
题组一 酸碱中和滴定中仪器、指示剂的选择及实验操作1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,下表中正确的选项是( )
选择指示剂的基本原则变色要灵敏,变色范围要小,使变色范围尽量与滴定终点溶液的酸碱性一致。酸碱指示剂的变色范围如下:
(1)石蕊变色范围较大,且在滴定终点时颜色的变化不易观察,故一般不选用石蕊作为酸碱中和滴定的指示剂。(2)滴定终点为碱性时,用酚酞作为指示剂,如用NaOH溶液滴定醋酸溶液。(3)滴定终点为酸性时,用甲基橙作为指示剂,如用盐酸滴定氨水。(4)强酸滴定强碱一般用甲基橙,但用酚酞也可以。(5)指示剂的用量不宜太多,一般为2~3滴。
2.某研究小组为测定食用白醋中醋酸的含量进行如下操作,正确的是( )A.用碱式滴定管量取一定体积的待测白醋放入锥形瓶中B.称取4.0 g NaOH,放入100 mL容量瓶中,加水至刻度线,配成1.00 ml·L-1 NaOH标准溶液C.用NaOH溶液滴定白醋,使用酚酞为指示剂,当溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点D.滴定时眼睛要注视滴定管内NaOH溶液的液面变化,防止滴定过量
题组二 酸碱中和滴定的误差分析及数据处理3.用0.01 ml·L-1盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是( )①用量筒量取浓盐酸配制0.01 ml·L-1稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸②配制稀盐酸定容时,俯视容量瓶刻度线③滴定结束时,读数后发现滴定管下端尖嘴处悬挂有一滴液滴④滴定过程中用少量蒸馏水将锥形瓶内壁附着的盐酸冲下A.①③ B.②④ C.②③④ D.①②③④
4. 室温下,某一元弱酸HA的电离常数Ka=1.6×10-6。 向20.00 mL浓度约为0.1 ml·L-1 HA溶液中逐滴加入0.100 0 ml·L-1的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题(已知lg 4=0.6):(1)a点溶液中pH约为________,此时溶液中由H2O电离出的c(H+)为___________________。
2.5×10-11 ml·L-1
(2)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用________作为指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(3)滴定过程中部分操作如下,下列各操作使测量结果偏高的是________(填字母)。A.滴定前碱式滴定管未用标准NaOH溶液润洗B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定C.滴定过程中,溶液出现变色后,立即停止滴定D.滴定结束后,仰视液面,读取NaOH溶液体积
(4)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为________ml·L-1。
常用量器的读数方法(1)平视读数(如图1):实验室中用量筒或滴定管量取一定体积的液体;读取液体体积时,视线应与凹液面最低点保持水平,视线与刻度的交点即为读数(即凹液面定视线,视线定读数)。
(2)俯视读数(如图2):当用量筒量取液体的体积时,由于俯视视线向下倾斜,寻找切点的位置在凹液面的上侧,读数高于正确的刻度线位置,即读数偏大。(3)仰视读数(如图3):读数时,由于视线向上倾斜,寻找切点的位置在凹液面的下侧,读数低于正确的刻度线位置;因滴定管刻度标法与量筒不同,仰视读数时,读取体积偏大。
题组三 滴定曲线的图像分析5. 如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线。下列叙述正确的是( )A.盐酸的物质的量浓度为1 ml/LB.P点时反应恰好完全,溶液呈中性C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线D.酚酞不能用作本实验的指示剂
6.(2022·深圳高三模拟)常温下,用0.10 ml·L-1 NaOH溶液分别滴定20.00 mL 0.10 ml·L-1 HCl溶液和20.00 mL 0.10 ml·L-1 CH3COOH溶液,得到两条滴定曲线,如图所示,则下列说法正确的是( )A.图2是滴定盐酸的曲线B.a与b的关系是a<bC.E点对应离子浓度由大到小的顺序可能为 c(CH3COO-)>c(Na+)>c(H+)>c(OH-)D.这两次滴定都可以用甲基橙作为指示剂
1.室温下,向20.00 mL 0.100 0 ml·L-1盐酸中滴加0.100 0 ml·L-1NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg 5=0.7。下列说法不正确的是( )A.NaOH与盐酸恰好完全反应时,pH=7B.选择变色范围在pH突变范围内的指示剂,可减小实验误差C.选择甲基红指示反应终点,误差比甲基橙的大D.V(NaOH)=30.00 mL时,pH=12.3
2.下列说法不正确的是( )A.2.0×10-7 ml·L-1的盐酸中c(H+)=2.0×10-7 ml·L-1B.将KCl溶液从常温加热至80 ℃,溶液的pH变小但仍保持中性C.常温下,NaCN溶液呈碱性,说明HCN是弱电解质D.常温下,pH为3的醋酸溶液中加入醋酸钠固体,溶液pH增大
3.碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量,过程如下:步骤Ⅰ.Na2CO3的制备
步骤Ⅱ.产品中NaHCO3含量测定①称取产品2.500 g,用蒸馏水溶解,定容于250 mL容量瓶中;②移取25.00 mL上述溶液于锥形瓶,加入2滴指示剂M,用0.100 0 ml·L-1盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸V1 mL;③在上述锥形瓶中再加入2滴指示剂N,继续用 0.100 0 ml·L-1 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸V2 mL;
回答下列问题:(1)步骤Ⅰ中晶体A的化学式为__________,晶体A能够析出的原因是________________________________________________________________。
30~35 ℃,NaHCO3的溶解度小于NaCl、NH4HCO3和NH4Cl的溶解度
(2)步骤Ⅰ中“300 ℃加热”所选用的仪器是__________________(填标号)。
2023届高三化学一轮复习 水的电离和溶液的pH 课件: 这是一份2023届高三化学一轮复习 水的电离和溶液的pH 课件,共30页。PPT课件主要包含了影响因素,不移动,溶液的酸碱性,溶液的pH,pH的测定方法,1酸碱指示剂法,2pH试纸法,使用方法,3pH计法,单一溶液等内容,欢迎下载使用。
2023届高三化学高考备考一轮复习 水的电离和溶液的pH课件: 这是一份2023届高三化学高考备考一轮复习 水的电离和溶液的pH课件,共40页。PPT课件主要包含了水的电离,归纳总结,溶液的酸碱性和pH等内容,欢迎下载使用。
人教版高考化学一轮复习8.2水的电离和溶液的ph课件: 这是一份人教版高考化学一轮复习8.2水的电离和溶液的ph课件












