
2023版新教材高考化学微专题小练习专练28电解池原理及应用
展开一、单项选择题
1.[2022·广东卷]以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中( )
A.阴极发生的反应为Mg-2e-===Mg2+
B. 阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
2.[2022·全国乙卷]LiO2电池比能量高,在汽车、航天等领域具有良好应用前景。近年来,科学家研究了一种光照充电LiO2电池(如图所示)。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h+===2Li++O2)对电池进行充电。下列叙述错误的是 ( )
A.充电时,电池的总反应Li2O2===2Li+O2
B.充电效率与光照产生的电子和空穴量有关
C.放电时,Li+从正极穿过离子交换膜向负极迁移
D.放电时,正极发生反应
O2+2Li++2e-===Li2O2
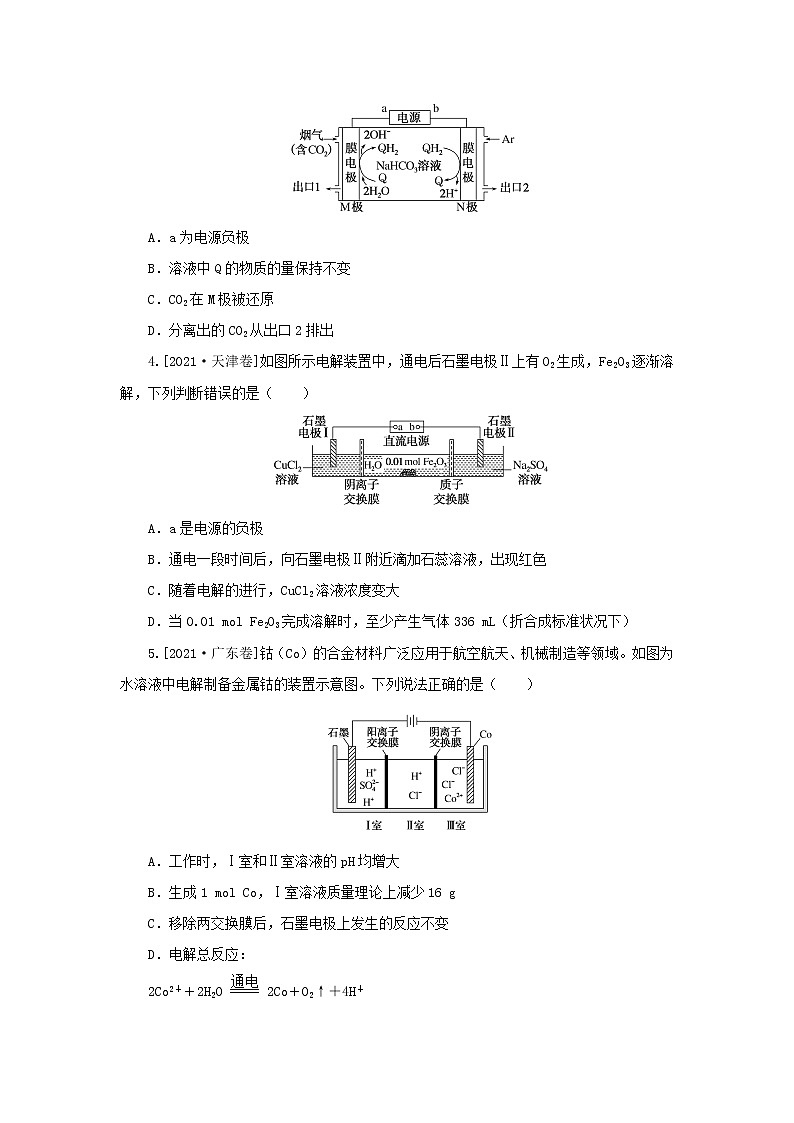
3.[2021·辽宁卷]利用(Q)与(QH2)电解转化法从烟气中分离CO2的原理如图。已知气体可选择性通过膜电极,溶液不能通过。下列说法错误的是( )
A.a为电源负极
B.溶液中Q的物质的量保持不变
C.CO2在M极被还原
D.分离出的CO2从出口2排出
4.[2021·天津卷]如图所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是( )
A.a是电源的负极
B.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色
C.随着电解的进行,CuCl2溶液浓度变大
D.当0.01 ml Fe2O3完成溶解时,至少产生气体336 mL(折合成标准状况下)
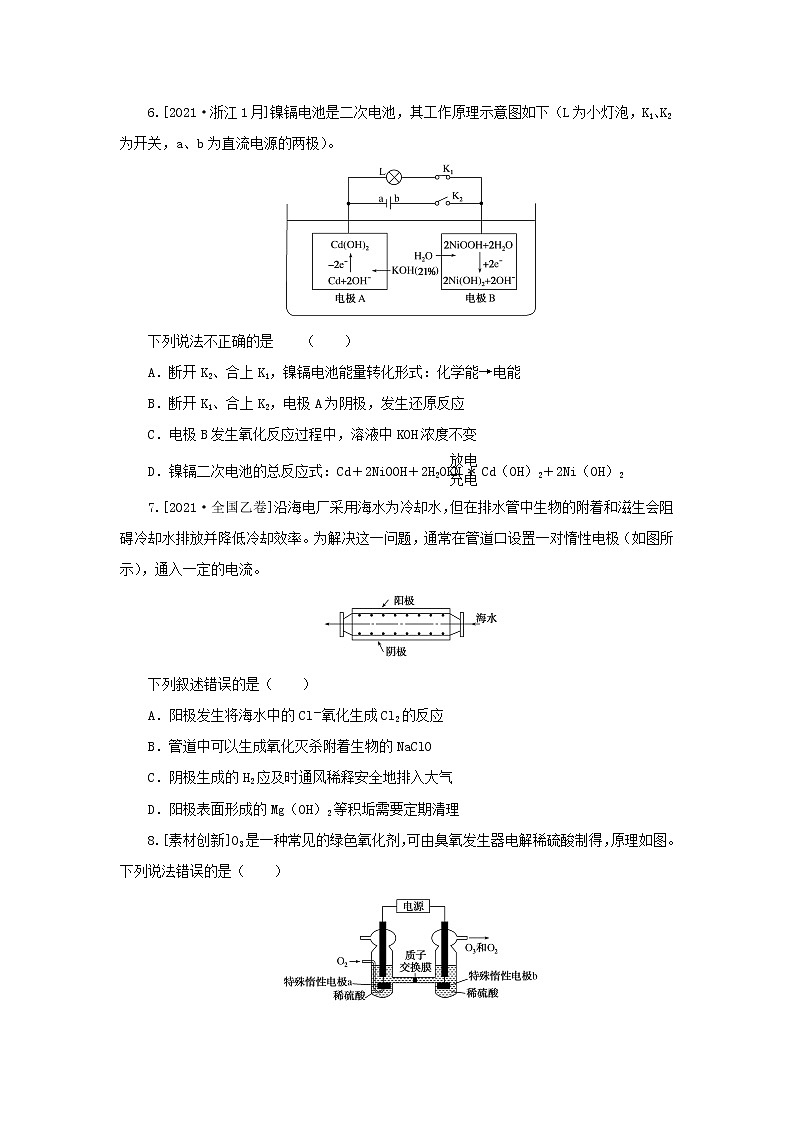
5.[2021·广东卷]钴(C)的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是( )
A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大
B.生成1 ml C,Ⅰ室溶液质量理论上减少16 g
C.移除两交换膜后,石墨电极上发生的反应不变
D.电解总反应:
2C2++2H2O eq \(=====,\s\up7(通电)) 2C+O2↑+4H+
6.[2021·浙江1月]镍镉电池是二次电池,其工作原理示意图如下(L为小灯泡,K1、K2为开关,a、b为直流电源的两极)。
下列说法不正确的是 ( )
A.断开K2、合上K1,镍镉电池能量转化形式:化学能→电能
B.断开K1、合上K2,电极A为阴极,发生还原反应
C.电极B发生氧化反应过程中,溶液中KOH浓度不变
D.镍镉二次电池的总反应式:Cd+2NiOOH+2H2O eq \(KN*,\s\up11(放电),\s\d4(充电)) Cd(OH)2+2Ni(OH)2
7.[2021·全国乙卷]沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是( )
A.阳极发生将海水中的Cl-氧化生成Cl2的反应
B.管道中可以生成氧化灭杀附着生物的NaClO
C.阴极生成的H2应及时通风稀释安全地排入大气
D.阳极表面形成的Mg(OH)2等积垢需要定期清理
8.[素材创新]O3是一种常见的绿色氧化剂,可由臭氧发生器电解稀硫酸制得,原理如图。下列说法错误的是( )
A.电极a为阴极
B.a极的电极反应式为
O2+4H++4e-===2H2O
C.电解一段时间后b极周围溶液的pH下降
D.标准状况下,当有5.6 L O2反应时,收集到O2和O3混合气体4.48 L, O3的体积分数为80%
9.[情境创新]双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HCl,其工作原理如图所示,M、N为离子交换膜。下列说法不正确的是( )
A.相同条件下,不考虑气体溶解,阴极得到气体体积是阳极两倍
B.电解过程中Na+向左迁移,N为阴离子交换膜
C.若去掉双极膜(BPM),阳极室会有Cl2生成
D.电解结束后,阴极附近溶液酸性明显增强
10.在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
A.X是电源负极
B.阴极的电极反应式是H2O+2e-===H2+O2-,CO2+2e-===CO+O2-
C.总反应可表示为
H2O+CO2 eq \(=====,\s\up7(通电)) H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1∶1
二、不定项选择题
11.利用如图所示装置模拟电解原理在工业生产中的应用。下列说法正确的是( )
A.氯碱工业中,X电极上的反应式是4OH--4e-===2H2O+O2↑
B.电解精炼铜时,Z溶液中的Cu2+浓度变小
C.在铁片上镀铜时,Y是纯铜
D.制取金属镁时,Z是熔融的氯化镁
12.[2021·全国甲卷]乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是( )
A.KBr在上述电化学合成过程中只起电解质的作用
B.阳极上的反应式为:+2H++2e-―→+H2O
C.制得2 ml乙醛酸,理论上外电路中迁移了1 ml 电子
D.双极膜中间层中的H+在外电场作用下向铅电极方向迁移
13.[2022·山西平遥高三测试]电解尿素[CO(NH2)2]的碱性溶液制氢气的装置如图所示。下列说法错误的是( )
A.为增强导电性,可用金属铜作阳极
B.电解过程中阴、阳极产生的气体的物质的量之比为1∶3
C.阴极的电极反应式为
2H2O+2e-===H2↑+2OH-
D.阳极的电极反应式为CO(NH2)2-6e-+8OH-===CO eq \\al(\s\up11(2-),\s\d4(3)) +N2↑+6H2O
14.[2022·四川威远中学月考]高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是( )
A.铁是阳极,电极反应为
Fe-2e-+2OH-===Fe(OH)2↓
B.电解一段时间后,镍电极附近溶液的pH减小
C.每制得1 ml Na2FeO4,理论上可以产生67.2 L气体
D.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO eq \\al(\s\up11(2-),\s\d4(4))
[HT]三、非选择题[HT]
15.Ⅰ.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。离子交换膜法电解食盐水的装置如图所示,图中的离子交换膜只允许阳离子通过。
(1)A为____________极,X、Y分别是__________、______________。`
(2)离子交换膜的作用是_______________________________________________、______________________________________________________________________。`
(3)a、b、c、d加入或取出的物质分别是________________、___________________、___________________、___________________。
Ⅱ.实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2。
电解时的阴极反应式为___________________,阳极反应式为___________________,电解时发生反应的化学方程式为
________________________________________________________________________。`
专练33 电解池原理及应用
1.C 阴极得电子,发生还原反应,被还原,A项、B项错误;由金属活动性顺序可知,Mg、Al在阳极失电子,离子进入电解液,Cu金属活动性弱,则阳极泥主要含Si、Cu,C项正确;阴极Al3+得电子生成Al单质,阳极上Mg、Al均失电子变成离子进入电解液中,故阳极和阴极的质量变化不相等,D项错误。
2.C 根据题给电池装置图并结合阴、阳极电极反应可知,充电时,电池的总反应为Li2O2===2Li+O2,A项正确;由题干中光照时阴、阳极反应可知,充电效率与光照产生的电子和空穴量有关,B项正确;放电时题给装置为原电池,阳离子(Li+)向正极迁移,C项错误;根据题给装置图可知,放电时正极上O2得电子并与Li+结合生成Li2O2,即O2+2Li++2e-===Li2O2,D项正确。
3.C 根据电解池工作原理示意图,可知M极发生还原反应,电极反应式为Q+2H2O+2e-===QH2+2OH-,则M极为阴极,a为电源负极,A正确;N极发生氧化反应,电极反应式为QH2-2e-===Q+2H+,由上述分析可知,溶液中Q的物质的量保持不变,B正确;结合题意和电极反应式可知,CO2没有参与电极反应,CO2在M极没有被还原,C错误;烟气中含有的CO2在M极上与生成的OH-结合生成的HCO eq \\al(\s\up11(-),\s\d4(3)) ,HCO eq \\al(\s\up11(-),\s\d4(3)) 向阳极移动,在N极上与生成的H+结合又生成CO2,故分离出的CO2从出口2排出,D正确。
4.C 由通电后石墨电极Ⅱ上有O2生成可知此电极发生氧化反应:2H2O-4e-===4H++O2↑,则石墨电极Ⅱ为阳极,b为电源正极,a为电源负极,A正确;石墨电极Ⅱ上发生放氧生酸的反应,通电一段时间后,石墨电极Ⅱ附近的溶液显酸性,滴加石蕊溶液出现红色,B正确;石墨电极Ⅰ上Cu2+放电:Cu2++2e-===Cu,Cu2+被还原为单质Cu,CuCl2溶液中Cu2+浓度逐渐减小,在电解池中,阴离子移向阳极,Cl-通过阴离子交换膜移向中间室,CuCl2溶液中Cl-浓度逐渐减小,则随着电解的进行,CuCl2溶液浓度变小,C错误;阳极附近产生的H+穿过质子交换膜与Fe2O3反应,存在反应关系:Fe2O3~6H+~1.5O2,当0.01 ml Fe2O3完全溶解时,产生0.015 ml O2,折合标准状况下,生成气体的体积为336 mL,D正确。
5.D 石墨电极为阳极,电极反应式为2H2O-4e-===O2↑+4H+,H+通过阳离子交换膜由Ⅰ室进入Ⅱ室,右侧C电极为阴极,电极反应式为C2++2e-===C,Cl-通过阴离子交换膜由Ⅲ室进入Ⅱ室,与H+结合生成盐酸。由上述分析知,Ⅰ室中水放电使硫酸浓度增大,Ⅱ室中生成盐酸,故Ⅰ室和Ⅱ室溶液的pH均减小,A错误;生成1 ml C时,转移2 ml电子,Ⅰ室有0.5 ml O2(即16 g)逸出,有2 ml(即2 g) H+通过阳离子交换膜进入Ⅱ室,则Ⅰ室溶液质量理论上减少18 g,B错误;移除两交换膜后,石墨电极上的电极反应为2Cl--2e-===Cl2↑,C错误;根据上述分析可知,电解时生成了O2、C、H+,则电解总反应为2C2++2H2O eq \(=====,\s\up7(通电)) 2C+O2↑+4H+,D正确。
6.C 断开K2、合上K1,发生的是原电池反应,所以能量转化形式为化学能→电能,A说法正确;断开K1、合上K2,发生的是电解池反应,电极A与电源负极相连,为阴极,阴极发生还原反应,B说法正确;当发生电解反应时,电极B是阳极,发生氧化反应,电极反应式为2Ni(OH)2+2OH--2e-===2NiOOH+2H2O,根据电极反应式可知溶液中KOH浓度降低,C说法错误;根据题给装置图中物质的变化过程可得总反应式为Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2,D说法正确。
7.D 海水中含有较大浓度的Cl-,通电后Cl-能在阳极上发生失电子的氧化反应生成Cl2,A项正确;电解过程中阴极区有NaOH生成,阳极上生成的Cl2与阴极区生成的NaOH反应可得到NaClO,B项正确;H2具有可燃性,故应及时排入大气,以免出现意外,C项正确;阴极的电极反应式为2H2O+2e-===2OH-+H2↑,生成的OH-与海水中的Mg2+结合形成Mg(OH)2,故Mg(OH)2主要在阴极上形成,D项错误。
8.D 电极b上生成O2和O3,则电极b上发生失电子的氧化反应,则电极b为阳极,电极a为阴极,A项正确;电极a的电极反应式为O2+4e-+4H+===2H2O,B项正确;电极b上H2O失去电子,发生氧化反应生成O2、O3和H+,故电解一段时间后b极周围溶液的pH下降,C项正确;标准状况下,当有5.6 L氧气参加反应时,转移电子1 ml,设收集到氧气x ml,臭氧y ml,则有x+y=0.2,4x+6y=1,解得x=y=0.1,故O3的体积分数为50%,D项错误。
9.D 阴极得到的气体为氢气,阳极得到的气体为氧气,根据电解水的原理知,阴极得到气体体积是阳极两倍,A项正确;电解过程中Na+向阴极移动,即向左迁移,Cl-向右迁移,故N为阴离子交换膜,B项正确;若去掉双极膜(BPM),阳极上会发生2Cl--2e-===Cl2↑,阳极室会有Cl2生成,C项正确;阴极上氢离子放电,故附近溶液酸性不会明显增强,D项错误。
10.D 由图可知,X极产物H2与CO分别为H2O与CO2的还原产物,可判断在X极上发生还原反应,由此判断X极为电源的负极,A项正确;根据题意可知,电解质为固体金属氧化物,可传导O2-,故在阴极上发生的反应为H2O+2e-===H2+O2-、CO2+2e-===CO+O2-,B项正确;根据电极产物及B项发生的电极反应可知,该电解池的总反应化学方程式为H2O+CO2 eq \(=====,\s\up7(通电)) H2+CO+O2,C项正确;根据C项的电解总反应化学方程式可知,阴、阳两极生成的气体的物质的量之比为2∶1,D项错误。
11.BD 氯碱工业中阳极是Cl-放电生成Cl2;电解精炼铜时阳极上粗铜溶解,阴极上Cu2+放电析出Cu,由于粗铜中含有锌、铁、镍等杂质,溶液中Cu2+浓度变小;铁片上镀铜时,阴极应该是铁片,阳极是纯铜。
12.D 根据图示,石墨电极一侧发生反应2Br--2e-===Br2、OHC—CHO+Br2+H2O―→HOOC—CHO+2HBr,总反应为OHC—CHO-2e-+H2O===HOOC—CHO+2H+,因此石墨电极为阳极,KBr不只是起到电解质的作用,A项错误,B项错误;根据阳极总反应OHC—CHO-2e-+H2O===HOOC—CHO+2H+、阴极反应HOOC—COOH+2e-+2H+===HOOC—CHO+H2O,可得总反应式为OHC—CHO+HOOC—COOH===2HOOC—CHO,故制得2 ml乙醛酸,理论上外电路中迁移了2 ml电子,C项错误;根据阴极(铅电极)反应,双极膜中间层中的H+在外电场作用下向阴极(铅电极)迁移,D项正确。
13.AB 如用金属铜作电解池的阳极,则电极本身会发生氧化反应,不能达到电解尿素的目的,故A错误;根据得失电子守恒,电解过程中阴极产生的H2和阳极产生的N2的物质的量之比为3∶1,故B错误;阴极发生还原反应生成氢气,故C正确;阳极发生氧化反应得到N2,故D正确。
14.D 铁失电子生成高铁酸钠,则铁作阳极,电极反应式为Fe+8OH--6e-===FeO eq \\al(\s\up11(2-),\s\d4(4)) +4H2O,故A错误;镍作阴极,镍电极上水中氢离子放电生成氢气,氢氧根离子浓度增大,所以溶液的pH增大,故B错误;不能确定温度和压强,生成气体体积无法确定,故C错误;若离子交换膜为阴离子交换膜,则电解结束后由于浓度差左侧溶液中会含有FeO eq \\al(\s\up11(2-),\s\d4(4)) ,故D正确。
15.答案:Ⅰ.(1)阳 Cl2 H2
(2)阻止OH-进入阳极室与Cl2发生副反应2NaOH+Cl2===NaCl+NaClO+H2O 阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸
(3)饱和食盐水 稀NaOH溶液 稀食盐水 浓NaOH溶液
Ⅱ.6H++6e-===3H2↑ NH eq \\al(\s\up11(+),\s\d4(4)) +3Cl--6e-===NCl3+4H+ NH4Cl+2HCl eq \(=====,\s\up7(电解)) NCl3+3H2↑
解析:Ⅱ由图可知,电解NH4Cl和盐酸混合溶液得到H2和NCl3,阴极的电极反应式为6H++6e-===3H2↑,阳极的电极反应式为NH eq \\al(\s\up11(+),\s\d4(4)) +3Cl--6e-===NCl3+4H+,电解时发生反应的化学方程式为NH4Cl+2HCl eq \(=====,\s\up7(电解)) 3H2↑+NCl3。
新高考2024版高考化学一轮复习微专题小练习专练33电解池原理及应用: 这是一份新高考2024版高考化学一轮复习微专题小练习专练33电解池原理及应用,共5页。试卷主要包含了[情境创新]双极膜等内容,欢迎下载使用。
统考版2024版高考化学一轮复习微专题小练习专练31电解池原理及应用: 这是一份统考版2024版高考化学一轮复习微专题小练习专练31电解池原理及应用,共6页。
高考化学微专题小练习专练33原电池电解池原理的综合应用二含答案: 这是一份高考化学微专题小练习专练33原电池电解池原理的综合应用二含答案,共8页。试卷主要包含了一种可充电锂-空气电池如图所示等内容,欢迎下载使用。













