




2023版高考化学一轮总复习第四章第一节原子结构与元素周期表课件
展开[自主测评]1.易错易混辨析(正确的画“√”,错误的画“×”)。
(1)3 g 3He 含有的中子数为 1NA。(
(3)同一周期,第ⅡA 族与第ⅢA 族的原子序数差一定为 1。
)(4)原子及离子的核外电子层数等于该元素所在的周期数。)
(5)卤族元素的最高价氧化物的水化物都属于强酸。(
(6)锂和钠在空气中燃烧得到的生成物中氧元素的价态相
错因:中子数为 18 的氯原子为35Cl。错因:同一周期,第ⅡA 族与第ⅢA 族的原子序数
差可能为1、11 或25。
错因:离子的核外电子层数不一定等于该元素所在
错因:氟元素没有正化合价,没有其氧化物,也就
错因:锂和钠活泼性不同,得到的产物分别是氧化
锂和过氧化钠,氧元素化合价分别为-2 和-1 价。
在的周期数,如Na+。
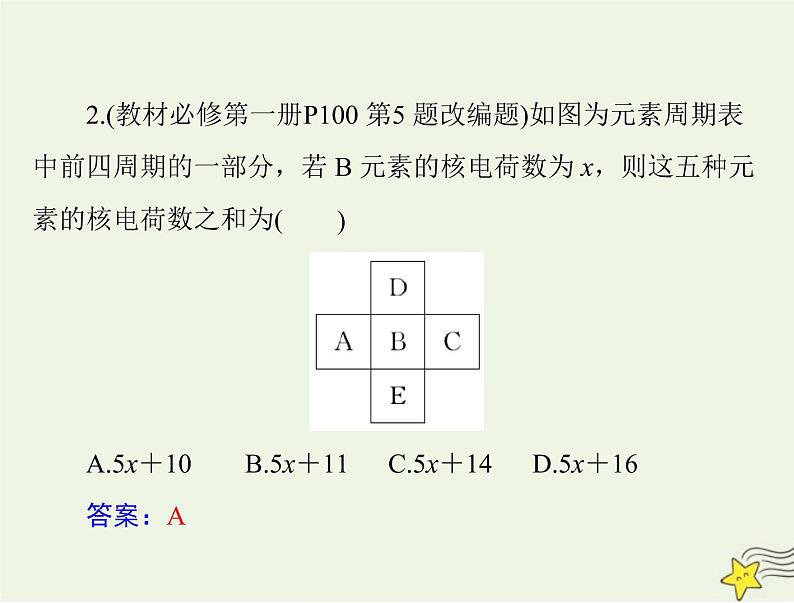
2.(教材必修第一册P100 第5 题改编题)如图为元素周期表中前四周期的一部分,若 B 元素的核电荷数为 x,则这五种元
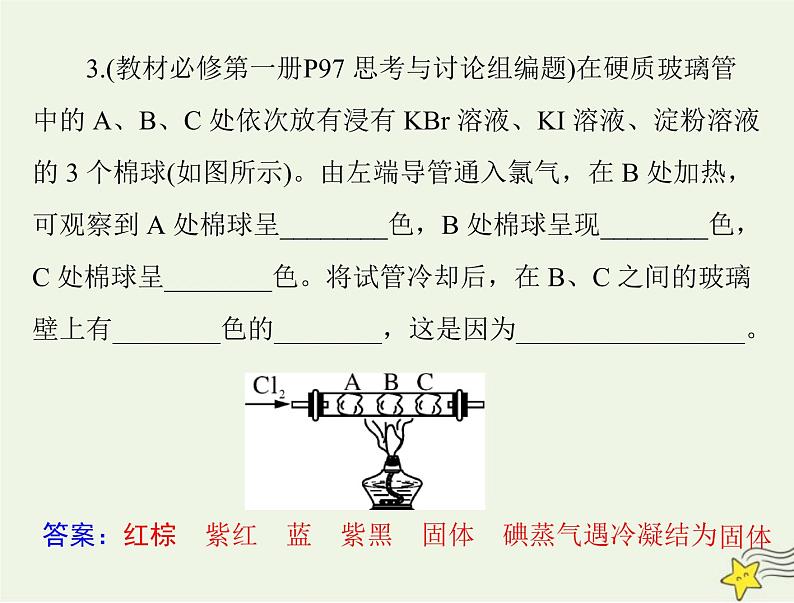
3.(教材必修第一册P97 思考与讨论组编题)在硬质玻璃管中的 A、B、C 处依次放有浸有 KBr 溶液、KI 溶液、淀粉溶液的 3 个棉球(如图所示)。由左端导管通入氯气,在 B 处加热,可观察到 A 处棉球呈________色,B 处棉球呈现________色,C 处棉球呈________色。将试管冷却后,在 B、C 之间的玻璃壁上有________色的________,这是因为_________________。
1.原子结构(1)构成原子的微粒及作用质子(Z 个)——决定元素的种类原子核 中子[(A-Z)个]——在质子数确定后决定原子种类核外电子(Z 个)——最外层电子数决定元素的化学性质
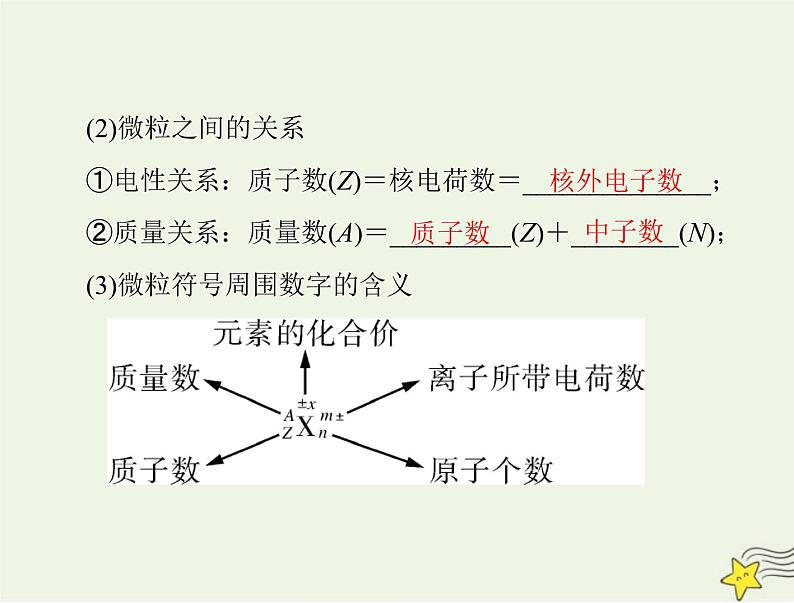
①电性关系:质子数(Z)=核电荷数=______________;②质量关系:质量数(A)=_________(Z)+________(N);
(3)微粒符号周围数字的含义
(4)核外电子排布与原子结构示意图①核外电子排布规律
②原子或离子结构示意图
(1)K、L、M、N 由里向外分别为第一层、第二层、第三层、
(2)阳离子的核外电子数=质子数-阳离子所带的电荷数;阴离子的核外电子数=质子数+阴离子所带的电荷数。
2.核素(1)元素、核素、同位素的概念及相互关系
①同一元素的各种核素的________不同,________相同,化学性质_______________,物理性质________;②同一元素的各种稳定核素在自然界中所占的原子百分数
(3)氢元素的三种核素
(4)几种重要核素的用途3.相对原子质量(1)原子(即核素)的相对原子质量:一个原子(即核素)的质量
与一个 12C 质量的
的比值。一种元素有几种同位素,就有几
种不同核素的相对原子质量。
(2)元素的相对原子质量:是按该元素各种天然同位素原子
所占的原子百分比算出的平均值。
(3)核素的近似相对原子质量=该核素的质量数。
(1)同位素的“六同三不同”
叫铝铍测年法。关于26Al 和10Be 的说法不正确的是(
【练1】(2021年青岛模拟)我国科学家通过测量 SiO2 中 26Al和10Be 两种核素的比例来确定“北京人”年龄,这种测量方法
【练2】(2021年淄博模拟) 已知 A、B、C、D 是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
(1)如果 A、B、C、D 均是 10 电子的粒子,请写出 A、D
的电子式:A________;D________。
(2)如果 A 和 C 是 18 电子的粒子,B 和D 是10 电子的粒
①A 与 B 在溶液中反应的离子方程式为____________________________________________________________________。②根据上述离子方程式,可以判断 C 与 B 结合质子的能力
大小是____________(用化学式或离子符号表示)。
(2)①HS-+OH-===S2-+H2O ②OH->S2-
寻找“10电子”微粒和“18电子”微粒的方法
(1)“10 电子”微粒
(2)“18 电子”微粒
原子核外电子排布原理及规律
【练3】(2021年淮南期末)下列离子化合物中,阴、阳离
子的电子层结构相同的是(
解析:A 项,NaCl 中钠离子核外有 10 个电子、氯离子核外有 18 个电子,氯离子电子层比钠离子多一个,电子层结构不同,错误;B 项,LiCl 中锂离子核外有 2 个电子、氯离子核外有 18 个电子,氯离子电子层比锂离子多 2 个,电子层结构不同,错误;C 项,氧化镁中氧离子和镁离子核外电子数都是 10,其阴阳离子电子层结构相同,正确;D 项,Na2S 中钠离子核外有10 个电子、硫离子核外有 18 个电子,硫离子比钠离子多 1 个电子层,电子层结构不同,错误。
【练 4】(2021 年云浮期末)下列有关短周期元素原子的说
A.当原子形成简单离子后,其最外层上的电子数不可超过8 个B.原子最外层上的电子数少于 4 个时,电子数越多,还原性越强C.原子核外电子中,最外层上的电子能量最低D.当最外层上的电子数变为 4 个时即达稳定结构
解析:A 项,原子形成简单离子后,最外层应满足稳定的结构,可为 2 或 8 等,正确;B 项,原子最外层上的电子数少于 4 个时,电子数越多,还原性越弱,错误;C 项,原子核外电子离核越远,能量越高,错误;D 项,最外层上的电子数变为 2 或 8 时达稳定结构,错误。
1~20 号元素原子核外电子排布的特点与规
律(2)最外层只有一个电子的原子:H、Li、Na、K;最外层有两个电子的原子:He、Be、Mg、Ca。(3)最外层电子数等于次外层电子数的原子:Be、Ar;最外层电子数是次外层电子数 2 倍的原子:C;最外层电子数是次外层电子数 3 倍的原子:O。
(4)电子层数与最外层电子数相等的原子:H、Be、Al;最外层电子数是电子层数2 倍的原子:He、C、S;最外层电子数是电子层数3 倍的原子:O。
(5)次外层电子数是最外层电子数2 倍的原子:Li、Si。(6)内层电子总数是最外层电子数2 倍的原子:Li、P。
1.原子结构与元素周期表的关系(1)原子序数:按照元素在周期表中的顺序给元素编号,称之为_________,_________=核电荷数=质子数=核外电子数。
①周期:把_________相同的元素,按______________的顺
序,从左至右排成的横行。
②族:把______________相同的元素,按_____________的
顺序,从上至下排成的纵列。
(1)元素周期表的应用
(2)含元素种类最多的族是第ⅢB 族,共有32 种元素;过渡元素包括所有副族,全部是金属元素,原子最外层电子数不超过2 个;最外层电子数为3~7 个的原子一定属于主族元素,且最外层电子数即为主族的族序数。
元素周期表的结构与位置推导
【练1】(2021 年沧州二模)A、B、C 均为短周期元素,它们在周期表中的相对位置如图所示。已知:B、C 两元素原子最外层电子数之和等于 A 元素原子最外层电子数的 2 倍;B、C两元素的核电荷数之和是 A 元素原子序数的 4 倍。则 A、B、
A.O、P、ClC.C、Al、P
B.N、Si、SD.F、S、Ar
解析:设 A、B、C 三种元素的原子序数分别为 a、b、c,由三种元素在元素周期表中的相对位置可知 a+8-1=b,a+8 +1=c,且 b+c=4a,所以 a=8,b=15,c=17,即 A、B、C 分别是 O、P、Cl。
【练2】结合如图所示元素周期表,回答下列问题:(1)表中所列元素,属于长周期元素的有_________(填字母,下同),属于主族元素的有____________;g 元素位于第_______周期第________族;i 元素位于第________周期第________族。(2)f 元素位于第________周期第________族。
a、b、c、d、e、f
[归纳提升] 元素位置的确定方法(1)“0 族”法确定元素位置
①熟记0 族元素的相应周期数和原子序数
②确定主族元素在周期表中位置的方法:原子序数-最邻
近的稀有气体元素的原子序数=ΔZ。若ΔZ<0,则与该稀有气体元素同周期,族序数为 8-|ΔZ|
若ΔZ>0,则在该稀有气体元素下一周期,族序数ΔZ
①原子序数是奇数的主族元素,其所在主族序数必为奇数。②原子序数是偶数的主族元素,其所在主族序数必为偶数。
根据元素周期表的“片段结构”推断元素
【练3】(2019 年全国Ⅱ卷)2019 年是门捷列夫发现元素周期律 150 周年。下表是元素周期表的一部分,W、X、Y、Z 为短周期主族元素,W 与 X 的最高化合价之和为 8。下列说法错.
A.原子半径:W
解析:主族元素的最高化合价与最外层电子数相等,由“W与 X 的最高化合价之和为 8”可知,W 为 N,X 为 Al,Y 为 Si,Z 为 P。原子半径:N
电荷数为 X 元素的 2 倍。下列说法正确的是(
A.X、W、Z 元素的原子半径及它们的气态氢化物的热稳定性均依次增大B.Y、Z、W 元素的最高价氧化物的水化物的酸性依次减弱C.液态 WX3 汽化需克服氢键D.根据元素周期律,可以推测 T 元素的单质具有半导体特性,T2X3 具有氧化性和还原性
解析:由分析可知,X 为 O、Y 为 Si、Z 为 P、W 为 S、T为 As。A 项,同周期自左而右原子半径减小、非金属性增强,同主族自上而下原子半径增大、非金属性减弱,故原子半径 X<W<Z,氢化物稳定性 Z<W<X,A 错误;B 项,非金属性Y<Z<W,故最高价氧化物的水化物的酸性 Y<Z<W,B 错误;C 项,SO3 分子之间没有氢键,液态 SO3 汽化需克服分子间作用力,C 错误;D 项,As 元素处于金属与非金属交界处,根据元素周期律,可以推测 As 元素的单质具有半导体特性,As2O3 中 As 元素处于中间价态,具有氧化性和还原性,D 正确。
[归纳提升](1)“┰”“┸”型元素原子序数之间的规律直接相邻的“┰”型元素原子序数的关系如图所示,
直接相邻的“┸”型元素原子序数的关系如图所示。
(2)“╂”型元素原子序数之间的规律
第ⅢA 族→0 族区域内满足“╂”型元素原子序数的关系,
(3)元素周期表中元素原子序数的序差规律
①同周期第ⅡA 族与第ⅢA 族元素的原子序数之差有以下三种情况:第2、3 周期(短周期)相差1,第4、5 周期相差11,第6、7 周期相差25。
②相邻周期,同一主族元素的原子序数可能相差2、8、18、32。若 A、B 是同主族相邻周期元素,A、B 所在周期分别有m和 n 种元素。如图:
当A、B在第ⅠA 或第ⅡA 族时,y=x+m。A、B在第ⅢA~
0 族时,y=x+n。
1.原子结构与元素性质的关系(1)金属元素原子的最外层电子数一般少于 4,容易_______
(2)非金属元素原子最外层电子数一般多于 4,容易_______电子,具有非金属性。
(1)碱金属是一类化学性质非常活泼的金属,在自然界中都
以________存在。
(2)碱金属元素的化学性质________,最外层电子数均为______,都能与________等非金属单质以及________反应,得到的产物中碱金属元素的化合价都为+1 价。(3)碱金属元素的化学性质具有_______性,随着_________的增加,碱金属元素原子的电子层数逐渐________,原子半径逐渐________,原子核对最外层电子的引力逐渐________,原子失去最外层电子的能力逐渐________。即从锂到铯,金属性
逐渐________。
(4)碱金属单质在物理性质上也表现出一些相似性和规律性。例如它们都比较________ ,有________ 性;密度都比水________,熔点也都比较________,导电性和导热性也都很好。
(1)卤族元素(简称卤素)是典型的非金属元素,在自然界中
都以________存在。
(2) 卤族元素的化学性质 ________ , 最外层电子数均为______,其单质表现出较强的________。
(3)卤族元素的化学性质具有________性,从 F→I,电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐________,原子得电子能力逐渐________,非金属性逐渐________。按 Cl2、Br2、I2 顺序氧化性逐渐________,相应离子的还原性逐渐________。即从 F2 到 I2,与 H2 反应所需要的条件逐渐________,反应剧烈程度依次________,生成气态氢化物
的稳定性依次________。
(4)卤族元素在物理性质上也表现出一些相似性和规律性。
的重大突破,下列关于金属铷的说法不正确的是(
碱金属元素的性质及其递变规律
【练1】(2021 年汕头东厦中学期中)光鼎国际控股集团在广东河源市龙川县麻布岗镇天堂山探明了一座储量达 17.5 万吨的独立铷矿床。作为目前世界上探明的首个独立铷矿床,是继稀土之后在中国探明的又一种优势矿产,标志着中国找矿史上
A.金属铷与氧气反应,能够生成复杂的氧化物B.金属铷与水剧烈反应,可能会发生爆炸
C.金属铷的密度大于钠,故可保存在煤油中D.铷的最高价氧化物对应的水化物难溶于水
解析:金属铷为第五周期第ⅠA 族元素,金属性较强,与钠性质相似。金属铷与氧气反应,反应条件不同产物不同,能够生成复杂的氧化物,A 正确;金属铷金属性较强与水剧烈反应,可能会发生爆炸,B 正确;金属铷的密度大于钠,且不与煤油反应,故可保存在煤油中,C 正确;铷的最高价氧化物对应的水化物为强碱,易溶于水,D 错误。
【练2】(2021 年石家庄一中期中)下列有关碱金属元素的
A.K 与 H2O 反应最剧烈B.Rb 比 Na 活泼,故 Rb 可以从 NaCl 溶液中置换出 NaC.碱金属的阳离子没有还原性,所以有强氧化性D.从 Li 到 Cs 都易失去最外层 1 个电子,且失电子能力逐渐增强解析:A 项,Cs 与 H2O 反应最剧烈;B 项,Rb 先与水反应,不会置换出 Na;C 项,碱金属阳离子很稳定,不具有强氧化性。答案:D
[归纳提升] 碱金属元素性质的相似性和递变性(1)相似性
Li→Cs,与氧气反应越来越剧烈,产物越来越复杂。如Li与O2 生成Li2O,Na 与O2 生成Na2O2,K 与O2 生成KO2。
②与H2O(或酸)的反应
Li→Cs,与H2O(或酸)反应越来越剧烈。如K 与H2O 反应能发生轻微爆炸,Rb、Cs 则遇水发生爆炸。因Na、K 等活泼的金属易与H2O 反应,故不能从盐的水溶液中置换出不活泼的金属,只有在熔融状态下才能置换出不活泼的金属。③最高价氧化物对应的水化物的碱性:LiOH
【练3】(2021年首都师范大学附属中学三模)某小组比较Cl-、Br-、I-的还原性,实验如下:
解析:实验1,浓硫酸与氯化钠固体反应生成氯化氢气体;实验 2,溶液变黄,说明有溴单质生成;②中溶液含有浓硫酸和溴单质,加入碘化钠生成碘单质,可能是浓硫酸把碘离子氧化为碘单质;实验 1 体现浓硫酸的难挥发性、实验 2 体现浓硫
NaCl+H2SO4(浓)=====NaHSO4+HCl↑,A正确;实验1溶液
说明浓硫酸能氧化溴离子,所以判断还原性:Br->Cl-,B正
酸的氧化性,据此分析解答。实验 1 中浓硫酸与氯化钠固体反应生成氯化氢气体,符合难挥发性酸制取挥发性酸,反应为
颜色无明显变化说明浓硫酸不能氧化氯离子,实验 2 溶液变黄
确;②中溶液含有浓硫酸和溴单质,加入碘化钠生成碘单质,
可能是浓硫酸把碘离子氧化为碘单质,不能得出还原性 I->Br-的结论,C错误;根据分析,实验1体现浓硫酸的难挥发性、实验 2 体现浓硫酸的氧化性,D 正确。
【练 4】(2021 年滨州期末)甲、乙、丙三种溶液各含有一种X-(X-为 Cl-、Br-、I-),向甲中加淀粉溶液和新制的氯水变为橙色,将此溶液倒入丙中,颜色无明显变化。则甲、乙、丙
解析:熟知有关卤素的知识:①单质氧化性为 Cl2>Br2>I2,而对应阴离子的还原性为 I->Br->Cl-;②碘单质可使淀粉变蓝
色,溴水颜色为橙色。由此可推出甲中加淀粉溶液和新制的氯
水后变为橙色,说明甲中含有 Br-,再加丙溶液无明显变化,则说明丙中无 I-。
[归纳提升] 卤族元素单质化学性质的相似性和递变性(1)相似性(用 X 代表卤族元素):
①与H2 反应越来越难,对应氢化物的稳定性逐渐减弱,还
原性逐渐增强,其水溶液的酸性逐渐增强,即
稳定性:HF>HCl>HBr>HI;还原性:HF
HBrO4>HIO4。
1.(2021 年全国乙卷)我国嫦娥五号探测器带回 1.731 kg 的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素 W、X、Y、Z,原子序数依次增大,最外层电子数之和为 15。X、Y、Z 为同周期相邻元素,且均不与 W 同族,
A.原子半径大小顺序为 W>X>Y>ZB.化合物 XW 中的化学键为离子键C.Y 单质的导电性能弱于 Z 单质的D.Z 的氧化物的水化物的酸性强于碳酸
解析:由短周期元素 W、X、Y、Z,原子序数依次增大,最外层电子数之和为 15, X、Y、Z 为同周期相邻元素,可知 W所在主族可能为第ⅢA 族或第ⅥA 族元素,又因 X、Y、Z 为同周期相邻元素,且均不与 W 同族,故 W 一定不是第ⅢA 族元素,即 W 一定是第ⅥA 族元素,进一步结合已知可推知 W、X、Y、Z 依次为 O、Mg、Al、Si,据此答题。O 原子有两个电子层,Mg、Al、Si 均有三个电子层且原子序数依次增大,故原子半径大小顺序为 Mg>Al>Si>O,即 X>Y>Z>W,A 错误;
化合物 XW 即 MgO 为离子化合物,其中的化学键为离子键,B 正确;Y 单质为铝单质,铝属于导体,导电性很强,Z 单质为硅,为半导体,半导体导电性介于导体和绝缘体之间,故 Y单质的导电性能强于 Z 单质的,C 错误;Z 的氧化物的水化物为硅酸,硅酸酸性弱于碳酸,D 错误。
个电子。下列说法不正确的是(
2.(2021 年广东卷)一种麻醉剂的分子结构式如图所示。其中,X 的原子核只有 1 个质子;元素 Y、Z、W 原子序数依次增大,且均位于 X 的下一周期;元素 E 的原子比 W 原子多 8
A.XEZ4 是一种强酸B.非金属性:W>Z>YC.原子半径:Y>W>ED.ZW2 中,Z 的化合价为+2 价
解析:题给化合物结构中 X、W、E 均形成 1 个共价键、Y 形成 4 个共价键、Z 形成 2 个共价键。X 的原子核只有 1 个质子,则 X 为 H 元素;元素 Y、Z、W 原子序数依次增大,且均位于 X 的下一周期,即第二周期元素,则 Y 为 C 元素,Z 为O 元素,W 为 F 元素;元素 E 的原子比 W 原子多 8 个电子,则 E 为 Cl 元素,综合以上分析可知,X、Y、Z、W、E 分别为H、C、O、F、Cl 元素。氯元素非金属性较强,其最高价氧化物的水化物 HClO4 是一种强酸,A 正确;同一周期元素从左到
右非金属性逐渐增强,所以非金属性:F>O>C,B 正确;同一周期从左到右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,电子层越多半径越大,所以原子半径:Cl>C>F,C错误;OF2 中,F 为-1 价,则 O 的化合价为+2 价,D 正确。
3.(2021年浙江选考)已知短周期元素X、Y、Z、M、Q 和 R在周期表中的相对位置如下所示,其中 Y 的最高化合价为+3。
A.还原性:ZQ2
A 错误;Mg 和 CO2 发生下述反应:2Mg+CO2
B 正确;Al 和 Fe2O3 发生铝热反应如下:2Al+Fe2O3
+2Fe,C 正确;M 为 N,N 的最高价氧化物的水化物为 HNO3,最低价氢化物为 NH3 ,二者发生如下反应:HNO3 +NH3===NH4NO3,D 正确。答案:A
4.(2020年全国Ⅲ卷)W、X、Y、Z 为原子序数依次增大的短周期元素,四种元素的核外电子总数满足 X+Y=W+Z;化
合物 XW3 与 WZ 相遇会产生白烟。下列叙述正确的是(A.非金属性:W>X>Y>ZB.原子半径:Z>Y>X>WC.元素 X 的含氧酸均为强酸D.Y 的氧化物水化物为强碱
解析:化合物 XW3 与 WZ 相遇会产生白烟,结合 W、X、Y、Z 的原子序数依次增大,又因四种元素的核外电子总数满足X+Y=W+Z,可知W、X、Y、Z 分别为H、N、Na、Cl,XW3为 NH3,WZ 为 HCl。由上述分析可知,W 为 H、X 为 N、Y为 Na、Z 为Cl。非金属性:Cl>N>H>Na,A 错误;同周期主族元素满足序大径小的规则,原子半径:Na>Cl>N>H,B错误;N 可以形成 HNO2,HNO2 为弱酸,C 错误;Na 的氧化物的水化物为 NaOH,NaOH 属于强碱,D 正确。
5.(2021 年浙江选考)现有 4 种短周期主族元素 X、Y、Z 和Q,原子序数依次增大,其中 Z、Q 在同一周期。相关信息如下表:
A.常温时,X 单质能与水发生剧烈反应B.Y 与 Q 元素组成的 YQ4 分子,空间结构为正四面体
C.Y、Z、Q 最高价氧化物对应水化物的酸性依次减弱D.第五周期且与 Q 同主族元素的单质在常温常压下呈液态解析:X 原子的最外层电子数是核外电子总数的一半,由于最外层电子数不超过 8 个,因此 X 只能是第二周期的 Be;Y元素的最高化合价和最低化合价之和为零,位于第ⅣA 族,Y是 C 或 Si;Z 单质为淡黄色固体,常存在于火山喷口附近,因此 Z 是 S;Q 是同周期元素中原子半径最小,且 Z 和 Q 位于同一周期,因此 Q 是 Cl。根据以上分析可知 X 是 Be,Y 是 C 或Si,Z 是 S,Q 是 Cl。则:Be 的金属性弱于 Mg,常温时镁和
冷水不反应,因此 Be 单质不能与水发生剧烈反应,A 错误;Y与 Q 元素组成的 CCl4 或 SiCl4 分子,空间结构均为正四面体,B 正确;Y、Z、Q 三种元素的非金属性逐渐增强,非金属性越强,最高价含氧酸的酸性越强,则最高价氧化物对应水化物的酸性依次增强,C 错误;第五周期且与 Cl 同主族元素的单质是碘,在常温常压下呈固态,D 错误。
原子序数依次增大,且总和为24。下列有关叙述错误的是( )
6.(2020 年全国Ⅱ卷)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素 W、X、Y、Z 的
A.该化合物中,W、X、Y 之间均为共价键B.Z 的单质既能与水反应,也可与甲醇反应C.Y 的最高化合价氧化物的水化物为强酸D.X 的氟化物 XF3 中原子均为 8 电子稳定结构
2024届高考化学一轮总复习第四章非金属及其化合物第一节氯及其化合物课件: 这是一份2024届高考化学一轮总复习第四章非金属及其化合物第一节氯及其化合物课件,共60页。PPT课件主要包含了目标导航,水的漂白效果,过滤→萃取,答案1加热,刺激性,1物理性质,强氧化,②氯水的性质,HClO,HCl+O2↑等内容,欢迎下载使用。
2024年高考化学一轮复习第四章第一节氯及其化合物课件: 这是一份2024年高考化学一轮复习第四章第一节氯及其化合物课件,共60页。PPT课件主要包含了目标导航,水的漂白效果,过滤→萃取,答案1加热,刺激性,1物理性质,强氧化,②氯水的性质,HClO,HCl+O2↑等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表图片ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表图片ppt课件,文件包含2元素周期律pptx、1原子结构与元素周期表pptx等2份课件配套教学资源,其中PPT共41页, 欢迎下载使用。













