



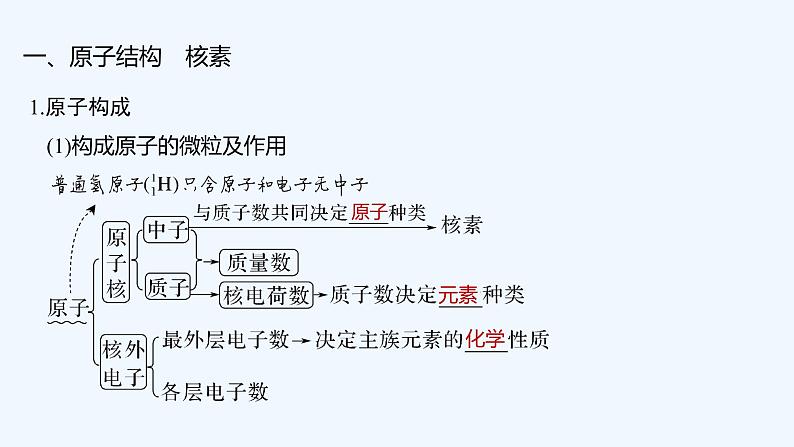
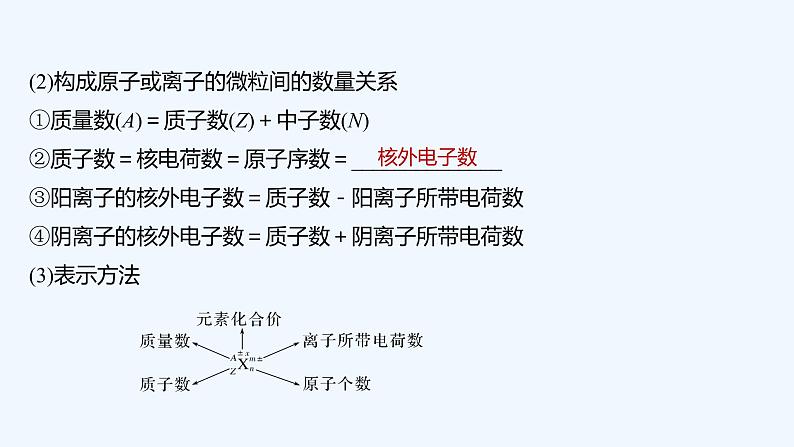
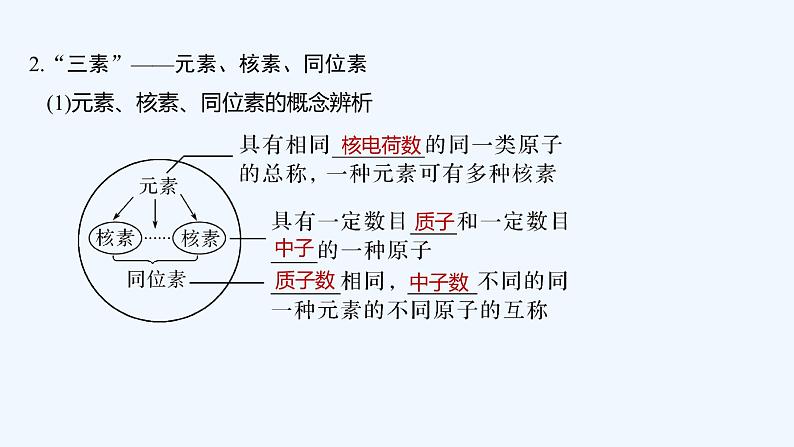
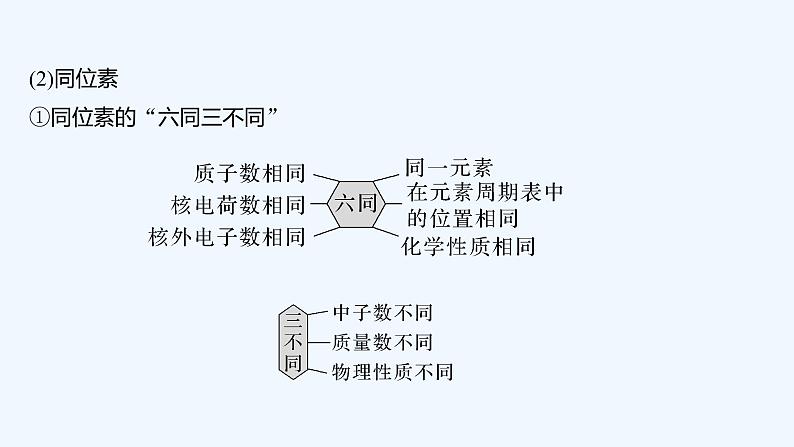



















2023版创新设计高考化学(新教材人教版)总复习一轮课件第六章 物质结构与性质 元素周期律
展开【课标要求】 1.认识离子键、共价键的本质。结合常见的离子化合物和共价分子的实例,认识物质的构成微粒、微粒间相互作用与物质性质的关系。知道金属键的特点与金属某些性质的关系。2.了解共价键具有饱和性和方向性。知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型;知道共价键可分为极性和非极性共价键。共价键的键能、键长和键角可以用来描述键的强弱和分子的空间结构。
3.认识分子间存在相互作用,知道范德华力和氢键是两种常见的分子间作用力,了解分子内氢键和分子间氢键在自然界中的广泛存在及重要作用。4.结合实例了解共价分子具有特定的空间结构,并可运用相关理论和模型进行解释和预测。知道分子的结构可以通过波谱、晶体X射线衍射等技术进行测定。知道分子可以分为极性分子和非极性分子,知道分子极性与分子中键的极性、分子的空间结构密切相关。结合实例初步认识分子的手性对其性质的影响。
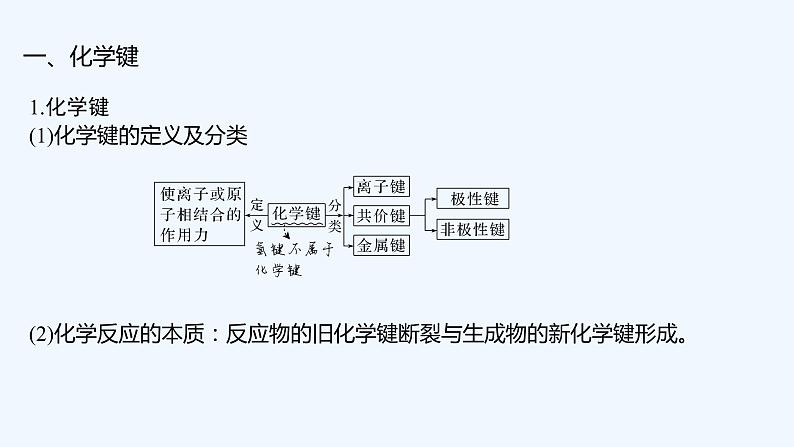
1.化学键(1)化学键的定义及分类
(2)化学反应的本质:反应物的旧化学键断裂与生成物的新化学键形成。
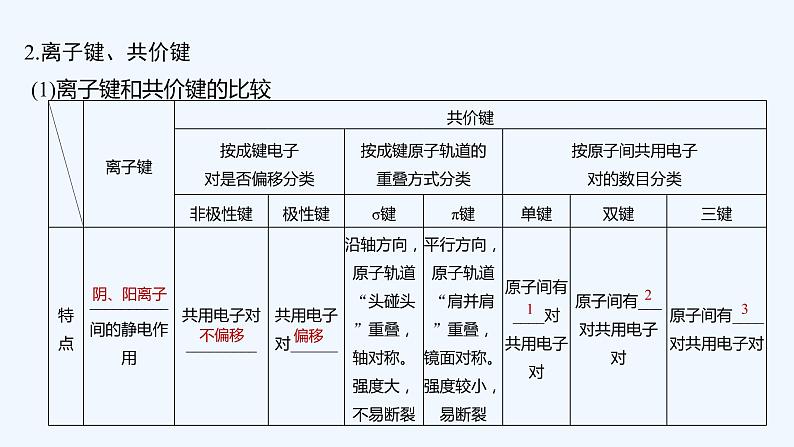
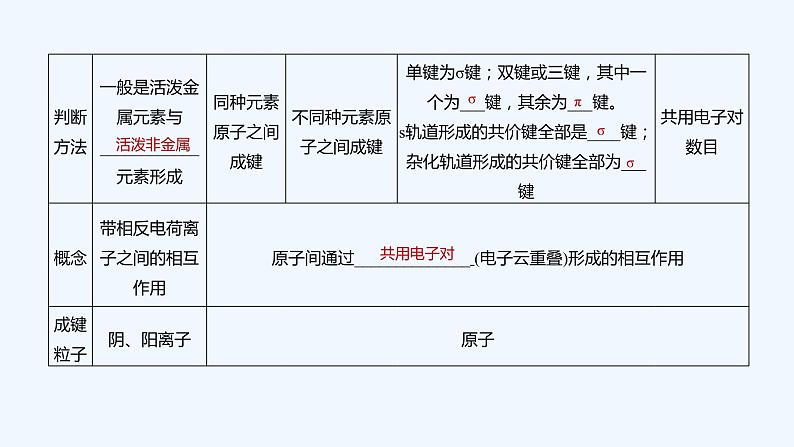
(1)离子键和共价键的比较
(2)共价键参数①概念
②键参数对分子性质的影响:a.键能______,键长______,化学键越强、越牢固,分子越稳定。
(1)概念:在元素符号周围用“·”或“×”来表示原子的____________的式子。(2)电子式的书写
(1)化学键与物质类型①概念离子化合物:由______键形成的化合物,如NaCl、NaOH等均是离子化合物。离子化合物中可能含有______键。共价化合物:只由______键形成的化合物,如CO2、HCl等均是共价化合物。共价化合物中______离子键。
(2)化学键对物质性质的影响①对物质熔、沸点的影响金刚石、石英等物质硬度大、熔点高,因为其中的共价键,键能很大。破坏时需消耗很多的能量。NaCl等部分离子化合物,有很强的离子键,熔点也较高。②对物质热稳定性的影响N2分子中氮氮三键的键能很大,故通常状况下,N2很稳定,H2S、HI等分子中的共价键键能较小,故它们受热易分解。
【诊断1】 判断下列叙述的正误(正确的划“√”,错误的划“×”)。
(1)在任何情况下,都是σ键比π键的键能大( )(2)H与O形成分子式是H2O而不是H3O的原因是共价键有饱和性( )(3)σ键可以绕键轴旋转,π键一定不能绕键轴旋转( )(4)在CH2===CHCN中含有6个σ键和3个π键( )
(1)红外光谱当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率_____的红外线,再记录到图谱上呈现吸收峰,通过和已有谱图库比对,或通过_________计算,可分析出分子中含有何种化学键或官能团的信息。(2)相对分子质量的测定——质谱法质荷数(粒子的相对质量与其电荷数的比值)的_______即为该物质的相对分子质量。
2.多样的分子空间结构
3.价层电子对互斥理论
(1)理论要点①价层电子对在空间上彼此相距最远时,排斥力最小,体系的能量最低。②孤电子对越多,排斥力越强,键角越小。(2)判断分子或离子立体构型“三步骤”第一步:确定中心原子上的价层电子对数
第二步:确定价层电子对的立体构型由于价层电子对之间的相互排斥作用,使它们尽可能地相互远离,这样已知价层电子对的数目,就可以确定它们的立体构型。第三步:分子立体构型的确定价层电子对有成键电子对和孤电子对之分,价层电子对的总数减去成键电子对数得孤电子对数。根据成键电子对数和孤电子对数,可以确定相应的较稳定的分子立体构型。
(1)杂化轨道理论概述当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间结构不同。
(2)杂化轨道三种类型
(3)由杂化轨道数判断中心原子的杂化类型杂化轨道用来形成σ键和容纳孤电子对,所以有公式:杂化轨道数=中心原子的孤电子对数+中心原子的σ键个数。
【诊断2】 判断下列叙述的正误(正确的划“√”,错误的划“×”)。
(1)NH3分子为三角锥形,N原子发生sp2杂化( )(2)分子中中心原子通过sp3杂化轨道成键时,该分子一定为正四面体结构( )(3)价层电子对互斥理论中,π键电子对数不计入中心原子的价层电子对数( )(4)CH4、NH3、H2O分子的中心原子均为sp3杂化,因此它们的空间构型相同( )
三、分子的结构与物质的性质
(1)键的极性①极性键:由不同原子形成的共价键,电子对会发生偏移;②非极性键:由同种原子形成的共价键,电子对不发生偏移。
(2)分子的极性①非极性分子与极性分子的比较:
②含有极性键的分子有没有极性,必须依据分子中极性键的极性的向量和是否为零而定。
(3)键的极性对化学性质的影响①羧酸的酸性可用pKa的大小来衡量,相同条件下pKa越小,酸性______。②羧酸的酸性强弱与其分子的组成和结构有关。a.三氟乙酸的酸性大于三氯乙酸,这是因为氟的电负性______氯的电负性,F—C键的极性大于Cl—C键的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基极性______,更易电离出________。b.烃基(符号R—)是推电子基团,烃基越长推电子效应______,使羧基中的羟基的极性______,羧酸的酸性______,则甲酸的酸性强于乙酸的酸性,乙酸的酸性大于______。
(1)定义分子之间存在的相互作用统称为分子间作用力。(2)分类分子间作用力最常见的是__________和______。(3)分子间作用力与化学键的强弱范德华力____氢键____化学键。
(4)范德华力①含义:物质分子间普遍存在的作用力。范德华力很弱,比化学键的键能小得多。相对分子质量越大,范德华力越大;分子的极性越大,范德华力也越大。②对性质的影响范德华力主要影响物质的熔点、沸点、硬度等物理性质。范德华力越强,物质的熔点、沸点______,硬度_______。
(5)氢键①氢键的形成:已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力,称为氢键。②表示方法:X—H…Y(X、Y为N、O、F,“-”表示共价键,“…”表示形成的氢键。)③特征:具有一定的_____性和_______性。
④分类:氢键包括________氢键和________氢键两种。
(1)“相似相溶”的规律:非极性溶质一般能溶于___________,极性溶质一般能溶于_________。若能形成氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。(2)“相似相溶”还适用于分子结构的相似性,如乙醇和水互溶(C2H5OH和H2O中的羟基相近),而戊醇在水中的溶解度明显减小。(3)分子与H2O反应,也能促进分子在水中的溶解度,如SO2、NO2。
“相似相溶”规律可用于解释一些物质溶解现象,如HCl(极性分子)易溶于H2O(极性溶剂),可做喷泉实验;苯(非极性溶剂)可萃取水(极性溶剂)中的溴(非极性分子)。
【诊断3】 判断下列叙述的正误(正确的划“√”,错误的划“×”)。
考点二 分子的空间结构与杂化类型的判断
考点一 共价键类型的判断及应用
考点三 分子间作用力、分子的性质
考点一 共价键类型的判断及应用
题组一 σ键和π键的判断1.下列关于σ键和π键的理解不正确的是( )
A.乙烯分子中的π键比σ键活泼B.在有些分子中,共价键可能只含有π键而没有σ键C.有些原子在与其他原子形成分子时只能形成σ键,不能形成π键D.当原子形成分子时,首先形成σ键,可能形成π键
解析 乙烯分子中π键键能比σ键键能小,易断裂,故分子中的π键比σ键活泼,A项正确;在共价单键中只含σ键,而含有π键的分子一定含有σ键,B项错误、D项正确;氢原子、氯原子等原子跟其他原子形成分子时只能形成σ键,C项正确。
2.含碳元素的物质是化学世界中最庞大的家庭,请填写下列空格:
题组二 共价键的键参数及应用3.下列说法中正确的是( )
解析 键长越长,键能越小,分子越不稳定,A项错误;水是V形分子,2个H—O键键角104.5°,C项错误;断裂2 ml H—O键吸收2×462.8 kJ能量,形成1 ml H—H键和0.5 ml O===O键时需释放能量,D项错误。
4.已知几种共价键的键能如下:
下列说法错误的是( )A.键能:N≡N>N===N>N—NB.H(g)+Cl(g)===HCl(g) ΔH=-431.8 kJ·ml-1C.H—N键能小于H—Cl键能,所以NH3的沸点高于HClD.2NH3(g)+3Cl2(g)===N2(g)+6HCl(g) ΔH=-463.9 kJ·ml-1
解析 A项,三键键长小于双键键长小于单键键长,键长越短,键能越大,所以键能:N≡N>N===N>N—N,正确;B项,H(g)+Cl(g)===HCl(g)的焓变为H—Cl键能的相反数,则ΔH=-431.8 kJ·ml-1,正确;C项,NH3的沸点高于HCl是由于NH3形成分子间氢键,而HCl不能,键能不是主要原因,错误;D项,根据ΔH=∑E(反应物)-∑E(生成物),则2NH3(g)+3Cl2(g)===N2(g)+6HCl(g) ΔH=6E(N—H)+3E(Cl—Cl)-E(N≡N)-6E(H—Cl)=-463.9 kJ·ml-1,正确。
考点二 分子的空间结构与杂化类型的判断
题组一 分子的空间构型1.(2021·沈阳模拟)下列分子VSEPR模型不是四面体形的是( )
A.SO3 B.H2O C.NH3 D.CH4
2.(2021·烟台模拟)根据杂化轨道理论和价层电子对互斥理论模型判断,下列分子或离子的中心原子杂化方式及空间构型正确的是( )
题组二 杂化轨道类型的判断3.下列分子中,各分子的立体构型和中心原子的杂化方式均正确的是( )
4.BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。它们的结构简式如下,请写出单体、二聚体和多聚体中Be的杂化轨道类型:
“四方法”判断分子中中心原子的杂化类型❶根据杂化轨道的空间结构判断①若杂化轨道在空间的分布为正四面体形或三角锥形,则分子的中心原子发生sp3杂化。②若杂化轨道在空间的分布呈平面三角形,则分子的中心原子发生sp2杂化。③若杂化轨道在空间的分布呈直线形,则分子的中心原子发生sp杂化。
❷根据杂化轨道之间的夹角判断若杂化轨道之间的夹角为109°28′,则分子的中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则分子的中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则分子的中心原子发生sp杂化。❸根据中心原子的价电子对数判断如中心原子的价电子对数为4,是sp3杂化;为3是sp2杂化;为2,则是sp杂化。❹根据分子或离子中有无π键及π键数目判断。如没有π键为sp3杂化,含1个π键为sp2杂化,含2个π键为sp杂化。
考点三 分子间作用力、分子的性质
题组一 分子的极性与手性的判断1.已知化合物M是某合成路线中的中间产物,其结构简式如图所示,下列有关M的叙述不正确的是( )
A.分子中含有非极性键,且为极性分子B.分子中的碳的杂化方式有2种C.与足量氢气反应所得产物中含有3个手性碳原子D.M的同分异构体中存在同时含有羟基、醛基和碳碳三键的芳香族化合物
解析 M与足量氢气反应所得产物中只含有两个手性碳原子(六元环上与乙基相连的两个碳原子)。
2.下列叙述正确的是( )
A.NH3是极性分子,N原子处在3个H原子所组成的三角形的中心B.CCl4是非极性分子,C原子处在4个Cl原子所组成的正方形的中心C.H2O是极性分子,O原子不处在2个H原子所连成的直线的中央D.CO2是非极性分子,C原子不处在2个O原子所连成的直线的中央
解析 NH3是极性分子,N原子处在三角锥形的顶点,3个H原子处于锥底,A项错误;CCl4是非极性分子,四个Cl原子构成的是正四面体结构,C原子处在4个Cl原子所组成的正四面体的中心,B项错误;H2O是极性分子,呈V形,O原子不处在2个H原子所连成直线的中央,C项正确;CO2是非极性分子,三个原子在一条直线上,C原子处在2个O原子所连成的直线的中央,D项错误。
分子极性的判断❶共价键的极性与分子极性的关系
❷判断ABn型分子极性的经验规律若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,若不等则为极性分子。如SO2为极性分子,SO3为非极性分子。
题组二 分子间作用力对物质性质的影响3.(2021·厦门模拟)下列说法错误的是( )
4.(2021·潍坊模拟)氢键是强极性键上的氢原子与电负性很大且含孤电子对的原子之间的作用力。下列事实与氢键无关的是( )
A.相同压强下,H2O的沸点高于HF的沸点B.一定条件下,NH3与BF3可以形成NH3·BF3C.羊毛制品水洗再晒干后变形D.H2O和CH3COCH3的结构和极性并不相似,但两者能完全互溶
粒子间作用力对物质性质的影响
微专题15 分子结构类简答题的规范解答专练
题组一 “溶解性”的比较1.填写下列空白。
(1)PH3是________(填“极性”或“非极性”)分子,其在水中的溶解度比NH3的小,原因是______________________________________。(2)(CH3)3N能溶于水的原因是_________________________________________。(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是________________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能溶于乙醇、乙醚等有机溶剂,原因是____________________________________________________________________。
NH3能与H2O形成分子间氢键,而PH3不能
(CH3)3N为极性分子且可与H2O形成分子间氢键
ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2中的化学键以共价键为主、极性较小
咖啡因与水杨酸钠之间形成了氢键
(2)配合物Pt(NH3)2Cl4有两种不同的结构,其中呈橙黄色的物质的结构比较不稳定,在水中的溶解度大;呈亮黄色的物质的结构较稳定,在水中的溶解度小,如图2所示的物质中呈亮黄色的是________(填“A”或“B”),理由是_________________________________________________________________________________________________________。
A为对称性结构,为非极性分子,B为非对称性结构,为极性分子,根据相似相溶规律,A在水中的溶解度小
题组二 原子成键特点的原因分析3.Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是_________________________________________________________________________________________________________________________________。
Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键,不易形成双键或三键
4.硅是重要的半导体材料,构成了现代电子工业的基础。碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
(1)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______________________________________________________________________________________________________________________________。
C—C和C—H的键能较大,所形成的烷烃稳定。而硅烷中Si—Si和Si—H的键能较小,易断裂,导致长链硅烷难以生成
(2)SiH4的稳定性小于CH4,更易生成氧化物,原因是____________________________________________________________________________________________________________________________________。
C—H的键能大于C—O,C—H比C—O稳定。而Si—H的键能却小于Si—O,所以Si—H不稳定而倾向于形成稳定性更强的Si—O
题组三 键角的大小比较及原因分析5.比较下列物质键角的大小并指明原因
(1)NF3的键角________NH3的键角(填“>”“<”或“=”),理由是________________________________________________________________________________。
F的电负性比H大,NF3中N周围电子云密度减小,成键电子对之间的排斥力较小
(3)比较NH3和[Cu(NH3)4]2+中H—N—H键角的大小:NH3________[Cu(NH3)4]2+(填“>”或“<”),并说明理由:________________________________________________________________________________________________________________________。
由于NH3提供孤电子对与Cu2+形成配位键后,N—H成键电子对受到的排斥力减小
题组四 “氢键”对物质熔沸点的影响
(1)乙二胺分子(H2N—CH2—CH2—NH2)中氮原子杂化类型为sp3,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是_______________________________________________________________。(2)丙酸钠(CH3CH2COONa)和氨基乙酸钠均能水解,水解产物有丙酸(CH3CH2COOH)和氨基乙酸(H2NCH2COOH),常温下丙酸为液体,而氨基乙酸为固体,主要原因是__________________________________________________________________________________________ 。
乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
羧基的存在使丙酸形成分子间氢键,而氨基乙酸分子中,羧基和氨基均能形成分子间氢键
尿素分子间存在氢键,使其熔、沸点升高,而硝酸分子内存在氢键,使其熔、沸点降低
联氨分子间形成的氢键数目多于氨分子间形成的氢键数目
方法篇 一、共价分子中键角大小的比较方法
【核心归纳】影响键角大小的因素主要有中心原子的杂化类型。中心原子孤电子对数,配位原子的电负性大小,中心原子的电负性大小等,这几个影响键角的因素都是有条件的,在影响键角的能力方面也是有区别的。
(1)电子对斥力大小的顺序孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力。例如:CH4、NH3·H2O三种分子的中心原子价层电子对数均为4,VSEPR模型均为四面体形,CH4、NH3和H2O中孤电子对数分别是0、1、2,故键角大小顺序为CH4>NH3>H2O,图示如下:
(2)双键之间的斥力>双键与单键之间的斥力>单键之间的斥力。例如:SO2Cl2的VSEPR模型为四面体形,因S—O是双键,S—Cl是单键,依据斥力的大小顺序判断:“∠O—S—O”>109°28′“∠Cl—S—Cl”<“∠O—S—Cl”<109°28′
(3)斥力大小顺序xW—xW>xW-xS>xS-xS(其中x代表配位原子的电负性,下标W为弱,S为强)例如:SO2F2中“∠F—S—F”为98°,而SO2Cl2中“∠Cl—S—Cl”为102°,后者键角较大的原因就是Cl的电负性小于F,Cl—S—Cl中价层电子对的斥力大于F—S—F中价层电子对的斥力,故SO2Cl2分子中键角大。
NH3>PH3>AsH3
(2)(2021·全国乙卷节选)[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示。
PH3中P的杂化类型是________。H2O的键角小于NH3的,分析原因:________________________________________________________________________________________________________________________________ _____________________________________________________。
H2O、NH3分子中的O原子、N原子均为sp3杂化,其中心原子的孤电子对数分别为2、1,由于孤电子对对成键电子对的斥力大于成键电子对之间的斥力,因此孤电子对数越多,键角越小
解析 (1)N、P、As属于同一主族元素,其电负性N>P>As,因三种氢化物分子中的中心原子电负性逐渐减弱,则分子中成键电子对逐渐远离中心原子,致使成键电子对的排斥降低,键角逐渐减小,即键角由大到小的顺序为NH3>PH3>AsH3。(2)由题图可知,PH3的中心原子P形成3个σ键电子对和1个孤电子对,则其杂化方式为sp3。H2O、NH3分子中的O原子、N原子均为sp3杂化,其中心原子的孤电子对数分别为2、1,由于孤电子对对成键电子对的斥力大于成键电子对之间的斥力,因此孤电子对数越多,键角越小。
【模板构建】 键角大小比较的解题流程
答案 (1)> (2)> (3)> [PtCl4(NH3)2]形成过程中,NH3中N原子的孤电子对与Pt形成配位键,N→Pt配位键相比于孤电子对,对其他成键电子对的排斥作用减小,造成H—N—H的键角增大
解析 (1)两种物质中碳原子都采用sp2杂化,都没有孤电子对,氯的电负性比氢大,甲醛的共用电子对更向碳原子集中,碳氢键的斥力更大,键角更大。(2)键角α是双键—单键之间的斥力,而键角β是单键—单键之间的斥力,双键—单键的斥力大于单键—单键的斥力,故键角α>β。(3)[PtCl4(NH3)2]中N原子形成3个N—H键和1个N→Pt配位键,N→Pt配位键相比于孤对电子,对其他成键电子对的排斥作用减小,故其H—N—H键之间的夹角大于NH3分子中的H—N—H键角。
答案 (1)大于 (2)H2O中氧原子有两对孤电子对,H3O+中氧原子有一对孤电子对,排斥力较小 (3)大于 C===O双键对C—C键的斥力大于C—O单键对C—C键的斥力
解析 (1)BF3分子的空间结构为平面三角形,键角为120°;CCl4分子的空间结构为正四面体形,键角为109°28′。(2)H2O、H3O+的中心原子的价层电子对数均为4,H2O中O原子有两对孤电子对,H3O+中O原子有一对孤电子对,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H—O—H的键角比H2O中H—O—H的键角大。(3)由于双键对单键的斥力大于单键对单键的斥力,故乙酸分子结构中键角1大于键角2。
方法篇 二、分子(或离子)中大π键的判断方法
【核心归纳】(1)大π键的含义在一个平面形的多原子分子中,如果相邻原子有垂直于分子平面的、对称性一致的,未参与杂化轨道的原子轨道,那么这些轨道可以相互重叠,形成多中心π键。这种多中心π键又称为“共轭π键”或“离域π键”,简称“大π键”。
(2)大π键的形成条件①所有参与离域π键的原子都必须在同一平面内,即连接这些原子的中心原子只能采取sp或sp2杂化;②所有参与离域键的原子都必须提供一个或两个相互平行或接近平行的p轨道。③根据泡利不相容原理,参与离域π键的p轨道上的电子数必须小于2倍的p轨道数。
③导热导电性:离域π键的电子可在整个离域键的范围内运动,石墨形成很大的离域键,是它能导电的原因。
②常见分子(或离子)的大π键
【典例2】 (2017·全国卷Ⅱ)经X射线衍射测得化合物R[(N5)6(H3O)3(NH4)4Cl,五氮阴离子盐]的晶体结构,其局部结构如图所示。
【模型构建】 大π键中电子数的确定方法
1.(2021·山东卷)关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( )
A.CH3OH为极性分子B.N2H4空间结构为平面形C.N2H4的沸点高于(CH3)2NNH2D.CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同
答案 (1)V形 (2)5 D
2.(2021·山东卷节选)(1)OF2分子的空间构型为________。(2)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为____________,下列对XeF2中心原子杂化方式推断合理的是____________(填标号)。A.sp B.sp2 C.sp3 D.sp3d
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为________(填标号)。(2)CO2分子中存在________个σ键和________个π键。(3)甲醇的沸点(64.7 ℃)介于水(100 ℃)和甲硫醇(CH3SH,7.6 ℃)之间,其原因是____________________________________________________________。
3.(2021·全国甲卷节选)(1)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为________。SiCl4可发生水解反应,机理如下:
答案 (1)sp3 ② (2)2 2(3)甲醇和水均能形成分子间氢键,而甲硫醇不能,且水比甲醇的氢键多
解析 SiCl4的中心原子硅原子周围有4对成键电子对,则Si采取sp3杂化。由中间体SiCl4(H2O)的结构可知,Si原子周围有5对成键电子对,故该杂化轨道含1个s杂化轨道、3个p杂化轨道和1个d杂化轨道,则Si采取的杂化类型为sp3d。(2)CO2分子的结构为O===C===O,则1个CO2分子中含2个σ键和2个π键。(3)甲醇的结构简式是CH3OH,1个甲醇分子可形成1个分子间氢键,而1个H2O分子可形成2个分子间氢键,水中氢键比例比甲醇高,故水的沸点比甲醇高,甲硫醇中不存在氢键,其沸点最低。
4.(2021·广东卷节选)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
(1)H2S、CH4、H2O的沸点由高到低顺序为___________________________。
H2O>H2S>CH4
解析 (1)H2O分子间能形成氢键,H2S、CH4分子间均不存在氢键,H2O的沸点大于H2S、CH4;随着相对分子质量增大,氢化物的沸点逐渐增大,则沸点:H2S>CH4,所以三者的沸点由高到低的顺序为H2O>H2S>CH4。
(2)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有________。A.在Ⅰ中S原子采取sp3杂化B.在Ⅱ中S元素的电负性最大C.在Ⅰ中C—C—C键角是180°D.在Ⅲ中存在离子键与共价键E.在Ⅳ中硫氧键的键能均相等(3)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是________。
解析 (2)化合物Ⅰ中S原子价层电子对数均为4,采用sp3杂化,A正确;化合物Ⅱ中含C、H、O、S、Hg五种元素,其中非金属性最强的是O元素,故化合物Ⅱ中O元素的电负性最大,B错误;化合物Ⅲ中C原子价层电子对数均为4,采用sp3杂化,键角约为109°28′,C错误;化合物Ⅲ为有机钠盐,故Ⅲ中存在离子键和共价键,D正确;化合物Ⅳ中存在的S===O键和S—O键是两种不同的化学键,键能不同,E错误。(3)化合物Ⅰ与化合物Ⅲ相比,化合物Ⅰ中有一个—OH,而化合物Ⅲ中对应的是—SO3Na,—OH的亲水性没有—SO3Na中的离子键强,故水溶性较好的是化合物Ⅲ。
1.(2021·莆田模拟)下列关于物质结构的说法正确的是( )
A.立体构型为直线形的分子都是非极性分子B.某物质在熔融状态能导电,则该物质中一定含有离子键C.在CH≡CCl分子中,C和Cl之间的化学键是sp—p σ键D.(NH4)2SO4晶体含离子键、极性共价键和配位键,属于配位化合物
解析 A.立体构型为直线形的分子可能是极性分子,如CH≡CCl为直线形分子但为极性分子,A错误;B.熔融状态时能导电的物质中含有自由移动的电子或离子,如金属单质,B错误;C.CH≡CCl分子中,C原子价层电子对个数是2,采用sp杂化,C原子中的sp轨道和Cl原子的p轨道形成σ键,所以该分子中C和Cl之间的化学键是sp—pσ键,C正确;D.(NH4)2SO4晶体中铵根离子和硫酸根离子之间存在离子键、N原子和H原子之间存在极性共价键,其中一个是配位键,属于离子化合物,D错误。
2.下列有关微粒性质的排列顺序错误的是( )
A.GeX4(X表示Cl、Br或I)为分子晶体,熔沸点:GeCl4
3.氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子的空间结构为平面三角形,则其阳离子的空间结构和阳离子中氮的杂化方式为( )
A.直线形 sp杂化B.V形 sp2杂化C.三角锥形 sp3杂化D.平面三角形 sp2杂化
4.(2021·汕头模拟)缺电子化合物是指电子数不符合路易斯结构(一个原子通过共用电子使其价电子数达到8、H原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法错误的是( )
5.(2021·泰安模拟)下列对有关事实的解释不正确的是( )
7.(2021·龙岩模拟)化合物NH3与BF3可以通过配位键形成NH3·BF3,下列说法正确的是( )
A.NH3与BF3都是由极性键构成的极性分子B.NH3的键角大于BF3的键角C.NH3的沸点高于BF3D.NH3·BF3的结构式为
8.(2021·长春模拟)德国科学家发现新配方:他使用了远古地球上存在的O2、N2、CH4、NH3、H2O和HCN,再使用硫醇和铁盐等物质合成RNA的四种基本碱基。下列说法不正确的是( )
A.基态Fe3+价电子排布为3d5B.O2、N2、HCN中均存在σ键和π键C.CH4、NH3、H2O分子间均存在氢键D.沸点:C2H5SH(乙硫醇)
9.(2021·武汉模拟)下表所列数据是在相同条件下,不同物质中氧氧键的键长和键能的实测数据,下列有关说法中正确的是( )
10.对下列实验事实的理论解释不正确的( )
11.(2021·湖南卷节选)(1)①气态SiX4分子的空间构型是___________;
N-甲基咪唑分子中碳原子的杂化轨道类型为__________,1个M2+中含有______个σ键;
(2)(2021·河北卷节选)①已知有关氮、磷的单键和三键的键能(kJ·ml-1)如下表:
3倍的N—N键的键能小于N≡N键的键能,而3倍的P—P键的键能大于P≡P键的键能
12.(2021·晋江模拟)(1)Cu2+处于[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,则Cu2+是否为sp3杂化________(填“是”或“否”),理由为____________________________________________________________________________________________________________。(2)用价电子对互斥理论推断甲醛中H—C—H的键角________120°(填“>”“<”或“=”)。
若是sp3杂化,[Cu(NH3)4]2+的空间构型为正四面体形,将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则只有1种结构
解析 (1)Cu2+处于[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,说明[Cu(NH3)4]2+应为平面正方形,产生异构体,由此判断Cu2+不为sp3杂化,理由:若是sp3杂化,[Cu(NH3)4]2+的空间构型为正四面体形,将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则只有1种结构。(2)甲醛碳氧之间为双键,根据价层电子对互斥理论可知双键与单键之间的斥力大于单键与单键之间的斥力,所以H—C—H的键角小于120°。
(3)SO2Cl2和SO2F2都属于AX4E0型分子,S===O之间以双键结合,S—Cl、S—F之间以单键结合,请你预测SO2Cl2和SO2F2分子的立体构型为_____________。SO2Cl2分子中∠Cl—S—Cl________(填“<”“>”或“=”)SO2F2分子中∠F—S—F。(4)抗坏血酸的分子结构如图所示,该分子中碳原子的轨道杂化类型为____________。
解析 (3)当中心原子的价层电子对数为4时,VSEPR模型为四面体形,硫原子无孤电子对,所以分子构型为四面体;因为X原子得电子能力越弱,A—X形成的共用电子对之间的斥力越强,F原子的得电子能力大于氯原子,所以SO2Cl2分子中∠Cl—S—Cl>SO2F2分子中∠F—S—F。(4)由图可知,碳原子杂化类型分别为sp2和sp3。
14.茶文化是中国人民对世界饮食文化的一大贡献,茶叶中含有少量的咖啡因(结构简式如图)。下列关于咖啡因的说法错误的是( )
A.咖啡因的组成元素均位于元素周期表p区B.咖啡因分子中C、N 均有 sp2、sp3两种杂化方式C.咖啡因与足量 H2加成的产物含有 4 个手性碳原子D.咖啡因分子间不存在氢键
15.已知A、B、C、D、E、F为元素周期表前四周期原子序数依次增大的六种元素,其中A的一种同位素原子中无中子,B的一种核素在考古时常用来鉴定一些文物的年代,D与E同主族,且E的原子序数是D的2倍,F元素在地壳中的含量位于金属元素的第二位。试回答下列问题:(1)关于B2A2的下列说法中正确的是_____________。①B2A2中的所有原子都满足8电子稳定结构②B2A2是由极性键和非极性键形成的非极性分子③每个B2A2分子中σ键和π键数目比为1∶1④B2A2分子中的A—B键属于s-sp σ键
H2O分子之间存在氢键
2023版创新设计高考化学(新教材苏教版)总复习一轮课件专题六 物质结构与性质 元素周期律: 这是一份2023版创新设计高考化学(新教材苏教版)总复习一轮课件专题六 物质结构与性质 元素周期律,文件包含2023版创新设计高考化学新教材苏教版总复习一轮课件第一单元原子结构pptx、2023版创新设计高考化学新教材苏教版总复习一轮课件第三单元微粒间作用力与物质性质pptx、2023版创新设计高考化学新教材苏教版总复习一轮课件第二单元元素周期表元素周期律pptx、2023版创新设计高考化学新教材苏教版总复习一轮课件第四单元分子空间结构与物质性质pptx等4份课件配套教学资源,其中PPT共240页, 欢迎下载使用。
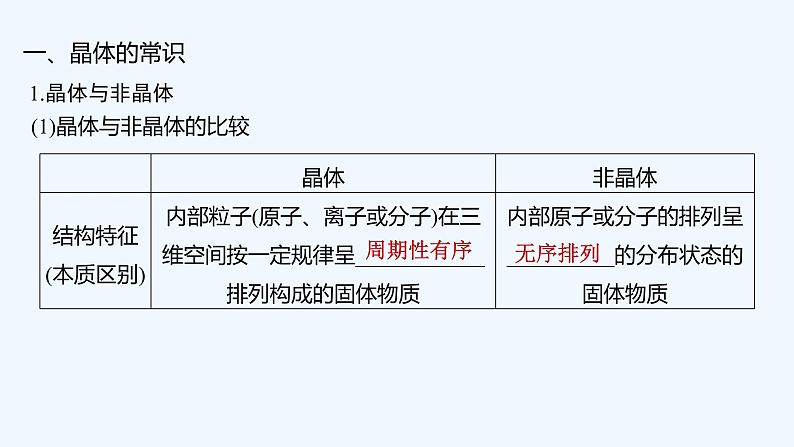
2023版创新设计高考化学(新教材鲁科版)总复习一轮课件第5章 物质结构与性质 元素周期律: 这是一份2023版创新设计高考化学(新教材鲁科版)总复习一轮课件第5章 物质结构与性质 元素周期律,文件包含2023版创新设计高考化学新教材鲁科版总复习一轮讲义第1讲原子结构pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第2讲元素周期表元素周期律pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第3讲微粒间相互作用与物质性质pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第4讲不同聚集态的物质与性质pptx等4份课件配套教学资源,其中PPT共240页, 欢迎下载使用。
2023版 创新设计 高考总复习 化学 苏教版专题12 物质结构与性质(选考): 这是一份2023版 创新设计 高考总复习 化学 苏教版专题12 物质结构与性质(选考),文件包含2023版创新设计高考总复习化学苏教版第一单元原子结构与性质pptx、2023版创新设计高考总复习化学苏教版第三单元晶体结构与性质pptx、2023版创新设计高考总复习化学苏教版第二单元分子结构与性质pptx、2023版创新设计高考总复习化学苏教版第二单元分子结构与性质DOCX、2023版创新设计高考总复习化学苏教版第三单元晶体结构与性质DOCX、2023版创新设计高考总复习化学苏教版第一单元原子结构与性质DOCX等6份课件配套教学资源,其中PPT共180页, 欢迎下载使用。












