
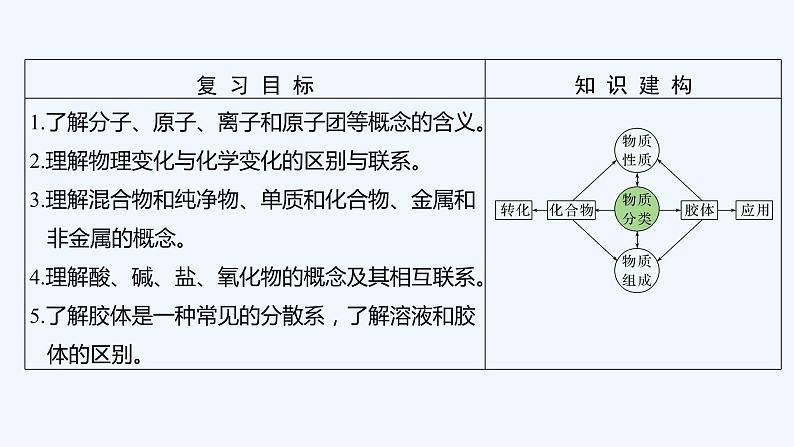





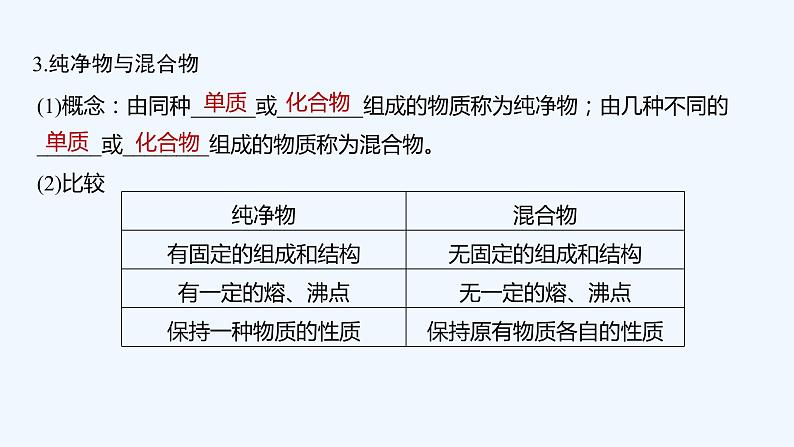

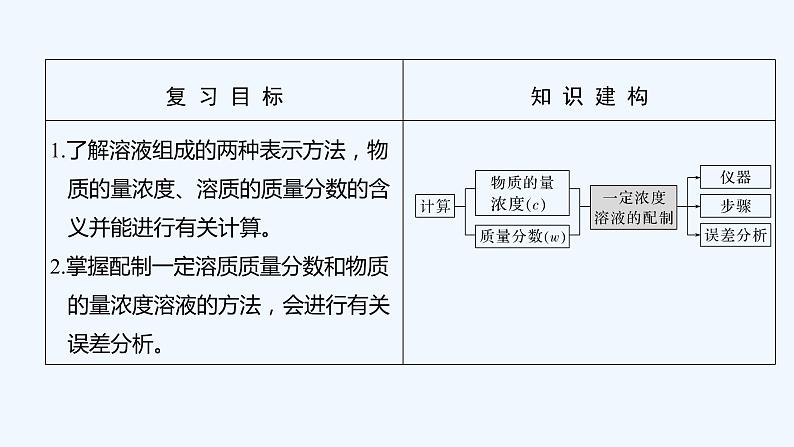



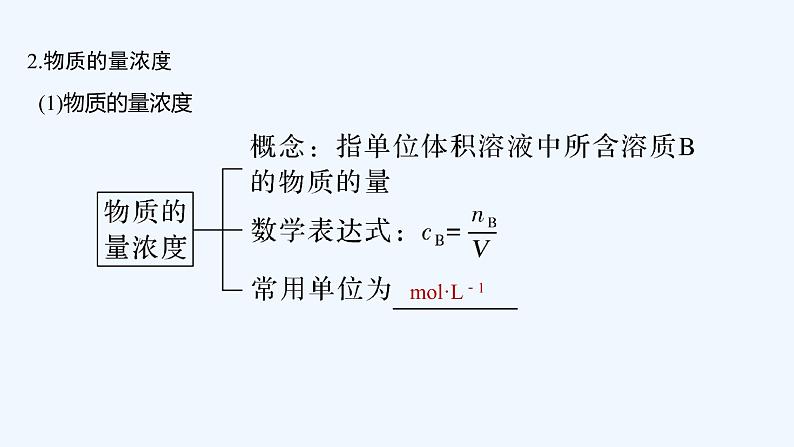


























2023版 创新设计 高考总复习 化学 苏教版专题1 化学家眼中的物质世界
展开本专题易错题强化练
一、常考易错选择题选项再排查
1.物质组成、分类、性质及应用类正误判断
(1)冰水混合物属于混合物(×)
(2)只由同种元素组成的物质一定是纯净物(×)
(3)石墨转化为金刚石是物理变化(×)
(4)232Th转化为233U是化学变化(×)
(5)非金属氧化物均为酸性氧化物(×)
(6)金属氧化物均为碱性氧化物(×)
(7)SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物(×)
(8)直径为20 nm的纳米级碳酸钙属于胶体(×)
(9)从海水中提取物质都必须通过化学反应才能实现(×)
2.氧化还原反应概念的正误判断
(1)置换反应全部属于氧化还原反应(√)
(2)有单质参加的反应一定是氧化还原反应(×)
(3)氧化还原反应中的反应物不是氧化剂就是还原剂(×)
(4)阳离子只有氧化性,阴离子只有还原性(×)
(5)元素从化合态变为游离态,该元素一定被还原(×)
(6)失电子越多,还原性越强,得电子越多,氧化性越强(×)
(7)金属元素被还原,不一定得到金属单质(√)
(8)含氧酸的价态越高,氧化性一定越强(×)
3.离子方程式的正误判断
(1)将稀HNO3滴加入Na2SO3溶液:SO+2H+===SO2↑+H2O(×)
(2)磁性氧化铁溶于稀硝酸:3Fe2++4H++NO===3Fe3++NO↑+2H2O(×)
(3)向明矾溶液中滴入Ba(OH)2溶液使SO恰好完全沉淀:2Ba2++3OH-+Al3++2SO===2BaSO4↓+Al(OH)3↓(×)
(4)浓盐酸与铁屑反应:2Fe+6H+===2Fe3++3H2↑(×)
(5)用铜作电极电解CuSO4溶液:2Cu2++2H2O2Cu+O2↑+4H+(×)
(6)向Na2S2O3溶液中加入稀硫酸:2S2O+4H+===SO+3S↓+2H2O(×)
(7)用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2===2NH+SO+H2O(√)
(8)向AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O===AlO+4NH+2H2O(×)
(9)NaClO和NaCl混合液中加入少量FeSO4溶液:2Fe2++ClO-+2H+===Cl-+2Fe3++H2O(×)
(10)酸性溶液中KIO3与KI反应生成I2:IO+I-+6H+===I2+3H2O(×)
二、常考易错知识点再排查
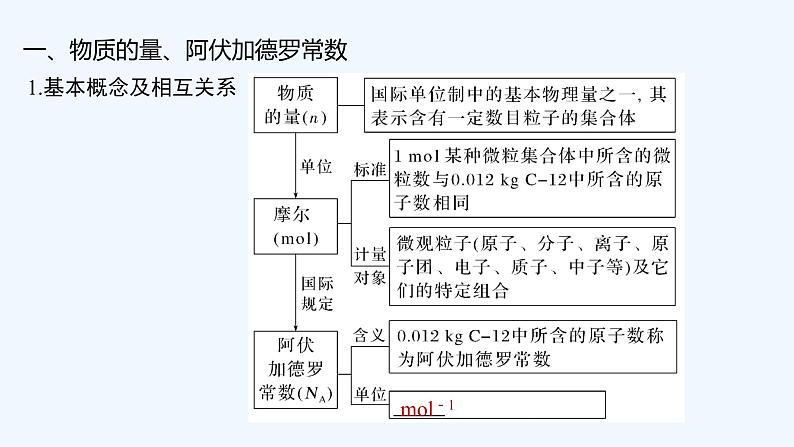
(一)化学计量
[辨析易错易混]
(1)考查气体摩尔体积适用条件及物质的聚集状态
①标准状况下,2.24 L CH4和CO2混合气体中含有的碳原子数目为0.1NA( )
②标准状况下,22.4 L HF的分子数为NA( )
③标准状况下,2.24 L NO2和N2O4混合气体中含有的氮原子数目为0.2NA( )
答案 ①√ ②× ③×
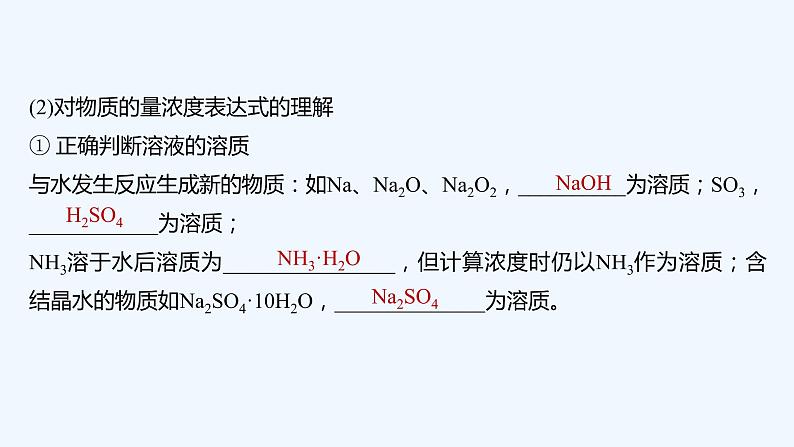
(2)考查物质的组成和结构
①1 mol 羟基与1 mol 氢氧根所含电子数均为9NA( )
②28 g 乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA( )
③1 mol Na2O 与1 mol Na2O2的固体中含有的阴离子数均为NA( )
④1.7 g H2O2中含有电子数为0.9NA( )
⑤1 mol NaCl中含有6.02×1023个NaCl分子( )
答案 ①× ②√ ③√ ④√ ⑤×
(3)考查氧化还原反应电子转移数
①标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA( )
②1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子( )
③常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA( )
④1 mol Cl2与足量Fe反应,转移的电子数为3NA( )
答案 ①× ②√ ③√ ④×
(4)考查化学反应前后微粒数目的变化
①50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA( )
②某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA( )
③1 mol Cu和足量稀硝酸反应产生NA个NO分子( )
④0.1 mol H2与0.1 mol I2蒸气在密闭容器中充分反应后,分子总数为0.2NA( )
⑤常温常压下,将0.1 mol NH3与0.1 mol HCl混合充分反应后,分子总数为0.2NA( )
答案 ①× ②× ③× ④√ ⑤×
(二)一定物质的量浓度溶液的配制
[辨析易错易混]
(1)配制0.1 mol·L-1的Na2CO3溶液480 mL,需用500 mL容量瓶( )
(2)用量筒量取15.0 mL 37% 的盐酸不需要胶头滴管 ( )
(3)量筒、容量瓶均标有使用温度( )
(4)准确量取9.50 mL水需要选择10 mL量筒( )
(5)托盘天平“左码右物”称量的质量一定偏小( )
(6)容量瓶、滴定管、分液漏斗使用前都需要检漏( )
(7)配制0.100 0 mol·L-1氯化钠溶液时,玻璃棒只起到引流作用( )
(8)称量NaOH固体不能直接放在托盘中,必须垫纸称量 ( )
(9)配制溶液定容时仰视会使所配溶液浓度偏大( )
(10)对量筒内的液体读数时仰视,会使读数偏小( )
(11)用量筒量取浓硫酸时,用水洗净内壁附着的硫酸会使结果更准确( )
(12)用容量瓶配制溶液时,若加水超过刻度线,立即用滴管吸出多余液体( )
(13)转移液体时若容量瓶内壁附有蒸馏水会使所配溶液浓度变小( )
(14)用pH=1的盐酸配制100 mL pH=2的盐酸只需要100 mL容量瓶、烧杯、玻璃棒、胶头滴管( )
(15)实验室用蔗糖配制100.0 g 溶质的质量分数为10%的蔗糖溶液,必须用到:100 mL的容量瓶、托盘天平、玻璃棒、烧杯和胶头滴管( )
答案 (1)√ (2)× (3)√ (4)× (5)× (6)√ (7)× (8)× (9)× (10)√
(11)× (12)× (13)× (14)× (15)×
三、常考笔答题答题语言再规范
1.实验室需要0.50 mol·L-1的NaOH溶液450 mL,配制时应称量____________ g NaOH,称量时需要____________、____________、____________(填仪器名称)。
答案 10.0 托盘天平 小烧杯 药匙
2.检查容量瓶是否漏水的方法:_____________________________。
答案 向容量瓶中加入适量水,盖好瓶塞,右手食指顶住瓶塞,左手托住瓶底,将容量瓶倒转过来看瓶口处是否有水渗出,若没有,将容量瓶正立,将瓶塞旋转180°,重复上述操作,如果瓶口仍无水渗出,则此容量瓶不漏水
3.配制一定物质的量浓度溶液定容时的操作是
______________________________________________________________。
答案 往容量瓶中缓慢加蒸馏水,等液面离容量瓶刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
2023版创新设计高考化学(新教材苏教版)总复习一轮课件专题十一 化学实验: 这是一份2023版创新设计高考化学(新教材苏教版)总复习一轮课件专题十一 化学实验,文件包含2023版创新设计高考化学新教材苏教版总复习一轮课件第一单元化学实验常用仪器和基本操作pptx、2023版创新设计高考化学新教材苏教版总复习一轮课件第三单元高考化学综合实验题探究pptx、2023版创新设计高考化学新教材苏教版总复习一轮课件第二单元物质的分离与提纯pptx等3份课件配套教学资源,其中PPT共180页, 欢迎下载使用。
2023版 创新设计 高考总复习 化学 苏教版专题12 物质结构与性质(选考): 这是一份2023版 创新设计 高考总复习 化学 苏教版专题12 物质结构与性质(选考),文件包含2023版创新设计高考总复习化学苏教版第一单元原子结构与性质pptx、2023版创新设计高考总复习化学苏教版第三单元晶体结构与性质pptx、2023版创新设计高考总复习化学苏教版第二单元分子结构与性质pptx、2023版创新设计高考总复习化学苏教版第二单元分子结构与性质DOCX、2023版创新设计高考总复习化学苏教版第三单元晶体结构与性质DOCX、2023版创新设计高考总复习化学苏教版第一单元原子结构与性质DOCX等6份课件配套教学资源,其中PPT共180页, 欢迎下载使用。
2023版 创新设计 高考总复习 化学 苏教版专题11 有机化学基础(选考): 这是一份2023版 创新设计 高考总复习 化学 苏教版专题11 有机化学基础(选考),文件包含2023版创新设计高考总复习化学苏教版第一单元认识有机化合物pptx、2023版创新设计高考总复习化学苏教版第三单元烃的衍生物pptx、2023版创新设计高考总复习化学苏教版第二单元常见的烃pptx、2023版创新设计高考总复习化学苏教版第四单元生命活动的物质基础有机高分子化合物pptx、2023版创新设计高考总复习化学苏教版第四单元生命活动的物质基础有机高分子化合物DOCX、2023版创新设计高考总复习化学苏教版第一单元认识有机化合物DOCX、2023版创新设计高考总复习化学苏教版第三单元烃的衍生物DOCX、2023版创新设计高考总复习化学苏教版第二单元常见的烃DOCX等8份课件配套教学资源,其中PPT共240页, 欢迎下载使用。













