


湖北省六校新高考联盟2021-2022学年高一下学期4月联考化学试题(Word版含答案)
展开2022 年湖北六校新高考联盟学校高一年级 4 月联考
化学试卷
考试时间:2022 年 4 月 28 日 14:30-17:05
可能用到的相对原子质量:H—1 N—14 O—16 Na—23 Fe—56 Cu—64
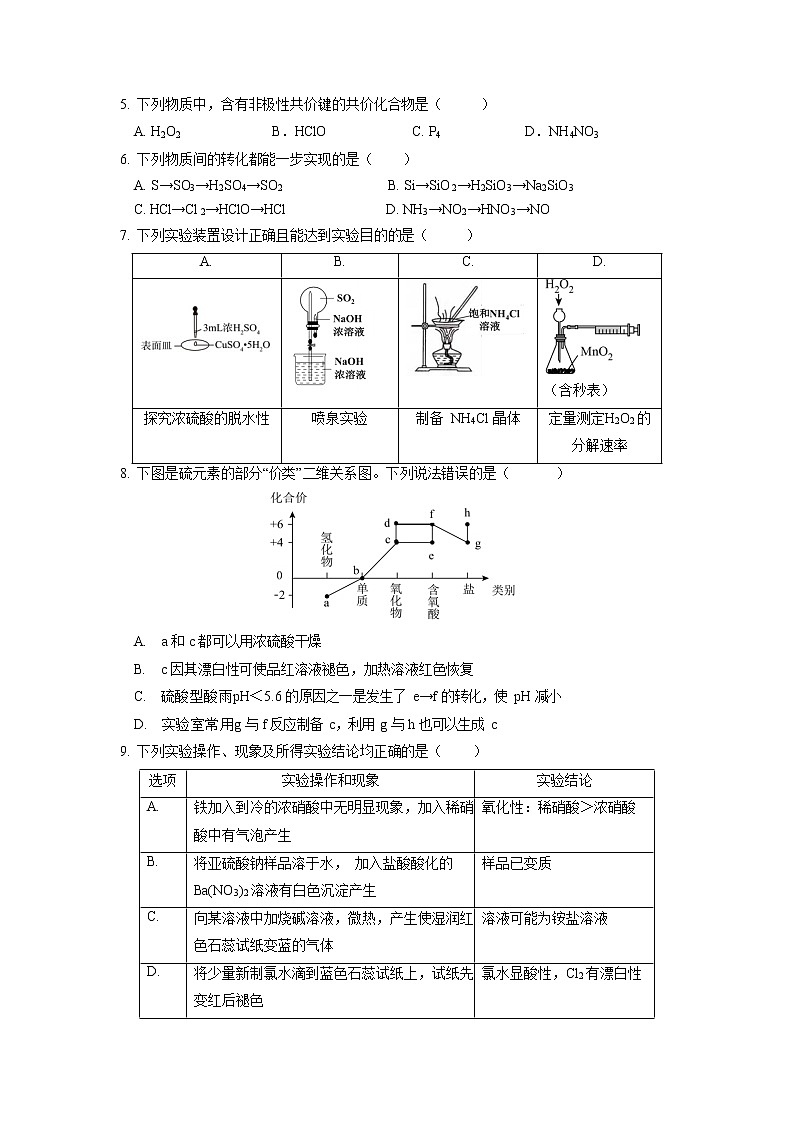
一、选择题(本题包括 15 个小题,每小题 3 分,共 45 分,每小题只有一个选项符合题意)
- 第 24 届冬奥会于 2022 年 2 月 4 日在北京开幕,许多核心技术为比赛保驾护航。下列说法不正确的是( )
- 场馆选用了二氧化碳跨临界制冷系统,同时利用冷热联供一体化设计对制冷余热进行回收利用,比传统氟利昂制冷技术更节能、环保
- 大规模使用氢燃料电池车,行驶时只产生水,实现“零碳排放”
- 户外保暖穿戴设备由石墨烯材料制造,该石墨烯材料属于传统无机非金属材料
- 碲化镉(CdTe)薄膜太阳能电池与半导体玻璃结合形成的碲化镉发电玻璃应用于国家速滑馆中,其中,Te 位于元素周期表中金属与非金属的交界处
- 设NA 表示阿伏加德罗常数,下列说法正确的是( )
- 将含 0.1molFeCl3 的溶液制成胶体后,分散系中含有的氢氧化铁胶粒数为 0.1NA
- 呼吸面具中发生的反应,每消耗 7.8g Na2O2,转移电子数为 0.2NA
- 标准状况下,2.24L H2O 中含O-H 键数目为 0.2NA
- 室温下,9.2g NO2 和N2O4 的混合物中原子总数为 0.6NA
- 能正确表示下列反应的离子方程式是( )
- 光导纤维在碱性环境中易断裂:Si+2OH-+H2O=SiO 2-+2H2↑
- 澄清石灰水中加入过量小苏打溶液:Ca2++2OH-+2HCO - = CaCO ↓+CO 2-+2H O
- 向明矾溶液中加入 Ba(OH)2 溶液使 SO 2-恰好完全沉淀:2Ba2++3OH-+Al3++2SO 2-
=2BaSO4↓+Al(OH)3↓
- 将 Fe(OH)3 溶于氢碘酸溶液中:Fe(OH)3 +3H+ = Fe3++3H2O
- 正确掌握化学用语是学习化学的基础,下列表达正确的是( )
- 中子数为 18 的氯原子: 18 Cl
- Cl-的结构示意图为:
- 用电子式表示NaCl的形成过程:
- C60、C70 和 C76 互为同素异形体
- 下列物质中,含有非极性共价键的共价化合物是( )
A. H2O2 B.HClO C. P4 D.NH4NO3
- 下列物质间的转化都能一步实现的是( )
A. S→SO3→H2SO4→SO2 B. Si→SiO2→H2SiO3→Na2SiO3
C. HCl→Cl2→HClO→HCl D. NH3→NO2→HNO3→NO
- 下列实验装置设计正确且能达到实验目的的是( )
A. | B. | C. | D. |
| (含秒表) | ||
探究浓硫酸的脱水性 | 喷泉实验 | 制备 NH4Cl 晶体 | 定量测定H2O2 的 分解速率 |
- 下图是硫元素的部分“价类”二维关系图。下列说法错误的是( )
- a 和 c 都可以用浓硫酸干燥
- c 因其漂白性可使品红溶液褪色,加热溶液红色恢复
- 硫酸型酸雨pH<5.6 的原因之一是发生了 e→f 的转化,使 pH 减小
- 实验室常用g 与 f 反应制备 c,利用 g 与 h 也可以生成 c
- 下列实验操作、现象及所得实验结论均正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A. | 铁加入到冷的浓硝酸中无明显现象,加入稀硝 酸中有气泡产生 | 氧化性:稀硝酸>浓硝酸 |
B. | 将亚硫酸钠样品溶于水, 加入盐酸酸化的 Ba(NO3)2 溶液有白色沉淀产生 | 样品已变质 |
C. | 向某溶液中加烧碱溶液,微热,产生使湿润红 色石蕊试纸变蓝的气体 | 溶液可能为铵盐溶液 |
D. | 将少量新制氯水滴到蓝色石蕊试纸上,试纸先 变红后褪色 | 氯水显酸性,Cl2 有漂白性 |
- 短周期元素 X、Y、Z、M、N 在元素周期表中的相对位置如表所示,其中 Y 的单质在一定条件下能与 N 的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体。则下列相关说法正确的是( )
| Y | Z |
|
X |
| M | N |
A.简单离子半径:X>M>N
B.YN2 化合物中Y 和N 均不满足 8 电子稳定结构C.最高价氧化物的水化物酸性强弱:M>N D.最简单氢化物的沸点:Z>Y
- 在 101kPa 下,1mol 石墨(s)在 O2(g)中完全燃烧生成 1mol CO2(g)放热 393.5kJ,1mol 金刚石(s)在 O2(g)中完全燃烧生成 1mol CO2(g)放热 395.4kJ,下列说法正确的是( )
- 1 mol 金刚石(s)与 1 mol O2(g)的总能量低于 1 mol CO2(g)的总能量
- 金刚石(s)转化为石墨(s)要放出能量
- 金刚石(s)比石墨(s)稳定
- 101kPa 下,2mol CO2(g)完全分解为石墨(s)和 O2(g)吸热 393.5kJ
- 有一种可穿戴电池,其结构如图所示,该电池的总反应为 V2O5+xZn==ZnxV2O5,关于此电池,下列说法错误的是( )
- Zn 为负极,生成的 Zn2+向正极移动
- 正极反应式为V2O5 +2xe-+ xZn2+ == ZnxV2O5
- 当 0.1mol Zn 溶解时,有 0.2mol 电子由负极经隔离膜流向正极
- 凝胶电解质可提高电池的安全性和稳定性
- “碘钟反应”表现为溶液混合后,溶液由无色变为蓝紫色,一定时间后褪为无色,接着又出现蓝紫色、褪为无色,这样周而复始地呈周期性变化。某化学兴趣小组查阅资料,“碘钟反应”总反应为:H2O2 +2S O 2−+2H+═S4O62−+2H2O,分反应 A 和反应 B 两步进行, 其中反应A 为:H2O2 +2I−+2H+═I2+2H2O。为探究溶液变蓝快慢的影响因素,该小组同学取等浓度的 H2O2 、Na2S2O3、H2SO4 及淀粉 KI 溶液混合,记录混合后溶液由无色变蓝色所需时间:实验①<实验②。
体积 mL 序号 | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | 淀粉KI 溶液 | H2O |
实验① | 5 | 4 | 8 | 3 | 0 |
实验② | 5 | 2 | x | y | z |
下列说法错误的是( )
- 反应 B 的离子方程式为 I2+2S2O32−═S4O62−+2I−
- 淀粉 KI 溶液可证明反应A 和反应 B 的存在
- 对比实验①和②,可得结论:增大反应物浓度,反应速率加快
D. x=8,y=3,z=0
- 在一定温度下,容积为 2L 密闭容器中加入 1 mol A 和 2 mol B,发生反应:
A(g)+2B(g) ⇌ C(s) +3D(g),达到平衡时生成 1.5 mol D。则下列说法正确的是( )
- n(A):n(B)=1:2 不变时,反应一定达到了平衡状态
- 平衡后B 的物质的量浓度为 1mol/L
- 压强不再变化时,反应一定达到了平衡状态D.气体的密度不变时,反应一定达到了平衡状态
- 将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成 NO 的体积和剩余金属的质量如下表(设硝酸的还原产物只有 NO)。下列说法正确的是( )
编号 | ① | ② | ③ | ④ |
硝酸体积/mL | 100 | 200 | 300 | 400 |
剩余金属/g | 18.6 | 9.6 | 0 | 0 |
NO 体积/L | 2.24 | 4.48 | 6.72 | V |
A.①中溶液存在 Fe3+ B.n(Fe):n(Cu)=1:1 C.硝酸的浓度为 2.5 mol/L D.④中V=8.96
二、非选择题(本题包括 4 个大题,共 55 分)
- (12 分) 常见的大气污染物有悬浮颗粒物、SO2 和 NOx 等,主要来源于燃煤、机动车尾气等,不仅污染环境,还会对人体健康造成危害。因而,大气质量监测成为环境保护和疾病预防的基础工作。
(1) 某城市首要污染物为可吸入颗粒物 PM2.5(直径小于等于 2.5μm 的悬浮颗粒物),将
PM2.5 分散在空气中形成的分散系 (填“是”或“不是”)胶体。
(2) 将 PM2.5 样本用蒸馏水配制成 100mL 一定物质的量浓度的待测试样。在定容步骤中需要用到的 3 种主要玻璃仪器为 、 和 。
(3) 室温下,经检测PM2.5 试样所含水溶性无机离子的化学组成及平均浓度如下表所示:
离子 | Na+ | K+ | + NH4 | Cl- | 2- SO4 | - NO3 |
c(mol/L) | 7×10 -6 | 3×10 -6 | 2×10 -5 | 1×10 -5 | 2×10 -5 | 1×10 -5 |
根据表中数据判断该试样为 (填“酸”或“中”或“碱”)性,试样中的
c(H+)或c(OH-)= mol/L。
(4) 汽车气缸温度越高,单位时间 NO 的排放量越大,请写出发生的化学方程式
。
(5) 为减少煤燃烧排放的烟气中 SO2 和 NOx 含量,可采用 NaClO2 在碱性环境下对烟气进行脱硫和脱硝。请完成脱硝过程的离子方程式:
- (13 分)热能和电能是人类生产生活中的两种重要能源。
- 合成氨工业是煤化工产业链中非常重要的一步。
(1) 已知断开 1mol H-H 键、1mol N≡N 键和 1mol N-H 键分别需要吸收的能量为 436kJ、946kJ
和 391kJ,则每生成 1mol NH3 需要 (填“吸收”或“放出”)热量 kJ。
(2) 在相同条件下向密闭容器中充入 0.5mol N2 和足量 H2,完全反应后吸收或放出的热量
(填“大于”、“等于”或“小于”)(1)中计算值。
- 燃料电池具备较高的能量转化率。乙醇(C2H5OH)碱性燃料电池的工作原理如图所示。
(3) 导线中电流的移动方向为 (用“a→b”或“b→a”表示)。
(4) 负极反应式为 ,放电一段时间后,
溶液的 pH 将 (填“增大”、“减小”或“不变”)。
- 充电电池实现了化学能与电能间的相互转化。磷酸铁锂电池是一种将锂嵌入碳材料,以含 Li+导电固体为电解质的充电电池,电池反应式为:
(5) 请写出该电池放电时的正极反应式: 。
- (14 分)在容积为 2L 的恒温密闭容器中,充入一定量的反应物发生化学反应,各物质
(B 为固体,其余物质均为气体)的含量随时间的变化如图所示,请回答下列问题:
(1) 该反应的化学方程式为: ,
0~2min 内用D 表示化学反应速率v(D)= ,A 的转化率为 。
(2) 用同一物质表示化学反应速率,则 0~2min 的化学反应速率 v(0~2min)与 2~3min 的化学反应速率 v(2-3min)相比较:v(0~2min) v(2-3min)(填“>”、“=”或 “ < ” )。 若 反 应 条 件 不 改 变 , 则 在 2~3min 发 生 该 变 化 的 原 因 可 能为 。
(3) 第 2min 时 v 逆(A) (填“>”、“=”或“<”)第 3min 时 v 正(A)。
(4) 反应达到平衡状态时混合气体的压强与起始时的压强之比为 。
(5) 下列关于该反应的速率和平衡状态的描述正确的是 。
- 恒容条件下通入惰性气体,反应速率增大
- 恒容条件下增加任一反应物的物质的量,反应速率增大
- 单位时间内每消耗 4a mol A,同时生成 5a mol B,反应一定达到平衡状态
- 混合气体的密度不再改变时,反应一定达到平衡状态
- 2v 正(A) = 3 v 逆(C)时,反应一定达到平衡状态
- 当 c(A):c(C):c(D)=2:3:2 时,反应一定达到平衡状态
- (16 分)NH3 既是一种化工产品,同时也是重要的化工原料。以氨气作原料可制备叠氮化钠(NaN3)——可用于合成抗生素头孢菌素药物和汽车安全气囊的气源。
- 制备 NaN3。
实验室中制备NaN3 分 2 步进行:①制备氨基钠:2Na+2NH3 2NaNH2+H2 ,装置如图甲。已知氨基钠极易与水剧烈反应生成 NH3,且易被空气氧化。②制备叠氮化钠:将得到的NaNH2 与 N2O 在 210-220°C 的条件下反应生成 NaN3、NaOH 和 NH3。
(1) 实验开始时,应先 (填“加热 C”或“打开 A 中活塞”),其目的是 。
(2)B 装置中药品可选 。
A.无水硫酸铜 B.无水氯化钙 C. P2O5 D.碱石灰
(3)若无 B 装置,C 中生成的氨基钠会发生的化学方程式为 。
(4)D 装置中长导管不伸入液面的目的是 。
(5) 某同学认为上述实验装置设计不合理,请提出改进措施 。
(6) 用化学方程式说明制备叠氮化钠的反应容器不用玻璃材质的原因是 。
- 测定 NaN3 的纯度。
利用图乙装置,通过倾斜锥形瓶,使小试管中 0.1000g NaN3 样品与足量的 NaClO 溶液接触并充分反应,测量产生的无色无味且无毒气体的体积 (不考虑溶剂的挥发)。已知:反应中放出大量的热。
(7) 反应后对水量气管读数时,正确的操作步骤是 。
①视线平视水量气管凹液面读数;②冷却至室温;③调节量气管和水准瓶中液面相平
(8) 室温下测得气体体积为 35.00mL(该气体密度为 1.2g/L),该样品的纯度(质量分数)为 。
河北省保定市六校联盟2022-2023学年高一下学期期中联考化学试题(Word版含答案): 这是一份河北省保定市六校联盟2022-2023学年高一下学期期中联考化学试题(Word版含答案),共13页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2021-2022学年湖北省六校新高考联盟高一(下)联考化学试卷(4月)(含答案解析): 这是一份2021-2022学年湖北省六校新高考联盟高一(下)联考化学试卷(4月)(含答案解析),共19页。试卷主要包含了8gNa2O2,转移电子数为0等内容,欢迎下载使用。
2021合肥六校联盟高一下学期期末联考化学试题PDF版含答案: 这是一份2021合肥六校联盟高一下学期期末联考化学试题PDF版含答案,文件包含211734D-化学pdf、211734D-化学dapdf等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。












