




2022年中考化学第一轮系统复习---专题2酸碱盐的化学性质课件PPT
展开1. (2019福建)十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )A. NaHCO3 B. Na2CO3 C. NaCl D. NaOH
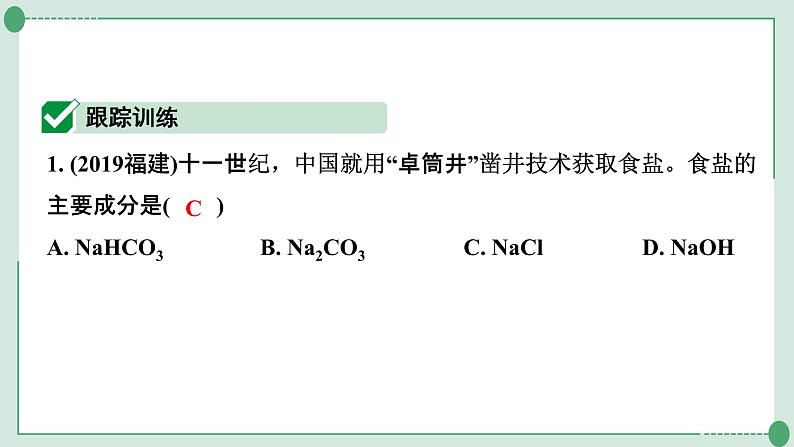
2. (2021三明5月质检)往石灰水中先滴加稀盐酸,然后滴加碳酸钠溶液,溶液pH的部分变化如图所示。下列分析正确的是( )A. ab段的反应现象是产生沉淀B. b点时,溶液中可能有HCl或Na2CO3,但不可能两种都有C. c点时,溶液中没有发生化学反应D. d点时,溶液中的溶质为Na2CO3、NaCl、CaCO3
3. (2019福建)t ℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的pH>7。关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2的溶解度随温度升高而减小;②Ca(OH)2与空气中的CO2反应。他们设计以下方案进行探究,其中没有意义的是( )A. 将装有浊液的烧杯,用冰水冷却,恢复至t ℃,观察浑浊是否消失B. 取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生C. 取适量浊液,过滤,往滤液中加入Na2CO3溶液,观察是否有沉淀生成D. 其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
4. (2021嘉兴)如图所示为小嘉构建的甲、乙、丙、丁四种不同物质的关系图,“——”表示相邻的两种物质能发生反应。若甲为铁,乙、丙、丁分别是稀H2SO4、CuCl2溶液、NaOH溶液中的任意一种,则下列判断错误的是( )A. 乙可能是CuCl2溶液B. 丙一定是NaOH溶液C. 丁一定是稀H2SO4D. 丙不可能是稀H2SO4
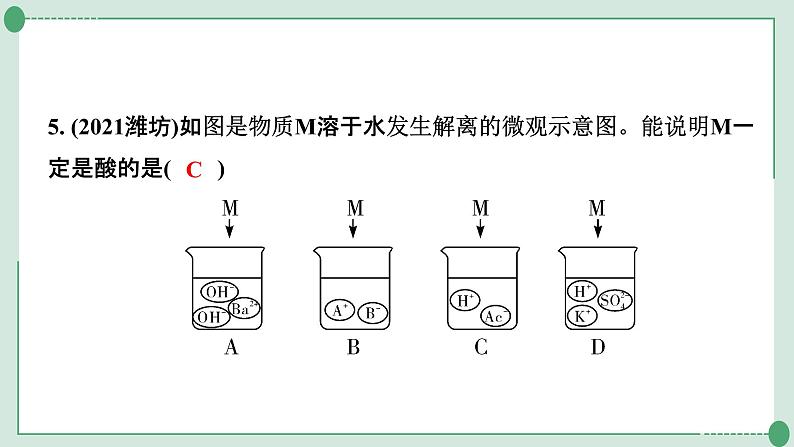
5. (2021潍坊)如图是物质M溶于水发生解离的微观示意图。能说明M一定是酸的是( )
6. [传统文化](2021重庆B卷)北宋沈括在《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾(硫酸铜晶体)。熬胆矾铁釜,久之亦化为铜”。下列叙述错误的是( )A. “苦泉”的溶质之一 —— CuSO4B. “挹其水熬之” —— 蒸发溶剂C. “熬胆矾铁釜,久之亦化为铜” —— 发生置换反应D. 将浓缩的“苦泉”与NaOH溶液混合 —— 制农药波尔多液
7. (2021连云港)常温下,通过下列实验探究Ca(OH)2的性质: 步骤一:向两支试管中分别加入0.2 g Ca(OH)2粉末,然后各加入2 mL水,振荡后静置,试管底部有粉末,溶液呈无色。步骤二:向两支试管中再各滴入2滴酚酞溶液,振荡后静置,溶液由无色变为红色,试管底部粉末无明显变化。 步骤三:继续向其中一支试管中加入2 mL水,振荡后静置,无明显变化;向另一支试管中加入2 mL稀盐酸,振荡后静置,溶液由红色变为无色,试管底部的粉末消失。
下列说法正确的是( )A. 步骤一说明常温下Ca(OH)2不溶于水B. 步骤二中溶液变红是因为Ca(OH)2在水溶液中解离出Ca2+C. 步骤三中消失的Ca(OH)2固体溶解在稀盐酸所含的水中D. 步骤三中溶液由红色变为无色的原因是Ca(OH)2+2HCl === CaCl2+2H2O
8. (2021天津)盛有下列物质的容器敞口放置在空气中一段时间后,容器内物质质量减少的是( )A. 铁钉 B. 浓盐酸C. 生石灰 D. 浓硫酸
9. (福建真题组合)下列说法正确的是_____(填序号)。①熟石灰显碱性,故可用来改良酸性土壤。(2020.6C)②盐酸能与活泼金属反应,故可用来除铁锈。(2018.7D)③小苏打能与酸反应,故可用于治疗胃酸过多。(2018.7C)
10. (2021山西)如图,长方形相邻顶点的物质间可发生反应。A、B、C为三种不同类别的物质,它们与各自长方形顶点上其他物质的类别不同。A的固体常作制冷剂。分析1:A与氢氧化钡溶液发生反应的现象是_____________________________。
有白色沉淀生成(或溶液变浑浊)
分析2:B与氢氧化钙反应的化学方程式为______________________________________________________________________________。分析3:C的物质类别是________________,它与稀硫酸反应的化学方程式为__________________________________________________________。
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH[或CuSO4+Ca(OH)2 === CaSO4+Cu(OH)2↓等]
Fe+H2SO4 === FeSO4+H2↑(或Mg+H2SO4 === MgSO4+H2↑等)
11. [知识迁移](2021衡阳)在化学学习和研究中有很多规律可循。应用规律可以让我们获取新知识。(1)碱性强弱规律:大量实验证明:金属越活泼,其对应的碱的碱性越强(碱的碱性强弱与碱的溶解性无关)。下列关于碱性强弱判断正确的是___(填字母序号)。A. KOH>NaOH>Ca(OH)2B. KOH>Ca(OH)2>NaOHC. NaOH>Ca(OH)2>KOH
(2)强酸制备弱酸规律:较强酸能制备较弱酸。已知酸性强弱:HCl >H2SO3>H2CO3>H2S,则下列反应不可能发生的是___(填字母序号)。A. K2CO3+2HCl === 2KCl + H2O+CO2 ↑B. Na2SO3+2HCl === 2NaCl + H2O+SO2↑C. Na2CO3+H2S === Na2S + H2O+CO2
12. (2017福建)如图是包含物质A、B、C、D和盐酸卡片的“化学拼图”,相邻两张卡片所标的物质(或其溶液)间能发生反应。(1)A不可能是___(填标号)。a. Mg b. Fe c. Ag d. Zn(2)若B为铁锈的主要成分Fe2O3,B与盐酸反应的化学方程式为________________________________。
Fe2O3+6HCl === 2FeCl3+3H2O
(3)若C为碳酸钠①C与D的反应属于__________(填基本反应类型);②D与盐酸反应的化学方程式为__________________________________________________________________(写一个);③将二氧化碳通入C溶液,可化合生成碳酸氢钠(NaHCO3),该反应的反应物有___种。
Ca(OH)2+2HCl=== CaCl2+2H2O[或Ba(OH)2+2HCl=== BaCl2+2H2O]
13. (2019福建)用如图所示装置模拟废液(含CuSO4、MgSO4及一些不溶物)净化实验,步骤如下:Ⅰ往沉降槽中加入适量絮凝剂(混凝剂)甲,加速沉降;Ⅱ往反应槽中缓慢加入一定浓度的NaOH溶液,至沉淀完全;Ⅲ通过盛装有活性炭的水槽后,调节溶液的pH=7,储存在指定容器中。
(1)测得原废液pH=5,显_____(填“酸性”“碱性”或“中性”)。(2)甲是_____(写物质名称);操作X可使固体与液体分离,操作X是_____;活性炭的作用是_____。(3)反应槽中生成沉淀的化学方程式为______________________________________________________________________________(写一个)。
CuSO4+ 2NaOH === Na2SO4+Cu(OH)2↓[或MgSO4+2NaOH=== Na2SO4+Mg(OH)2↓]
14. 如图,四支试管分别盛有某浓度的盐酸、碳酸钠、氯化钡、氢氧化钠溶液中的一种。①向A试管滴入酚酞溶液后,溶液变红色。②接着将A试管液体倒入B试管,观察到溶液变为无色。③再将B试管液体倒入C试管,观察到有气泡产生,溶液呈红色。④最后将C试管液体倒入D试管,观察到有白色沉淀产生,溶液呈无色。回答下列问题:
(1)步骤②发生反应的化学方程式是____________________________。(2)步骤②得到的B试管溶液中含有的溶质为:酚酞、____________。(3)步骤③产生的气体是________________。(4)步骤④D试管中产生白色沉淀,该白色沉淀是________________。
NaOH+HCl === NaCl+H2O
碳酸钡(或BaCO3)
15. (2021抚顺、铁岭改编)化学兴趣小组的同学在验证硫酸的性质时,进行了以下实验。【实验一】浓硫酸稀释过程中的能量变化图一实验中观察到用石蜡固定在铜片下的乒乓球脱落,此现象说明浓硫酸溶于水时_____。
【实验二】溶液浓度对硫酸化学性质的影响图二实验中,观察到很快变黑的是滤纸___(填“A”或“B”),由此可知,硫酸溶液的浓度不同,腐蚀性不同。【实验三】稀硫酸的化学性质小组同学按图三进行实验。(1)试管1中发生反应的化学方程式为__________________________。(2)试管2中可观察到的现象是_____________________________________。
Zn+H2SO4 === ZnSO4+H2↑
红棕色粉末逐渐溶解,溶液由无色变成黄色
(3)向试管3中滴加了足量的稀硫酸仍无明显现象,要证明二者已经发生了反应,可选用____(填字母序号)继续进行实验,以达到实验目的。A. 酚酞溶液 B. 氯化钡溶液 C. 硫酸铜溶液(4)向试管4反应后的溶液中滴加无色酚酞溶液,溶液变红,则此时溶液中含有的溶质是_______________。(5)某同学推测试管5中并未发生反应,原因是_____________________。
K2CO3、K2SO4
16. (2021营口)如图为初中化学中关于酸、碱、盐化学性质的知识框架图,X、Y是除酸、碱、盐之外的不同类别的物质,据图回答问题:(1)X的物质类别是___________;(2)若“盐1”为AgNO3,则反应③的化学方程式为___________________________(任写一个);(3)反应④能够发生应该满足的条件是______________________________;(4)在反应①②③④中,属于中和反应的是___。
Fe+2AgNO3 === 2Ag+Fe(NO3)2
反应物均溶于水,生成物中有沉淀
17. (2021福建节选)为方便推测某些复杂物质的化学性质,可将其化学式改用常见物质的化学式表示。如碱式碳酸铜[Cu2(OH)2CO3]可改写为Cu(OH)2·CuCO3,推测其兼具Cu(OH)2和CuCO3的化学性质。(1)举重运动员常用碱式碳酸镁[Mg2(OH)2CO3]粉末抹在手掌以增大摩擦力。①参照上述方法,碱式碳酸镁的化学式可改写为________________。②该物质兼具___(填“酸”或“碱”)和碳酸盐的化学性质。
Mg(OH)2·MgCO3
(2)某种茶垢清洁剂的主要成分为过碳酸钠(可表示为2Na2CO3·3H2O2)。将过碳酸钠溶解于热水中,有大量气泡产生,其原因是___________________;当不再产生气泡后,往溶液中加入足量澄清石灰水,反应的化学方程式为_____________________________________。
Ca(OH)2+Na2CO3 === CaCO3↓+2NaOH
(3)岩石、矿物的结构复杂,其成分可用氧化物的化学式来表示:如硅酸钙CaSiO3可表示为CaO·SiO2,试用氧化物的化学式表示下列矿物质的成分:①石棉 CaMg3Si4O12:_________________;②白云母K2Al6Si6(OH)8O18 :______________________。
CaO·3MgO·4SiO2
K2O·3Al2O3·6SiO2·4H2O
18. (2021恩施州)图1是关于氢氧化钠化学性质的思维导图,请据图回答问题。(1)性质①,将无色酚酞溶液滴入氢氧化钠溶液中,溶液呈___色。(2)性质②,将氢氧化钠溶液滴入稀盐酸中。图2表示该反应过程中溶液pH的变化曲线,n点溶液中的溶质是_____________(填化学式)。
(3)依据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为_____________________________。(4)性质④,将氢氧化钠固体和某种盐混合研磨,能放出有刺激性气味的气体。推测这种盐可能是____。
SO2+2NaOH === Na2SO3+H2O
19. (2021宁夏)及时归纳是学好化学的主要方法之一。利用如图所示的结构图归纳盐的四个方面的化学性质(图中编号①~④),请归纳有关知识。(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是_____________,化学方程式为_________________________________________。
2NaOH === Na2SO4+Cu(OH)2↓
(2)在性质③中,X代表____类物质。(3)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学式_______________________(写一个)。
NaCl(或其他可溶性氯盐)
一、酸的化学性质(酸五条)①酸能使紫色石蕊溶液_____,不能使无色酚酞溶液变色。
②酸+活泼金属 → 盐+氢气a. 盐酸和铁:________________________(写化学方程式,后同),现象:_________________________________;b. 盐酸和铝:__________________________;c. 硫酸和锌:__________________________;
Fe+2HCl === FeCl2+H2↑
有气泡产生,溶液由无色变成浅绿色
2Al+6HCl === 2AlCl3+3H2↑
③酸+金属氧化物 → 盐+水a. 盐酸和氧化铁(用于金属除锈):______________________________;b. 硫酸和氧化铁(用于金属除锈):_________________________________;c. 盐酸和氧化铜:____________________________;d. 硫酸和氧化铜:____________________________。
Fe2O3+6HCl === 2FeCl3+3H2O
Fe2O3+3H2SO4 === Fe2(SO4)3+ 3H2O
CuO+2HCl === CuCl2+ H2O
CuO+H2SO4 === CuSO4+H2O
④酸+碱 → 盐+水a. 盐酸和氢氧化钠:___________________________;b. 硫酸和氢氧化钠:________________________________;c. 盐酸和氢氧化钙:_______________________________。⑤酸+盐 → 新酸+新盐a. 盐酸和碳酸钠:____________________________________;b. 盐酸和碳酸氢钠:___________________________________。
HCl+NaOH === NaCl+H2OH2SO4+2NaOH === Na2SO4+2H2O2HCl+Ca(OH)2 === CaCl2+2H2O
Na2CO3+2HCl === 2NaCl+CO2↑+H2O NaHCO3+HCl === NaCl+CO2↑+H2O
【总结】不同的酸具有共性的原因是_______________________________;不同的酸具有“个性”的原因是___________________,如盐酸能与硝酸银溶液反应,而硫酸不能与硝酸银溶液反应;硫酸能与氯化钡溶液反应,而盐酸不能与氯化钡溶液反应。
在水溶液中解离出的阳离子都是H+
【知识补充】常见酸的其他性质及用途
碳酸氢钠(或NaHCO3)
二、碱的化学性质(碱四条)①碱能使紫色石蕊溶液____,使无色酚酞溶液____。
②碱+某些非金属氧化物 → 盐+水a. 氢氧化钠溶液和二氧化碳(吸收二氧化碳):_______________________________;b. 氢氧化钙溶液和二氧化碳(检验二氧化碳):__________________________________(现象:__________________________________)。
2NaOH+CO2 === Na2CO3+H2O
Ca(OH)2 +CO2 === CaCO3↓+H2O
有白色沉淀生成(或澄清石灰水变浑浊)
③碱+酸 → 盐+水a. 氢氧化钠和稀盐酸:___________________________;b. 氢氧化钙和稀硫酸(改良酸性土壤、处理酸性废水): _________________________________;c. 氢氧化铝和稀盐酸(用于治疗胃酸过多):___________________________。
HCl+NaOH === NaCl+H2O
H2SO4+Ca(OH)2 === CaSO4+2H2O
Al(OH)3+3HCl === AlCl3+3H2O
④碱+盐 → 新盐+新碱a. 氢氧化钠溶液和氯化镁溶液: __________________________________(现象:______________);b. 氢氧化钙溶液和硫酸铜溶液(配制农药波尔多液): _______________________________________(现象:______________)。【总结】不同的碱具有通性的原因是_______________________________;不同的碱具有“个性”的原因是___________________,如氢氧化钙能与碳酸钠溶液发生反应,而氢氧化钠不能与碳酸钠溶液发生反应。
2NaOH+MgCl2 === Mg(OH)2↓+2NaCl
CuSO4+Ca(OH)2 === CaSO4+Cu(OH)2↓
在水溶液中解离出的阴离子都是OH-
【知识补充】常见碱的其他性质及用途
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
CaO+H2O === Ca(OH)2
三、盐的化学性质1. 盐的定义:指一类组成里含有金属离子(或铵根离子)和________的化合物。2. 盐的化学性质 ①盐+金属(K、Ca、Na除外) → 新盐+新金属a. 铁和硫酸铜溶液:__________________________;b. 铜和硝酸银溶液:______________________________。
Fe+CuSO4 === FeSO4+Cu
Cu+2AgNO3 === Cu(NO3)2+2Ag
②盐+酸 → 新盐+新酸a. 稀硫酸和碳酸钠: ______________________________________;b. 稀盐酸和碳酸氢钠(用于治疗胃酸过多): ____________________________________。③盐+碱 → 新盐+新碱a. 氢氧化钙和碳酸钠溶液:______________________________________(现象:_______________);b. 氢氧化钠和硫酸铜溶液:_____________________________________(现象:_______________)。
Na2CO3+H2SO4 === Na2SO4+CO2↑+H2O
NaHCO3+HCl === NaCl+ CO2↑+H2O
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
2NaOH+CuSO4 === Cu(OH)2↓+Na2SO4
④盐1+盐2 → 新盐1+新盐2a. 碳酸钠和氯化钡溶液:__________________________________(现象:_______________);b. 硝酸银和氯化钠溶液:________________________________(现象:_______________)。
BaCl2+Na2CO3 === BaCO3↓+2NaCl
NaCl+AgNO3 === AgCl↓+NaNO3
【知识补充】常见盐的其他性质及用途
初中人教版第十单元 酸和碱实验活动6 酸、碱的化学性质复习ppt课件: 这是一份初中人教版第十单元 酸和碱实验活动6 酸、碱的化学性质复习ppt课件,共18页。PPT课件主要包含了投石问路,我想有个家,牵手“酸碱盐”,活动一酸的化学性质,活动二碱的化学性质,活动三盐的化学性质,我来设计,学以致用,课堂小结,手掌记忆法等内容,欢迎下载使用。
2022年中考化学第一轮系统复习专题10 常见气体的制取课件PPT: 这是一份2022年中考化学第一轮系统复习专题10 常见气体的制取课件PPT,共52页。PPT课件主要包含了酒精灯,氧气不易溶于水,AHE或,AHF,t2~t3,集气瓶,B或C,控制反应速率,长颈漏斗,在试管口塞一团棉花等内容,欢迎下载使用。
2022年中考化学第一轮系统复习专题5 物质的除杂课件PPT: 这是一份2022年中考化学第一轮系统复习专题5 物质的除杂课件PPT,共19页。PPT课件主要包含了BaCl2,BaOH2等内容,欢迎下载使用。












