2022年高考化学三轮冲刺之回归教材07 图像数据和结果的分析练习题
展开回归教材重难点07 图像数据和结果的分析
高考五星高频考点,2021年全国甲卷第12题、2021年全国乙卷第13题、2020年全国I卷第13题、、2019年全国I卷第10题、2019年全国I卷第11题、2019年全国II卷第12题。
图像、图表穿插于教材之中。图表是高考试题的数字化语言,用图表表述化学反应过程或者呈现信息情景是近几年高考化学综合试题常见的表达方式。数形结合的试题具有简明、直观、形象的特点,是近年来高考的热点题型。而多变量图像题还具有信息量大、可随意调控试题难度等特点,能够很全面地考查学生分析、比较、概括和归纳问题的能力,因此备受命题者青睐。纵观近几年的高考化学试题,每年都有试题以图表方式呈现相关实验结果及化学信息,要求学生在获取信息后对相关化学现象、事实作出合理解释,在推理基础上作出合理的判断或得出正确的结论。试题的新颖度、难度和区分度在一定程度上都借助于图表的创新得以体现,这也是新课程高考的重要特点之一。所以,图文转化能力是学生适应高考的必备能力。
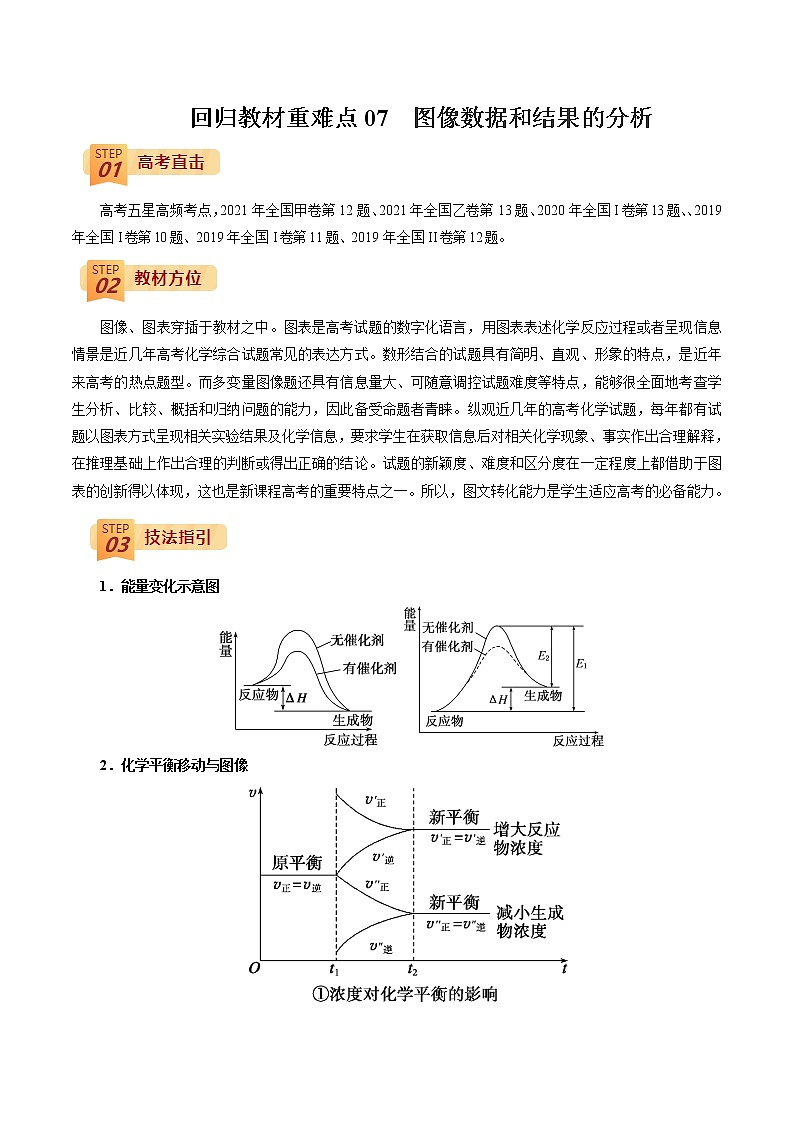
1.能量变化示意图
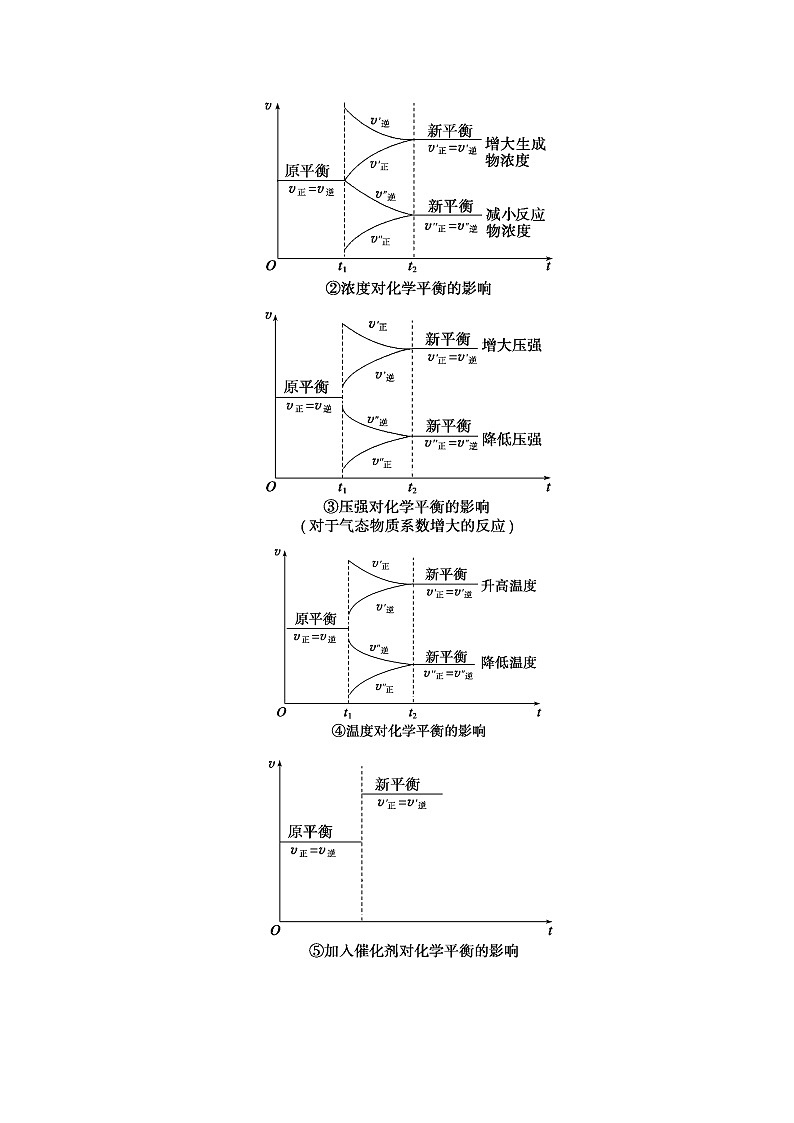
2.化学平衡移动与图像
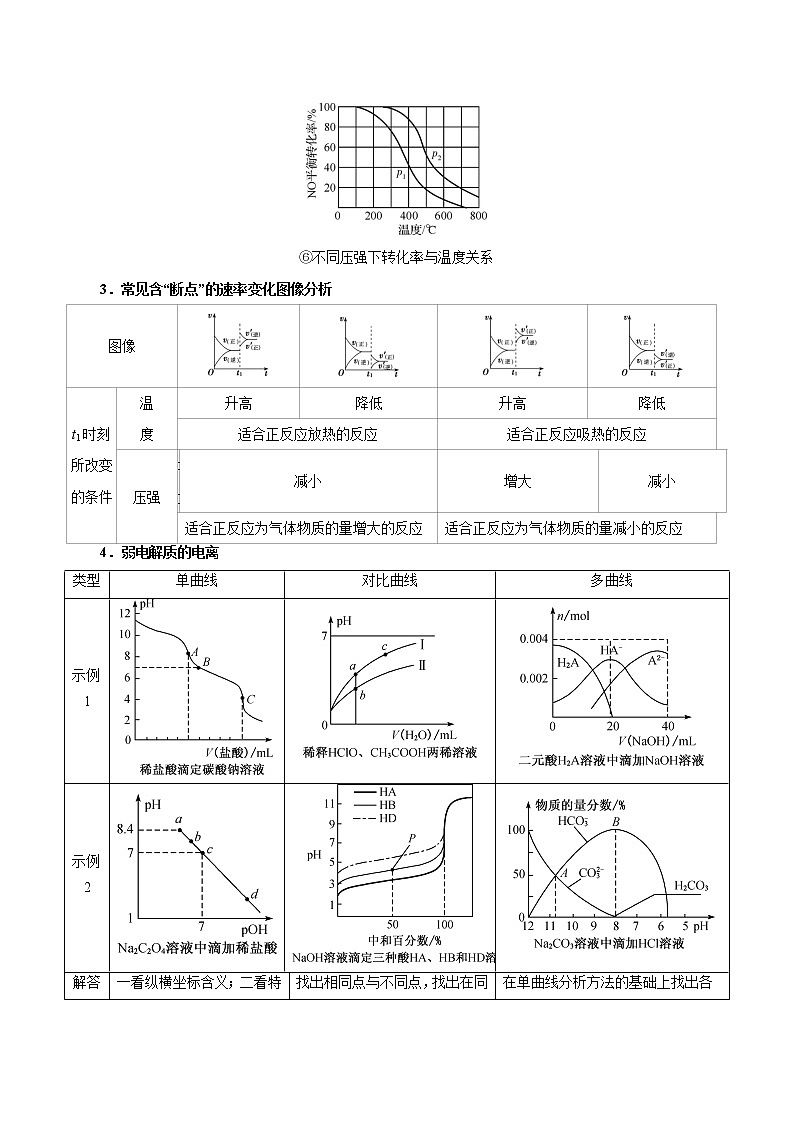
⑥不同压强下转化率与温度关系
3.常见含“断点”的速率变化图像分析
图像
t1时刻所改变的条件
温
度
升高
降低
升高
降低
适合正反应放热的反应
适合正反应吸热的反应
压强
增大
减小
增大
减小
适合正反应为气体物质的量增大的反应
适合正反应为气体物质的量减小的反应
4.弱电解质的电离
类型
单曲线
对比曲线
多曲线
示例1
示例2
解答
要点
一看纵横坐标含义;二看特殊点(起点、拐点、落点);三看变化趋势(规律)
找出相同点与不同点,找出在同一条件下两种曲线之间的差别与联系
在单曲线分析方法的基础上找出各种曲线的差别,分析变化对应的化学原理(物质)。尤其注意分析交点
5.弱电解质分布系数图
分布曲线是指以pH为横坐标,分布系数即组分的平衡浓度占总浓度的分数为纵坐标,即分布系数与溶液pH之间的关系曲线。
举例
一元弱酸(以CH3COOH为例)
二元酸(以草酸为例)
三元酸(以H3PO4为例)
弱电解
质分布
系数图
δn
δ0、δ1分别为CH3COOH、CH3COO-分布系数
δ0为H2C2O4分布系数、δ1为HC2O分布系数、δ2为C2O分布系数
δ0为H3PO4分布系数、δ1为H2PO分布系数、δ2为HPO分布系数、δ3为PO分布系数
当pH
当溶液的pH=1.2时δ0=δ1,pH=4.2时δ1=δ2;当pH<1.2时,H2C2O4占优势;在1.2
当溶液的pH=2时δ0=δ1,pH=7.1时δ1=δ2,pH=12.2时δ2=δ3;当pH<2时, H3PO4占优势;在2
离子
方程式
pH由2到6发生反应的离子方程式:
pH由4到6发生反应的离子方程式:
pH由11到14发生反应的离子方程式:
求lg K
K(CH3COOH)=,从图可知,c(CH3COO-)=c(CH3COOH) 时pH=pKa =4.76,K(CH3COOH)=c(H+)=10-4.76,
K2( H2C2O4)=,从图可知,c(C2O)=c(HC2O) 时pH=4.2,K2=c(H+)=10-4.2,
K3(H3PO4)=,从图可知,c( HPO)=c( PO) 时pH=12.2,K3=c(H+)=10-12.2,
6.化学平衡图像的解题思路和方法
7.巧妙利用“关键点”突破离子图像问题
(1)抓反应“一半”点,判断是什么溶质的等量混合。
(2)抓“恰好”反应点,生成什么溶质,溶液呈什么性,是什么因素造成的。
(3)抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足。
(4)抓反应“过量”点,溶质是什么,判断谁多、谁少还是等量。
1.(2021•湖南选择性考试)已知:A(g)+2B(g)3C(g)△H<0,向一恒温恒容的密闭容器中充入1mol A和3mol B发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )
A.容器内压强不变,表明反应达到平衡 B.t2时改变的条件:向容器中加入C
C.平衡时A的体积分数φ:φ(Ⅱ)>φ(Ⅰ) D.平衡常数K:K(Ⅱ)<K(Ⅰ)
【答案】BC
【解析】A项,为气体体积不变的反应,反应前后气体的物质的量不变,则压强始终不变,不能判定平衡状态,故A错误;B项,t2时正反应速率瞬间不变,然后增大,可知改变的条件为向容器中加入C,故B正确;C项,t2时加入C,平衡逆向移动,则平衡时A的体积分数φ:φ(Ⅱ)>φ(I),故C正确;D项,平衡常数与温度有关,温度不变,则平衡常数K:K(Ⅱ)=K(Ⅰ),故D错误;故选BC。
2.(2021•河北选择性考试)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M) (k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是
A.0~30min时间段内,Y的平均反应速率为6.67×10-8mol•L-1•min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
【答案】A
【解析】A项,由图中数据可知,30 min时,M、Z的浓度分别为0.300 mol•L-1和0.125 mol•L-1,则M的变化量为0.5 mol•L-1-0.300 mol•L-1=0.200 mol•L-1,其中转化为Y的变化量为0.200 mol•L-1-0.125 mol•L-1=0.075 mol•L-1。因此,0~30 min时间段内,Y的平均反应速率为 ,A不正确;B项,由题中信息可知,反应①和反应②的速率之比为,Y和Z分别为反应①和反应②的产物,且两者与M的化学计量数相同(化学计量数均为1),因此反应开始后,体系中Y和Z的浓度之比等于 ,由于k1、k2为速率常数,故该比值保持不变,B正确; C项,结合A、B的分析可知因此反应开始后,在相同的时间内体系中Y和Z的浓度之比等于=,因此,如果反应能进行到底,反应结束时有 的M转化为Z,即62.5%的M转化为Z,C正确;D项,由以上分析可知,在相同的时间内生成Z较多、生成Y较少,因此,反应①的化学反应速率较小,在同一体系中,活化能较小的化学反应速率较快,故反应①的活化能比反应②的活化能大,D说法正确。故选A。
3.(2021•全国甲卷)已知相同温度下,Ksp(BaSO4)<Ksp(BaCO3)。某温度下,饱和溶液中-lg[c(SO42-)、-lg[c(CO32-)、与-lg[c(Ba2+)]的关系如图所示。
下列说法正确的是( )
A.曲线①代表BaCO3的沉淀溶解曲线
B.该温度下BaSO4的Ksp(BaSO4)值为1.0×10-10
C.加适量BaCl2固体可使溶液由a点变到b点
D.c(Ba2+)=10-5.1时两溶液中
【答案】B
【解析】因BaCO3、BaSO4均为难溶物,饱和溶液中-lg[c(Ba2+)]+{-lg[c(SO42-)]}=-lg[c(Ba2+)×c(SO42-)]=-lg[Ksp(BaSO4)],同理可知溶液中-lg[c(Ba2+)]+{-lg[c(CO32-)]}=-lg[Ksp(BaCO3)],因Ksp(BaSO4)< Ksp(BaCO3),则-lg[Ksp(BaCO3)]<-lg[Ksp(BaSO4)],由此可知曲线①为-lg[c(Ba2+)]与-lg[c(SO42-)]的关系,曲线②为-lg[c(Ba2+)]与-lg[c(CO32-)]的关系。A项,由题可知,曲线上的点均为饱和溶液中微粒浓度关系,由上述分析可知,曲线①为BaSO4的沉淀溶解曲线,故A错误;B项,曲线①为BaSO4溶液中-lg[c(Ba2+)]与-lg[c(SO42-)]的关系,由图可知,当溶液中-lg[c(Ba2+)]=3时,-lg[c(SO42-)=7,则-lg[Ksp(BaSO4)]=7+3=10,因此Ksp(BaSO4)=1.0×10-10,故B正确;C项,向饱和BaSO4溶液中加入适量BaCl2固体后,溶液中c(Ba2+)增大,根据温度不变则Ksp(BaSO4)不变可知,溶液中c(SO42-)将减小,因此a点将沿曲线①向左上方移动,故C错误;D项,由图可知,当溶液中c(Ba2+)=10-5.1时,两溶液中==,故D错误;故选B。
4.(2021•全国乙卷)HA是一元弱酸,难溶盐MA的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,时c2(M+)-c(H+)为线性关系,如下图中实线所示。
下列叙述错误的是( )
A.溶液pH=4时,c(M+)<3.0×10-4 mol·L-1
B.MA的溶度积度积Ksp(MA)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+) =c(A-)+c(OH―)
D.HA的电离常数Ka1(HA)≈2.0×10-4
【答案】C
【解析】A项,由图可知pH=4,即c(H+)=10×10-5mol/L时,c2(M+)=7.5×10-8mol2/L2,c(M+)=mol/L<3.0×10-4mol/L,A正确;B项,由图可知,c(H+)=0时,可看作溶液中有较大浓度的OH-,此时A-的水解极大地被抑制,溶液中c(M+)=c(A-),则Ksp(MA)= c(M+)×c(A-)= c2(M+)=5.0×10-8,B正确;C.设调pH所用的酸为HnX,则结合电荷守恒可知c(M+)+c(H+) =c(A-)+c(OH―)+ nc(Xn-),题给等式右边缺阴离子部分nc(Xn-),C错误;D项,当c(HA)= c(A-)时,由物料守恒知c(A-)+ c(HA)=c(M+),则,,则c2(M+)=5.0×10-8,对应图得此时溶液中c(H+) =2.0×10-4mol/L,,D正确;故选C。
5.(2020•新课标Ⅰ卷)以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数:δ(A2-)=c(A2-)c(H2A)+c(HA-)+c(A2-)]
下列叙述正确的是( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.2000 mol·L−1
C.HA−的电离常数Ka=1.0×10−2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
【答案】C
【解析】根据图像,曲线①代表的粒子的分布系数随着NaOH的滴入逐渐减小,曲线②代表的粒子的分布系数随着NaOH的滴入逐渐增大,粒子的分布系数只有1个交点;当加入40mLNaOH溶液时,溶液的pH在中性发生突变,且曲线②代表的粒子达到最大值接近1;没有加入NaOH时,pH约为1,说明H2A第一步完全电离,第二步部分电离,曲线①代表δ(HA-),曲线②代表δ(A2-),根据反应2NaOH+H2A=Na2A+2H2O,c(H2A)=0.1000mol/L×40mL2×20.00mL=0.1000mol/L。A项,根据分析,曲线①代表δ(HA-),曲线②代表δ(A2-),A错误;B项,当加入40.00mLNaOH溶液时,溶液的pH发生突变,说明恰好完全反应,结合分析,根据反应2NaOH+H2A=Na2A+2H2O,c(H2A)= 0.1000mol/L×40mL2×20.00mL=0.1000mol/L,B错误;C项,根据曲线当δ(HA-)=δ(A2-)时溶液的pH=2,则HA-的电离平衡常数Ka=c(A2-)⋅c(H+)c(HA-)=c(H+)=1×10-2,C正确;D项,用酚酞作指示剂,酚酞变色的pH范围为8.2~10,终点时溶液呈碱性,c(OH-)>c(H+),溶液中的电荷守恒为c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),则c(Na+)>2c(A2-)+c(HA-),D错误;故选C。
6.(2019•新课标Ⅰ卷)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2−的导电能力之和大于HA−的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
【答案】C
【解析】邻苯二甲酸氢钾为二元弱酸酸式盐,溶液呈酸性,向邻苯二甲酸氢钾溶液中加入氢氧化钠溶液,两者反应生成邻苯二甲酸钾和邻苯二甲酸钠,溶液中离子浓度增大,导电性增强,邻苯二甲酸钾和邻苯二甲酸钠为强碱弱酸盐,邻苯二甲酸根在溶液中水解使溶液呈碱性。A项,向邻苯二甲酸氢钾溶液中加入氢氧化钠溶液,两者反应生成邻苯二甲酸钾和邻苯二甲酸钠,溶液中Na+和A2—的浓度增大。由图像可知,溶液导电性增强,说明导电能力与离子浓度和种类有关,故A正确;B项,a点和b点K+的物质的量相同,K+的物质的量浓度变化不明显,HA−转化为A2−,b点导电性强于a点,说明Na+和A2−的导电能力强于HA−,故B正确;C项,b点邻苯二甲酸氢钾溶液与氢氧化钠溶液恰好完全反应生成邻苯二甲酸钾和邻苯二甲酸钠,邻苯二甲酸钾为强碱弱酸盐,A2−在溶液中水解使溶液呈碱性,溶液pH>7,故C错误;D项,b点邻苯二甲酸氢钾溶液与氢氧化钠溶液恰好完全反应生成等物质的量的邻苯二甲酸钾和邻苯二甲酸钠,溶液中c(Na+)和c(K+)相等,c点是继续加入氢氧化钠溶液后,得到邻苯二甲酸钾、邻苯二甲酸钠、氢氧化钠的混合溶液,则溶液中c(Na+)>c(K+),由图可知,a点到b点加入氢氧化钠溶液的体积大于b点到c点加入氢氧化钠溶液的体积,则溶液中c(K+)>c(OH−),溶液中三者大小顺序为c(Na+)>c(K+)>c(OH−),故D正确。
7.(2019•新课标Ⅱ卷)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A. 图中a和b分别为T1、T2温度下CdS在水中的溶解度
B. 图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)
D. 温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
【答案】B
【解析】A项,CdS在水中存在沉淀溶解平衡:CdSCd2++S2-,其溶度积Ksp=c(Cd2+)·c(S2-),在饱和溶液中,c(Cd2+)= c(S2-)=S(溶解度),结合图像可以看出,图中a和b分别表示T1和T2温度下CdS的溶解度,A项正确;B项,CdS的沉淀溶解平衡中的溶度积受温度影响,m、n和p点均在温度为T1条件下所测的对应离子浓度,则其溶度积相同,B项错误;C项,m点达到沉淀溶解平衡,向其中加入硫化钠后,平衡向逆反应方向移动,c(Cd2+)减小,c(S2-)增大,溶液组成由m沿mnp向p方向移动,C项正确;D项,从图像中可以看出,随着温度的升高,溶解的离子浓度增大,则说明CdSCd2++S2-为吸热反应,则温度降低时,q点对应饱和溶液的溶解度下降,溶液中的c(Cd2+)与c(S2-)同时减小,会沿qp线向p点方向移动,D项正确;故选B。
8(2022·广东省汕头市高三教学质量监测)2021年为我国实现碳达峰、碳中和关键的一年,CO2综合利用的技术不断创新。某实验小组研究CO2和CH4反应得到合成气的原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。向体积为1L的密闭容器中充入1molCH4和1molCO2,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。下列有关说法正确的是( )
A.该反应的ΔH<0
B.压强:p2>p1
C.1100℃时,该反应的平衡常数为12.96
D.反应达到平衡后在容器内再充入1molCH4和1molCO2,此时CO2的转化率会增大
【答案】C
【解析】A项,由题干图示可知,压强相同时,温度升高,CO2的转化率增大,说明升高温度平衡正向移动,故该反应的ΔH>0,A错误;B项,由题干图示可知,温度相同时,p2压强下CO2的转化率更大,结合反应方程式CO2(g)+CH4(g) 2CO(g)+2H2(g)可知,增大压强,化学平衡逆向移动,CO2的转化率减小,故压强:p2<p1,B错误;C项,1100℃时,根据三段式分析可知,
该反应的平衡常数为K===12.96,C正确;D项,反应达到平衡后在容器内再充入1molCH4和1molCO2,相当于对容器增大压强,化学平衡逆向移动,故此时CO2的转化率会减小,D错误;故选C。
9.(2021·河南省顶尖名校联盟高三联考)已知在一定温度下,和C在一密闭容器中进行反应BaSO4(s)+4C(s)BaS(s)+4CO(g),CO的平衡浓度(mol/L)的对数与温度的倒数的关系如图所示:
下列说法中正确的是( )
A.该反应的ΔH<0
B.Q点BaSO4的消耗速率大于生成速率
C.温度不变,将R点状态的容器体积缩小,重新达到平衡时,气体的压强增大
D.温度是时,反应的平衡常数为100
【答案】D
【解析】根据反应BaSO4(s)+4C(s)BaS(s)+4CO(g)可知,反应的平衡常数K=c4(CO),结合图像可知,随着的增大而增大,则证明K=c4(CO)随着温度的升高而增大,即反应为吸热反应,图像直线上的点均为平衡点。A项,根据上述分析可知,反应的平衡常数随着T的升高而增大,所以该反应为吸热反应,即ΔH>0,A错误;B项,Q点未达到平衡,其Qc>K,则此时BaSO4的消耗速率小于其生成速率,B错误;C项,温度不变,将R点状态的容器体积缩小,即增大压强,平衡向逆向移动,因为平衡常数K不变,所以CO的平衡浓度不变,气体压强不变,C错误;D项,温度是即时,根据图像数据可知,=0.5,所以c(CO)=100.5,则K=c4(CO)=100,D正确;故选D。
10.(2022·重庆市高三联考)CH4和Cl2反应生成CH3Cl和HCl的反应进程如图所示。
已知总反应分3步进行:
(1)Cl-Cl(g)→2Cl•(g) △H1=+242.7 kJ∙mol−1
(2)CH4(g)+•Cl(g)→•CH3(g)+HCl(g) △H2
(3)•CH3(g)+Cl-Cl(g)→CH3Cl(g)+•Cl(g) △H3
下列有关说法正确的是( )
A.△H2<0
B.第2步的反应速率小于第3步的反应速率
C.根据上述信息,反应中只有C-H键的断裂和C-Cl键的形成
D.CH4(g)+Cl2(g)→CH3Cl(g)+HCl(g) △H=−112.9 kJ∙mol−1
【答案】B
【解析】A项,观察图像知第2步反应是吸热反应,△H2>0,故A错误;B项,第2步的正反应活化能大于第3步的正反应活化能,所以第2步的反应速率小于第3步的,故B正确;C项,反应中还断裂了Cl-Cl键,还形成了H-Cl键,故C错误;D项,根据图中信息•CH3(g)+Cl-Cl(g)→CH3Cl(g)+•Cl(g) △H3=−112.9 kJ∙mol−1,CH4(g)+•Cl(g)→•CH3(g)+HCl(g) △H2>0,因此CH4(g)+Cl2(g)→CH3Cl(g)+HCl(g) △H>−112.9 kJ∙mol−1,故D错误;故选B。
11.(2022·广东省高考研究会高考测评研究院高三调研)化学反应2IClI2+Cl2,Kp可分为以下两步:
① ;
② 。
经测定和计算,得到和均为线性关系,如下图所示,已知反应②是吸热反应。则下列说法正确的是( )
A.NOCl是化学反应2IClI2+Cl2的催化剂
B.图②代表
C.
D.当时,表明可逆反应2IClI2+Cl2达到了平衡状态
【答案】B
【解析】A项,NOCl在反应①中是生成物,在反应②中是反应物,所以NOCl是总反应的中间体,不是催化剂,A错误;B项,因反应②是吸热反应,Kp随温度的升高而增大,T增大,1/T减小,B正确;C项,①+②得总反应,所以Kp=Kp1×Kp2,C错误;D项,速率之比等于化学计量数之比,时反应达到平衡,D错误;故选B。
12.(2022·江苏省百校大联考高三第二次考试)在一定的温度和压强下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。已知:
CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-165kJ·mol-1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41kJ·mol-1
催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测CO2转化率和生成CH4选择性随温度变化的影响如图所示。
已知:CH4选择性=×100%
下列有关说法正确的是( )
A.在260℃~320℃间,以Ni-CeO2为催化剂,升高温度CH4的产率不变
B.延长W点的反应时间,一定能提高CO2的转化率
C.选择合适的催化剂,有利于提高CO2的转化率
D.高于320℃后,以Ni为催化剂,随温度的升高CO2转化率上升的原因是平衡正向移动
【答案】C
【解析】A项,在260℃~320℃间,升高温度CH4的选择性基本不变,但CO2的转化率在上升,所以CH4的产率上升,A错误;B项,W点可能是平衡点,延长时间不一定能提高CO2的转化率,B错误;C项,由图可知,使用不同的催化剂,CO2的转化率不同,C正确;D项,图示对应的时间内以Ni为催化剂,明显低于相同温度下Ni-CeO2为催化剂的转化率,一定未达平衡,高于320℃后,随温度的升高CO2转化率上升的原因是催化剂活性增大,反应速率加快,D错误。故选C。
13.(2022·河南省部分重点中学高三调研考试)多个专家研究组经过通力合作,设计了双单原子协同催化剂,该催化剂在协同作用下不仅可以最大程度上提高原子利用率,而且可以提高催化剂的选择性。4—硝基苯乙烯选择性加氢反应制备乙烯苯胺的反应如图,下列说法中错误的是( )
A.Ir单原子位点促进氢气的活化,Mo和Ir的协同作用改变催化剂选择性
B.从图示的催化过程可以发现,Mo单原子位点对4—硝基苯乙烯有较好的吸附效果
C.在双单原子催化剂作用下,可以提高4—硝基苯乙烯的平衡转化率
D.使用双单原子催化剂时,可以大大减少副反应的发生,提高乙烯苯胺的产率
【答案】C
【解析】A项,Ir单原子位点促进氢气的活化,产物有的3种且比例接近,Mo和Ir的协同作用改变催化剂选择性,生成选择性为96%的其中一种,A正确;B项,从图示的催化过程可以发现,Mo单原子位点对4—硝基苯乙烯有较好的吸附效果,选择性为96%,B正确;C项,催化剂不能改变平衡移动,故不能提高4—硝基苯乙烯的平衡转化率,C错误;D项,根据图示可知双单原子的催化剂选择性为96%,大于单原子催化剂的37%选择性,可以大大减少副反应的发生,提高乙烯苯胺的产率,D正确;故选 C。
14.(2022·重庆市巴蜀中学高三适应性考试)温度为T℃,向体积不等的恒容密闭容器中分别加入nmolC4H10气体,发生反应:C4H10(g) C4H8(g)+H2(g)。经过相同的反应时间,测得各容器中C4H10的转化率与容器体积的关系如图所示:
下列说法正确的是( )
A.容器内的压强:pa:pb=7:9
B.由图可知,a、c两点的逆反应速率:c>a
C.向b点平衡体系中再充入一定量的C4H10气体,重新达到平衡时,C4H10的体积分数比原平衡小
D.V1:V2=1:12
【答案】C
【解析】A项,a点时NO2的转化率为40%,a点反应三段式为:
n=0.6n+0.4n+0.4n=1.4n,同理b点时NO2的转化率为80%,此时n=0.2n+0.8n+0.8n=1.8n,由pV=nRT可知,PaV1=1.4nRT,PbV2=1.8nRT,:Pa:Pb=7 V2:9 V1,由于V2>V1,所以容器内的压强:Pa:Pb>7:9,故A错误;B项,图中a点、c点NO2的转化率相同,但a点容器体积小于c点容器体积,则对应的生成物浓度:a>c,则逆反应速率:a>c,B错误;C项,恒温恒容下,向b点平衡体系中再充入一定量的C4H10气体,对于只有一个反应物的平衡而言相当于增大压强,由反应:C4H10(g)C4H8(g)+H2(g),正反应方向为气体分子数增大,则平衡逆向移动,C4H10的量增多,但加入的C4H10气体不能完全转化,则重新达到平衡时,C4H10的体积分数比原平衡小,C正确;D项,由于b点C4H10的转化率比a点大,a点至b点可看作在恒温恒压下,通过增大体积来减压使平衡正向移动,C4H10的转化率增大,由A选项可知na=1.4n,nb=1.8n,由pV=nRT可知V1:V2= na:nb=1.4:1.8=7:9,D错误;故选C。
15.(2022·江苏省海门区高三第二次诊断测试)甲醛中木材加工、医药等方面有重要用途。甲醇利用脱氢法可制备甲醛,主要反应为:CH3OH(g)HCHO(g)+H2(g) ∆H=+85.2kJ∙mol-1。Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程ⅰ:
历程ⅱ:
历程ⅲ:
历程ⅳ:
如图所示为在体积2L的恒容容器中,投入1molCH3OH,在碳酸钠催化剂作用下,经过5min反应,测得甲醇转化率与甲醛的选择性与温度的关系(甲醛的选择性:转化的CH3OH中生成HCHO的百分比),下列有关说法正确的是( )
A.600℃时,前5min内生成甲醛的平均速率v(HCHO)=0.055mol·L-1·min-1
B.700℃时,反应历程ⅱ的速率小于反应历程ⅲ的速率
C.脱氢法制甲醛中,在高温高压条件下更有利于提高平衡产率
D.反应历程ⅰ的活化能大于CH3OH(g)HCHO(g)+H2(g)的活化能
【答案】B
【解析】A项,由图可知,600℃时甲醇转化率为55%、甲醛的选择性为60%,则前5min内生成甲醛的平均速率v(HCHO)= =0.033 mol·L-1·min-1,故A错误;B项,由图可知,600℃后,甲醇的转化率增大、甲醛的选择性降低,说明历程ⅲ的反应程度大,相同时间内反应历程ⅱ的速率小于反应历程ⅲ的速率,故B正确;C项,该反应为气体体积增大的吸热反应,增大压强,平衡向逆反应方向移动,甲醛的产率降低,故C错误;D项,使用催化剂,降低反应的活化能,则使用碳酸钠做反应催化剂的反应历程ⅰ的活化能小于CH3OH(g)HCHO(g)+H2(g)的活化能,故D错误;故选B。
16.(2022·广东省高三综合能力测试)已知反应:2X(1)Y(1),取等量X,分别在0℃和20℃下,测得其转化率随时间变化的关系曲线(α-t)如图所示。下列说法正确的是( )
A.曲线Ⅰ代表0℃下X的α-t曲线
B.反应进行到66min时,Y的物质的量为0.113mol
C.该反应ΔH>0
D.加入催化剂,X的平衡转化率升高
【答案】A
【解析】A项,据图可知,平衡前反应相同时间,曲线Ⅰ所示条件下转化率更小,即反应速率更慢,温度越低反应速率越小,所以曲线Ⅰ代表0℃下X的α-t曲线,A正确;B项,据图可知反应进行到66min时,X的转化率为0.113,但初始投料未知,所以无法计算此时Y的物质的量,B错误;C项,曲线Ⅱ所示温度更高,但平衡时X的转化率低,说明升高温度平衡逆向移动,正反应为放热反应,ΔH<0,C错误;D项,催化剂可以加快反应速率,但不能改变平衡转化率,D错误;故选A。
17.(2022·江苏省扬州市高三模拟)丁烷催化脱氢制备丁烯的主反应为C4H10(g)C4H8(g)+H2(g) △H>0,副反应为C4H10裂解生成C1-C3 (表示碳原子数为1~3的烷烃或烯烃)。将C4H10与H2的混合气体以定流速通过填充有催化剂的反应器,C4H8的产率、C4H10的转化率与温度的关系如图所示。下列说法不正确的是( )
A.435℃时C4H8产率低的原因可能是此温度下催化剂活性较低,反应速率较慢
B.600℃以后,C4H8的产率下降原因可能是C4H10发生裂解反应生成C1-C3
C.图中表示C4H8产率的曲线中,A点时主反应不一定达到平衡状态
D.提高丁烷脱氢制备丁烯转化率的研究方向为寻找低温时具有较高活性的催化剂
【答案】D
【解析】A项,题干图示为将C4H10与H2的混合气体以定流速通过填充有催化剂的反应器,C4H8的产率、C4H10的转化率与温度的关系,故435℃时C4H8产率低的原因可能是此温度下催化剂活性较低,反应速率较慢,A正确;B项,根据主反应C4H10(g)C4H8(g)+H2(g) △H>0可知升高温度,平衡正向移动,C4H8的产率增大,图中可知600℃以后C4H8的产率下降,C1-C3的产率增大,故600℃以后,C4H8的产率下降原因可能是C4H10发生裂解反应生成C1-C3,B正确;C项,由B项分析可知,图中表示C4H8产率的曲线中,A点后丁烯的产率下降并不一定是平衡移动的结果,故A点时主反应不一定达到平衡状态,C正确;D项,由于主反应C4H10(g)C4H8(g)+H2(g) △H>0升高温度,平衡正向移动,丁烯的产率增大,且温度高时,将发生副反应,故提高丁烷脱氢制备丁烯转化率的研究方向为寻找高温时具有较高活性和对主反应具有良好选择性的催化剂,D错误;故选D。
18.(2022·辽宁省大连市高三模拟预测)25℃时,用HCl气体调节0.1mol·L−1氨水的pH,体系中粒子浓度的对数值(lgc)、反应物的物质的量之比[]与pH的关系如图所示。若忽略通入气体后溶液体积的变化,下列有关说法正确的是( )
A.25℃时,NH3·H2O的电离平衡常数为10-9.25
B.t=0.5时,2c(H+)+c(NH3·H2O)=c(NH4+)+2c(OH−)
C.P1所示溶液:c(Cl−)=0.05mol·L−1
D.P2所示溶液:c(NH4+)>100c(NH3·H2O)
【答案】D
【解析】A项,NH3·H2O的电离平衡常数K=,据图可知当lgc(NH4+)=lgc(NH3·H2O),即c(NH4+)=c(NH3·H2O)时,溶液pH=9.25,则此时c(OH−)=10-4.75mol/L,所以K=10-4.75,A错误;B项,t=0.5时,溶液中的溶质为等物质的量的NH3·H2O和NH4Cl,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH−)+c(Cl−),存在物料守恒2c(Cl−)=c(NH3·H2O)+c(NH4+),联立可得2c(H+)+ c(NH4+) = c(NH3·H2O) +2c(OH−),B错误;C项,若c(Cl−)=0.05mol·L−1,则此时溶质应为等物质的量的NH3·H2O和NH4Cl,由于NH4+的水解程度和NH3·H2O的电离程度不同,所以此时溶液中c(NH4+)≠c(NH3·H2O),与P1不符,C错误;D项,K==10-4.75,P2所示溶液pH=7,则c(OH-)=10-7,所以==102.25>100,D正确;故选D。
19.(2022·四川省遂宁市高三一诊理科综合)25℃时,向的二元酸H2A溶液中逐滴滴入等浓度的NaOH溶液,测得溶液的pH与lg Y[Y代表或]关系如图。下列相关结论正确的是( )
A.曲线a表示pH与的变化关系
B.25℃时,H2A的Ka2约为10-7.2
C.当溶液的pH=6时,c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH―)
D.滴入20.00mL NaOH溶液时,c(Na+)>c(HA-)>c(OH―)>c(H+)
【答案】B
【解析】根据向H2A溶液中加入NaOH溶液的反应过程可知,H2A越来越少,先生成HA-,在生成A2-,则可知曲线a代表lg随pH的变化,曲线b代表随pH的变化曲线,已知H2AH++HA-,则有Ka1=,根据曲线a可知,Ka1==101.88×10-4=10-2.12,HA-H++A2-,则有Ka2=,根据曲线b可知,Ka2==102.8×10-10=10-7.2。A项,由分析可知,曲线a表示pH与lg的变化关系,A错误;B项,由分析可知,25℃时,H2A的Ka2约为10-7.2,B正确;C项,根据电荷守恒可知,当溶液的pH=6时,c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH―),C错误;D项,滴入20.00mL NaOH溶液时即生成NaHA溶液,由分析可知,Ka2=10-7.2,Kh2===10-11.88,即HA-的电离大于水解,反应后溶液呈酸性,故离子浓度大小关系为:c(Na+)>c(HA-)>c(H+) c(OH―)>,D错误;故选B。
20.(2022·辽宁省名校联盟高三联考)实验室用0.1mol/L的NaOH溶液滴定的HAuCl4溶液。溶液中,含氯微粒a、b的分布系数、NaOH溶液体积V(NaOH)与pH的关系如图所示。[比如HAuCl4的分布系数,]。下列叙述错误的是( )
A.x点对应溶液的pH约为5
B.p点对应的溶液中,2c(H+)-c(HAuCl4)=2c(OH-)-c(AuCl4-)
C.微粒b为AuCl4-,该滴定可选酚酞作指示剂
D.滴定到q点时,溶液中c(HAuCl4)>c(AuCl4-)
【答案】D
【解析】A项,由图像可知,当V((NaOH)=0时,对应溶液的pH=3,此时溶液中的c(H+)=0.001mol·L-1,,x点时,根据图像有c(HAuCl4)= c(AuCl4-),则此时的,,A正确;B项,p点时,V((NaOH)=10mL,根据电荷守恒有:c(H+)+c(Na+)= c(OH-)+ c(AuCl4-),根据物料守恒有:2c(Na+)= c(HAuCl4)+ c(AuCl4-),两式联立方程消去c(Na+),解得:2c(H+)-c(HAuCl4)=2c(OH-)-c(AuCl4-),B正确;C项,随着NaOH的加入,HAuCl4逐渐减少,AuCl4-逐渐增多,结合图像可知,微粒a为HAuCl4,微粒b为AuCl4-,滴定到q点时,V((NaOH)=20mL,两者恰好完全反应,生成NaAuCl4溶液,此时溶液呈碱性,所以选酚酞作指示剂,C正确;D项,滴定到q点时,V((NaOH)=20mL,由图可知c(AuCl4-)>c(HAuCl4),选项D错误;故选D。
21.(2022·河北省石家庄市高三教学质量检测)用强碱滴定某一元弱酸时,弱酸被强碱部分中和后得到“弱酸盐和弱酸”组成的缓冲溶液,其中存在。时,用的溶液滴定某未知浓度的溶液,滴定过程中消耗溶液的体积与混合溶液之间的关系如图所示(已知:,酸性)。
下列说法错误的是( )
A.电离常数的数量级为
B.b点溶液中存在c(A—)+c(OH—)=c(HA)+ c(H+)
C.c点溶液中离子浓度的大小关系为c(A—)>c(HA) >c(H+)>c(OH—)
D.若将改为等体积等浓度的,则随溶液体积的变化曲线竖直上移
【答案】B
【解析】温度不变,酸的电离常数不变,设酸的浓度为cmol/L,由可得:4.27+lg=4.75+lg,整理可得=100.48=3,解得c=0.2,则PKa=4.75+lg(2—1) =4.75,Ka=10—4.75。A项,HA的电离常数Ka=10—4.75,则电离常数的数量级为10—5,故A正确;B项,b点时Ka=c(H+)=10—4.75,由Ka=可得溶液中c(A—)= c(HA),由图可知,b点溶液呈酸性,溶液中c(H+)>c(OH—),则c(HA)+ c(H+)>c(A—)+c(OH—),故B错误;C项,b点时Ka=c(H+)=10—4.75,由Ka=可得溶液中c(A—)= c(HA),则随氢氧化钠溶液体积增大,c点时溶液中c(A—) >c(HA),由图可知,c点溶液呈酸性,溶液中c(H+)>c(OH—),所以溶液中c(A—) >c(HA) >c(H+)>c(OH—),故C正确;D项,由HA的酸性强于HCN可知,HA的电离常数大于HCN,由可知,当相等时,酸的电离常数越大,溶液pH越小,则若将HA改为等体积等浓度的HCN,则pH随NaOH溶液体积的变化曲线竖直上移,故D正确;故选B。
22.(2022·四川省凉山州高三第一次诊断测试)水的电离平衡曲线如图所示,下列说法正确的是( )
A.图中温度T1>T2>
B.温度时,将的NaOH溶液与的H2SO4溶液混合,若混合溶液呈中性,则NaOH溶液与H2SO4溶液的体积比为
C.b点到c点可以通过温度不变,在水中加入适量的
D.图中五个点的Kw的关系为b>c>a>d=e
【答案】B
【解析】根据图像可知温度为T1时Kw=10-7 ×10-7=10-14,温度为T2时Kw=10-610-6=10-12,温度升高水的电离程度增大,故T2>T1。A项,根据分析可知温度为T1时Kw=10-7 ×10-7=10-14,温度为T2时Kw=10-6 ×10-6=10-12,温度升高水的电离程度增大,故T1>T2>,故A错误;B项,T2温度时,将pH=10的NaOH溶液c(OH-)=10-2mol/L,pH=3的H2SO4溶液c(H+)=10-3mol/L,混合后,若溶液呈中性,根据n(OH-)=n(H+),则NaOH溶液与H2SO4溶液的体积比为1:10,故B正确;C项,由图可知b点到c点Kw减小,温度改变Kw改变,故C错误;D项,温度不变Kw,温度升高Kw增大,a、e、d三点温度相同故Kw相同,从a到b温度依次升高,故Kw的关系为b>c>a=d=e,故D错误;故选B。
23.(2022·安徽省百校联盟高三联考)马来酸又称顺丁烯二酸,可简写为H2X,主要用于制造不饱和聚酯树脂、染色助剂和油脂防腐剂等。常温下,将溶液滴加到等浓度的H2X溶液中,测得混合溶液的与或浓度变化关系如图所示。下列叙述错误的是( )
A.N代表与的变化曲线
B.a点时,加入NaOH溶液的体积为5mL
C.NaHX溶液中:c(Na+)>c(HX-)>c(X2-)>c(H2X)
D.当pH=7时,加入NaOH溶液的体积大于
【答案】B
【解析】A项,由图可知,横坐标加纵坐标为或,即或,由于,所以,所以N表示与pH的变化曲线,A正确;B项,当时,,当时,,当加入NaOH溶液体积为5mL时,溶液中为等物质的量浓度的H2X和NaHX,H2X的电离常数(10-12)远大于HX-的电离常数(10-6.0)和水解常数(10-12.8),所以,而a点是两者相等的点,B错误;C项,HX-的电离常数为,水解常数为,电离大于水解,NaHX溶液中离子浓度大小关系为c(Na+)>c(HX-)>c(X2-)>c(H2X),C正确;D项,NaHX溶液呈酸性,当溶液呈中性时,应为NaHX和Na2X的混合溶液,加入NaOH溶液的体积大于10mL,D正确。故选B。
24.(2022·广东省高考研究测评研究院高三联考)常温下,向二元弱酸H2A溶液中加入NaOH固体,配制一组c(H2A)+c(HA-)+ c(A2-)=0.01 mol·L-1的混合溶液,溶液中含A微粒的物质的量浓度随pH的变化曲线如下图所示。下列说法不正确的是( )
A.Ka1=10 Ka2
B.M点溶液中, c(Na+)=0.01 mol·L-1
C.M点溶液中由水电离出的c(H+)小于N点溶液中由水电离出的c(H+)
D.NaHA溶液中,c(H2A) 小于c(A2-)
【答案】B
【解析】由题干图示可知,二元弱酸的电离方程式为H2HA-+H+,HAA2-+H+,图中实线为H2A,过M点的实线为HA-,过N点的虚线为A2-。A项,由图可知,pH=4.4时,c(H2A)=c(HA-),则,同理Ka1=10-5.4,则Ka1=10 Ka2,A确;B项,M点时,由电荷守恒可知:c(Na+)+c(H+)=2c(A2-)+ c(HA-)+c(OH-),又此时c(H2A)= c(A2-),且c(H+)>c(OH-),则c(Na+)<c(H2A)+c(HA-)+ c(A2-)<0.01 mol·L-1,B错误;C项,M点时,NaOH滴定H2A仍未到达生成Na2A的滴定终点,此时水的电离程度一直在增大,C正确;D项,由于Ka1=10 Ka2>KW,则NaHA的电离程度大于水解程度,c(H2A)小于c(A2-),D正确;故选B。
25.(2022·湖北省立肝腾云联盟高三联考)常温下,用0.100的盐酸滴定20mL相同浓度的一元碱BOH溶液(滴有少量酚酞),滴定过程中溶液pH及电导率变化曲线如图所示。下列说法中正确的是( )
A.BOH的电离常数Kb约为
B.a点溶液中:
C.b点溶液的颜色为粉红色
D.滴定至pH=7时,
【答案】B
【解析】A项,0.10mol/LBOH溶液的pH=11,则该溶液中,BOH为弱碱,其电离程度较小,则溶液中c(BOH)≈0.10mol/L,c(B+)≈c(OH-)=0.01mol/L,BOH的,故A错误;B项,a点酸物质的量是碱物质的量的一半,则混合溶液中溶质为等物质的量浓度的BOH、BCl,a点溶液中存在电荷守恒c(B+)+c(H+)=c(OH-)+c(Cl-)、存在物料守恒c(B+)+c(BOH)=2c(Cl-),所以存在c(B+)+2c(H+)=2c(OH-)+c(BOH),故B正确;C项,b点加入酸碱物质的量相等,二者恰好完全反应生成BCl,溶液中溶质为BCl,假设a点BOH不电离且B+不水解,b点B+不水解,a点c(B+)=、b点c(B+)=,混合溶液中BOH电离程度和B+水解程度都较小,则b点溶液几乎为中性,溶液应为无色,故C错误;D项,混合溶液pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒c(B+)+c(H+)=c(OH-)+c(Cl-),则c(B+)=c(Cl-),酸碱混合后导致溶液体积增大,则导致溶液中c(Cl-)减小,所以存在c(B+)=c(Cl-)<0.1mol•L-1,故D错误;故选B。
26.(2022·山东省潍坊市高三学科核心素养测评)Cu2+与NH3可结合生成多种络合物,在水溶液中存在如下平衡: [Cu(NH3)4]2+[Cu(NH3)3]2+[Cu(NH3)2]2+[Cu(NH3)]2+Cu2+。向某浓度的硫酸铜溶液中滴加浓氨水,实验测得含Cu微粒的物质的量分布分数 ()与溶液中游离氨的lgc(NH3)关系如图所示。下列说法错误的是( )
A.曲线b表示[Cu(NH3)]2+
B.
C.1gc(NH3)=-4时,c(Cu2+)=c{[Cu(NH3)]2+}>Cu(NH3)2]2+
D.M点时,
【答案】B
【解析】由图可知,曲线a在c(NH3)最小时,物质的量分布分数最大,说明曲线a表示Cu2+,随着c(NH3)升高,c(Cu2+)逐渐减小,[Cu(NH3)]2+的浓度逐渐增大,故曲线b是[Cu(NH3)]2+,继续升高c(NH3),[Cu(NH3)]2+浓度逐渐减小,[Cu(NH3)2]2+的浓度逐渐增大,则曲线c表示c表示[Cu(NH3)2]2+,以此类推,曲线d表示[Cu(NH3)3]2+,曲线e表示[Cu(NH3)4]2+。A项,曲线b表示[Cu(NH3)]2+,故A正确;B项,曲线a表示Cu2+,曲线b表示[Cu(NH3)]2+,曲线c表示[Cu(NH3)2]2+,曲线d表示[Cu(NH3)3]2+,曲线e表示[Cu(NH3)4]2+,K1=,由图像可知,当c([Cu(NH3)4]2+)= c([Cu(NH3)3]2+)时,c(NH3)=10-2mol/L,即K1=10-2;K2=,当c([Cu(NH3)2]2+)= c([Cu(NH3)3]2+),c(NH3)≈10-2.6mol/L,即K2=10-2.6;K4= ,当c(Cu2+)=c([Cu(NH3)]2+)时,c(NH3)=10-4mol/L,即K4=10-4;,,所以,故B错误;C项,根据图像分析,当1gc(NH3)=-4时,c(Cu2+)=c{[Cu(NH3)]2+}>Cu(NH3)2]2+,故C正确;D项,结合以上分析可知,K1=, K2 =,K3=; =,把K1、K2、K3带入上式,M点时,c([Cu(NH3)]2+)=c([Cu(NH3)4]2+),经过化简后可得=lgc3(NH3)=3lgc(NH3),即满足M点时,,故D正确;故选B。
27.(2022·四川省宜宾市二模)常温下,保持某含Ca2+水体中H2CO3与空气中CO2的平衡,调节水体pH,水体中-lg[c(X)]与pH的关系如下图所示(其中X为H2CO3、HCO3-、CO32-或Ca2+)。下列说法正确的是( )
A.曲线Ⅱ表示-lg[c(HCO3-)]与pH的关系
B.该温度下,H2CO3的电离常数Ka2的数量级为10-10
C.a点的水体中:c(Ca2+)>c(HCO3-)>c(CO32-)
D.向水体中加入适量Ca(OH)2固体,可使溶液由b点变到c点
【答案】C
【解析】根据图象分析,随着pH的增大,溶液的碱性增强,HCO3-的浓度减小,CO32-浓度增大,因此曲线Ⅲ代表与pH的关系,由于碳酸分步电离,第一步电离产生HCO3-,第二步电离时产生CO32-,因此曲线Ⅰ为与pH的关系,随着CO32-浓度增大,逐渐生成CaCO3沉淀,溶液中Ca2+逐渐减小,曲线Ⅱ为与pH的关系。A项,曲线Ⅱ为与pH的关系,故A错误;B项,由图可知,pH=7.7时,曲线Ⅲ和曲线Ⅰ相交,此时c(HCO3-)=c(CO32-), ,则H2CO3的电离常数,故B错误;C项,由图可知,经过a点作一条垂直与pH轴的直线,曲线Ⅱ在最上面,曲线Ⅲ在最下面,因此a点的水体中:c(Ca2+)>c(HCO3-)>c(CO32-),故C正确;D项,向水体中加入适量Ca(OH)2固体,Ca2+浓度增大,温度不变,Ksp(CaCO3)不变,则CO32-浓度减小,因此向水体中加入适量Ca(OH)2固体,不能使溶液由b点变到c点,故D错误;故选C。
28.(2022·河北省高三模拟预测)H2A是一种二元弱酸,H2A由于与空气中的某种成分作用而保持不变,已知Ksp(MA)= 3×10-9,某水体中lg c(X) (X为H2A、HA-、A2-、M2+)与pH的关系如图所示。下列说法正确的是( )
A.曲线②代表A2- B.H2A的一级电离常数为10-8.3
C.c(M2+)随pH升高而增大 D.pH=10.3时,c(M2+)=3.0×10-7.9 mol·L-1
【答案】D
【解析】A项,H2A的浓度保持不变,则曲线①代表H2A,随着pH逐渐增大,HA-、A2-离子浓度增大,pH较小时,HA-的浓度大于A2-的浓度,则曲线②代表HA-,曲线③代表A2-,A错误;B项,曲线①和曲线②的交点代表溶中H2A、HA-的浓度相等,由交点的坐标(6.3,-5))可知,H2A的一级电离常数,B错误;C项,由A分析可知,曲线④代表M2+,则c(M2+)随pH升高而减小,C错误;D项,根据图像,曲线②和曲线③的交点(10.3,-1.1)代表溶液中HA-、A2-离子浓度相等,均为10-1.1 mol·L-1,则,D正确;故选D。
29.(2022·四川省成都市二模)室温下,向1.00L0.100mol/LNH4HCO3溶液中加入NaOH稀溶液,溶液中主要型体的分布系数[比如A2-的分布系数δ(A2-)=]以及pH随n(NaOH)变化如图。
下列叙述错误的是( )
A.0.100mol/LNH4HCO3溶液中>1,水电离受到促进
B.加入NaOH稀溶液过程中,溶液满足关系式c(NH4+)+c(NH3·H2O)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.Ka2(H2CO3)×Kb(NH3·H2O)
【答案】D
【解析】A项,NH4HCO3= NH4++HCO3-,NH4+和HCO3-分别发生水解,HCO3-+H2O H2CO3+OH-,NH3·H2ONH4++H+,因为,所以c(OH-)>c(H+),则说明HCO3-水解程度大,使水电离受到促进,故A正确;B项,NH4HCO3= NH4++HCO3-,NH4+和HCO3-分别发生水解,HCO3-+H2O H2CO3+OH-,NH3·H2ONH4++H+,则由物料守恒得 c(NH4+)+c(NH3·H2O)=c(CO32-)+c(H2CO3)+c(HCO3-),故B正确;C项,,图中c(CO32-)=c(HCO3-)时,c(NH4+)<c(NH3·H2O),所以,因此,故C正确;D项,加入少量NaOH时,HCO3-浓度基本不变,而NH4+浓度快速减小,所以OH-先与NH4+发生主要反应,故D错误。故选D。
2023年高考化学三轮回归教材重难点07 图像数据和结果的分析: 这是一份2023年高考化学三轮回归教材重难点07 图像数据和结果的分析,共31页。试卷主要包含了能量变化示意图,化学平衡移动与图像,弱电解质的电离,弱电解质分布系数图,化学平衡图像的解题思路和方法等内容,欢迎下载使用。
2022年高考化学三轮冲刺之回归教材10 实验方案的设计与评价练习题: 这是一份2022年高考化学三轮冲刺之回归教材10 实验方案的设计与评价练习题,共31页。试卷主要包含了无机物质的制备,有机物质的制备,明确常考实验装置的作用,实验条件控制的操作与目的,物质制备与提纯的思维流程,定量型实验题的解题模板,评价实验方案的三角度,铜是不活泼的金属,常见有、价等内容,欢迎下载使用。
2022年高考化学三轮冲刺之回归教材01 化学与STSE与传统文化练习题: 这是一份2022年高考化学三轮冲刺之回归教材01 化学与STSE与传统文化练习题,共19页。试卷主要包含了化学与环境保护,化学与材料,化学与营养,化学与资源开发,常见化学物质的性质及其应用,化学与传统文化,化学与生活密切相关等内容,欢迎下载使用。












