




2022年中考化学二轮专题突破课件物质的检验、鉴别和除杂
展开考点一 物质的检验与鉴别
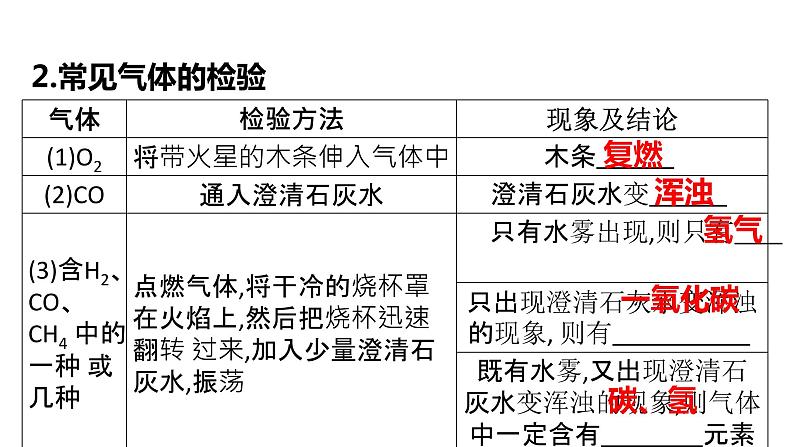
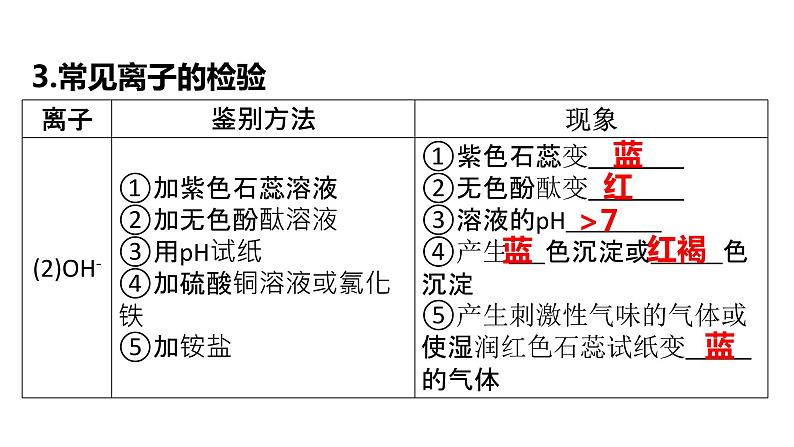
1.检验原则、方法和步骤 (1)检验原则:检验物质时操作要简便,选用常用试剂,实验现象要明显。 (2)检验方法 物理方法: ①根据颜色检验:如含有Cu2+的溶液显 色, 含有Fe3+的溶液显 色,含Fe2+的溶液显 色,KMnO4溶液显 色等。 ②根据气味检验:如NH3、SO2等气体有 气味。
③根据溶解性检验:如常见的CaCO3、MnO2、AgCl等物质 ,溶于水,Ca(OH)2 溶于水等。 ④根据物质的特殊性质检验:如 CaO、浓硫酸、NaOH固体溶于水能 热量,NH4NO3溶于水 热量,金属铁和Fe3O4都能被磁铁吸引等。 化学方法:利用物质的特殊化学性质(如根据酸碱性,可使用紫色石蕊溶液、无色酚酞溶液、pH试纸检验),反应时产生的特征现象(如反应有气体或沉淀生成), 通过观察、分析,得出结论。 (3)检验步骤:对被检验物质,要先取样,再进行 实验。概括为 “取物质 → 加试剂 → 观现象 → 得 结论”。
金属表面变黑的是黄铜,不变色的为黄金
有气泡冒出 的是黄铜,反之为黄金
若固体溶解,产生气泡,溶液由无色变浅绿色
若固体溶解,溶液由无色变蓝色
检验固体物质时,先要将其溶于水,同时取出少 量试剂进行操作,根据现象和结论对其进行鉴 定,既要鉴定阳离子,也要鉴定阴离子。
考点二 物质的提纯(除杂)
1.原理(1)物质的分离:将混合物中的各组分分离,得到纯净的一种物质。用化学方法分离混合物时,选择试剂时要考虑是否能再恢复到原来的状态。(2)物质的提纯:除去物质中混有的杂质。提纯时不要求将杂质恢复到原来的状态,但要求被提纯的物质质量不减少,不引入新杂质。
2.方法(1)物理方法①过滤:可溶性物质与难溶性物质的分离、提纯,如粗盐提纯。②冷却结晶法:适用于分离可溶性混合物,提纯物质和杂质均可溶且溶解度随温度的变化不同,如NaCl和KNO3固体混合物的分离。 ③蒸发结晶法:分离溶质和溶剂;除去易挥发的杂质;适用于分离可溶性混合物,如海水晒盐。④磁铁吸引法等。
(2)化学方法原则:“不增”,不能引入新的杂质;“不减”,选用的试剂只和杂质反应,不与被提纯的物质反应;“易分”,操作简便易行,和杂质反应的生成物与被提纯的物质容易分离开来。①化气法:加入某种试剂,使杂质转化为气体而除去。如加入适量稀硫酸除去Na2SO4中的Na2CO3。②沉淀法:在混合物中加入某种试剂,使其中的杂质转化为沉淀,过滤除去沉淀。如加入适量BaCl2溶液,过滤除去NaCl溶液中的Na2SO4。③转化法:将杂质通过化学反应转化为被提纯物质。如将气体通过灼热的氧化铜除去CO2中的CO。
④置换法:将杂质通过置换反应而除去。如加入过量铁粉,充分反应后过滤除去FeSO4溶液中的CuSO4。⑤吸收法:将气体中的杂质用固体或液体吸收而除去。如将气体先后通入装有氢氧化钠溶液和浓硫酸的洗气瓶除去CO中混有的少量CO2。
3.除杂类型(1)气体(括号内为杂质)
饱和碳酸氢钠溶液、浓硫酸
(2)固体(括号内为杂质)
在空气中(或氧气中)灼烧
加入足量的稀硫酸,过滤、洗涤、干燥
加水溶解,过滤、洗涤、干燥
加入适量氯化钡溶液,过滤
加入适量硫酸钠溶液,过滤
加入适量澄清石灰水,过滤
加入适量硝酸银溶液,过滤
加入适量氯化钠溶液,过滤
冷却热饱和溶液或降温结晶
加入足量氧化铜粉末,过滤
加入足量碳酸钙粉末,过滤
加入适量硝酸钡溶液,过滤
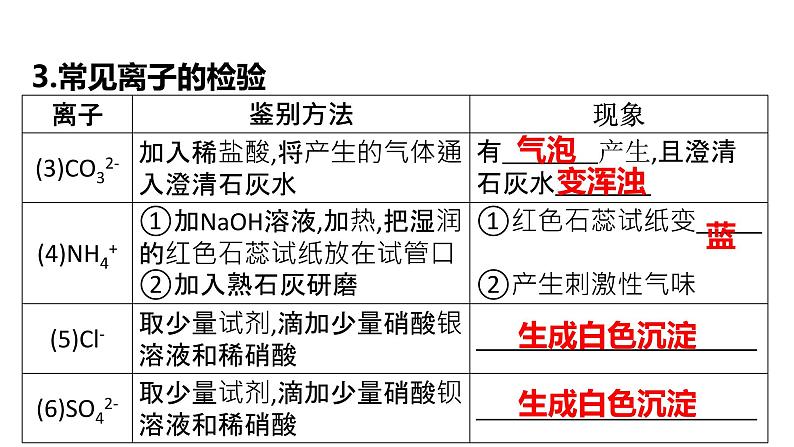
(4)常见杂质离子的除杂
H+ 、Ca2+ 、Ba2+
除杂过程中的注意事项: 1.注意“适量”“足量”“过量”等词的使用,加入除杂试剂过量时,最终要将过量试剂除净。 2.除杂时涉及操作,如加水溶解、加试剂、过滤、蒸发、结晶、洗涤、干燥等,审题时要弄清最终要得到的物质,从而调整好除杂操作的先后顺序。
命题点1 物质的检验与鉴别
(2020·青海)下列各组物质的鉴别方法与结论均正确的是( )
【解题思路】了解纯金属与合金的区别;学会用肥皂水鉴别软水与硬水;利用溶解热效应鉴别物质;铵态氮肥的检验方法。
(2021·广东)鉴别、除杂是重要的实验技能,下列实验设计能达到实验目的的是( )
学习化学知识和技能,可以帮助我们鉴别和检验物质。(1)在实验室鉴别白酒与白醋,可采用的方法是 。
(2)现有两瓶失去标签的无色溶液,其中一瓶是氢氧化钙溶液,一瓶是稀硫酸。同学们设计了如下实验方案鉴别:先给两瓶溶液贴上标签A、B,然后分别取样进行实验。
A 中有白色沉淀生成,B中有气泡冒出
写出方案1中发生反应的化学方程式: 。 【方法感悟】在鉴别物质时,要先分析物质的性质,然后选择恰当的试剂,必须产生不同现象才能达到鉴别物质的目的。 【拓展应用】请从下列提供的试剂中选出所有能鉴别出这两种物质的试剂X (填序号) 。 ①酚酞溶液 ②镁 ③氧化铜 ④稀硝酸 ⑤氢氧化铜 ⑥氯化镁溶液 ⑦硝酸钡溶液
Ca(OH)2+CO2=CaCO3↓+ H2O
(2021·临沂)检验、鉴别、除杂与分离是研究及获得物质的重要方法。下列实验方案不合理的是( )
【解题思路】铵态氮肥能与熟石灰反应生成氨气,氨 气具有刺激性气味,可用熟石灰研磨、闻气味进行鉴别;氧化铜和碳都是黑色的,观察颜色无法区分;通过灼热的铜网,铜能与氧气在加热的条件下反应生成氧化铜,铜与氮气不反应,可除去杂质;二氧化锰难溶于水,氯化钾溶于水,加水溶解,过滤、蒸发,可得氯化钾,烘干滤渣可得二氧化锰。
(2020•天水)下列各组物质的溶液,不用其他试剂,无法将其一一区别的是( ) A.(NH4)2SO4 NaCl NH4Cl Ba(OH)2 B.H2SO4 NaOH Na2SO4 FeCl3 C.CaCl2 Na2SO4 Na2CO3 NaNO3 D.HCl H2SO4 BaCl2 K2CO3
1.特征现象法:利用物质的物理性质(如颜色等)不同,通过观察找到突破口,然后利用已鉴别出来的物质作为试剂将剩余物质连环鉴别出来。 如不用其他试剂鉴别下列四种溶液:AgNO3、KOH、NaCl、FeCl3。 方法:观察颜色,呈黄色的是FeCl3溶液。以FeCl3为试剂分别滴入其他三种溶液中,有白色沉淀生成的是AgNO3溶液,有红褐色沉淀生成的是KOH溶液。
方法突破 多种物质的无试剂鉴别
2.两两混合法:采用两两混合的方法,若能各自产生不同现象,便可加以区别。 组内有碳酸钠或碳酸钾溶液,且碳酸钠或碳酸钾跟另外三种物质反应,分别有沉淀、气体和另一 现象。如不其他试剂鉴别下列四种溶液:K2CO3、H2SO4、HNO3、BaCl2。 方法:各取少量,两两混合,必有一种溶液滴入其他三种溶液中,出现气泡、气泡、白色沉淀,则这一种溶液就是 K2CO3,出现白色沉淀的那种就是BaCl2溶液,取BaCl2溶液滴入另外两种溶液中,出现白色沉淀的是H2SO4溶液,没现象的是HNO3溶液。
3.借助产物法:借用相关反应产物和酸反应加以鉴别(组内物质一般含有酸)。
四种白色固体:①NaCl;②BaCl2;③Na2SO4;④CuSO4。不用其他试剂(可用水)就可以把它们区分开,区分的先后顺序是( ) A.③②①④ B.④②③① C.②③①④ D.④③②①
(2021·黑龙江)下列实验方案能达到实验目的的是( )
(2020·滨州)除去下列物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是( )
【解题思路】利用杂质与被提纯物的化学性质不 同、溶解性不同,除去物质中混有的杂质,且被提纯 的物质质量不减少,不引入新杂质。
(2020·孝感)下列实验方案不能达到实验目的的是( )
(2020·黔南州)某同学为除去食盐水中的Na2SO4杂质,进行了以下实验。下列有关说法错误的是( )A.X是BaCl2 溶液 B.Y是 Na2CO3 C.Z是稀盐酸 D.步骤②与④可交换
【解题思路】依次加入过量的氯化钡溶液、过量的碳酸钠,除去硫酸根离子、过量的钡离子,最后加入适量的盐酸除去剩余的碳酸钠。
(2020·福州质检)实验室以粗盐(含少量泥沙、MgCl2、CaCl2、Na2SO4)为原料制取“84”消毒液的部分流程如下图:(1)物质A属于 (填“溶液”“悬浊液”或“乳浊液”)。
(2)下列有关操作B的说法正确的是 (填字母)。a.除去可溶性杂质 b.玻璃棒仅起搅拌作用 c.漏斗中液面低于滤纸边缘 (3)沉淀中除了泥沙,还含有 种难溶物。调节pH最适宜的试剂是 (填名称)。
中考化学复习高频考点集中练7物质的检验、鉴别与除杂课件: 这是一份中考化学复习高频考点集中练7物质的检验、鉴别与除杂课件,共19页。PPT课件主要包含了CaOH2,复分解反应,溶液由红色变成无色,实验探究一,产生气泡,CaCl2,完全除去Na2CO3,NO-3,AgCl等内容,欢迎下载使用。
2023年中考二轮专题复习物质的检验与鉴别、分离和除杂课件PPT: 这是一份2023年中考二轮专题复习物质的检验与鉴别、分离和除杂课件PPT,共40页。PPT课件主要包含了物质的检验,跟踪小练,变浑浊,变成红色,物质的鉴别,肥皂水,氢氧化钠,硝酸铵,纯金属,铵态氮肥等内容,欢迎下载使用。
科粤版中考化学复习重难突破11物质的检验、鉴别与除杂课件: 这是一份科粤版中考化学复习重难突破11物质的检验、鉴别与除杂课件,共38页。PPT课件主要包含了答案是B等内容,欢迎下载使用。












