
苏教版(2019)高考一轮复习专题质检卷七 化学反应速率和化学平衡
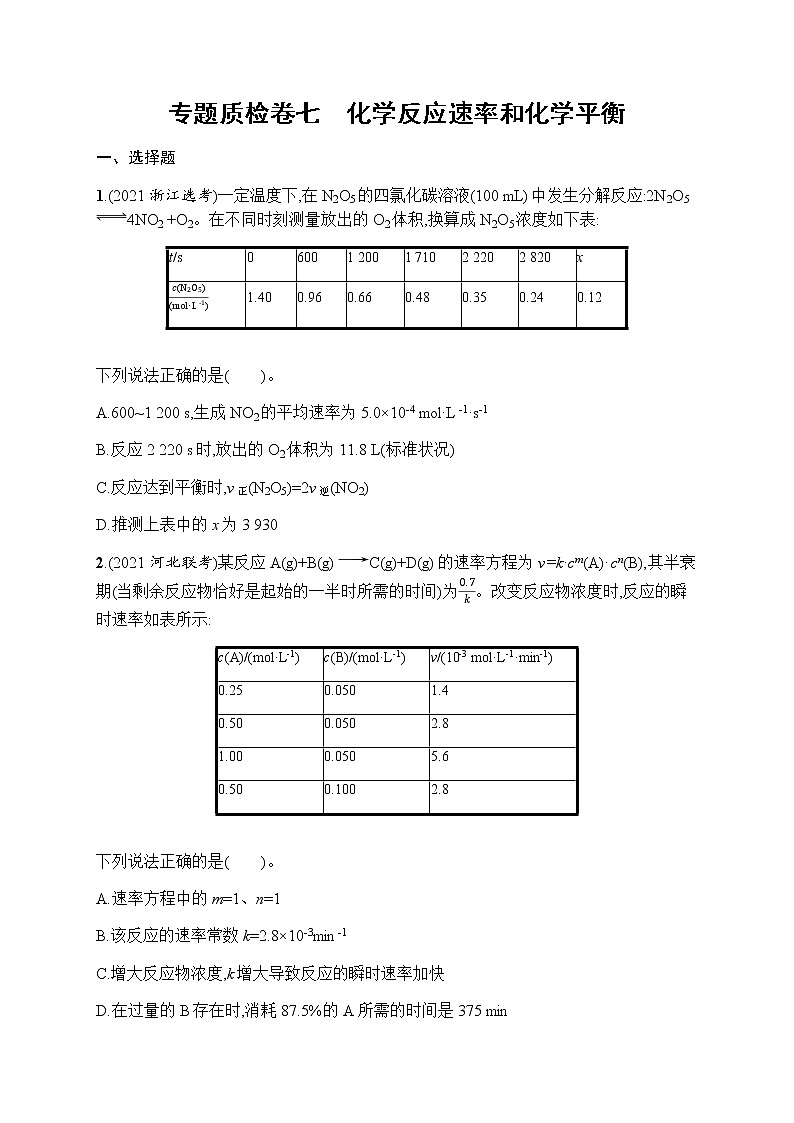
展开1.(2021浙江选考)一定温度下,在N2O5的四氯化碳溶液(100 mL)中发生分解反应:2N2O54NO2 +O2。在不同时刻测量放出的O2体积,换算成N2O5浓度如下表:
下列说法正确的是( )。
A.600~1 200 s,生成NO2的平均速率为5.0×10-4 ml·L-1·s-1
B.反应2 220 s时,放出的O2体积为11.8 L(标准状况)
C.反应达到平衡时,v正(N2O5)=2v逆(NO2)
D.推测上表中的x为3 930
2.(2021河北联考)某反应A(g)+B(g)C(g)+D(g)的速率方程为v=k·cm(A)·cn(B),其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.7k。改变反应物浓度时,反应的瞬时速率如表所示:
下列说法正确的是( )。
A.速率方程中的m=1、n=1
B.该反应的速率常数k=2.8×10-3min-1
C.增大反应物浓度,k增大导致反应的瞬时速率加快
D.在过量的B存在时,消耗87.5%的A所需的时间是375 min
3.等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)2Z(g)+W(s) ΔH<0,下列叙述正确的是( )。
A.达到平衡时,反应速率v正(X)=2v逆(Z)
B.平衡常数K值越大,X的转化率越大
C.达到平衡后降低温度,平衡向逆反应方向移动
D.达到平衡后,增大压强有利于该反应平衡向逆反应方向移动
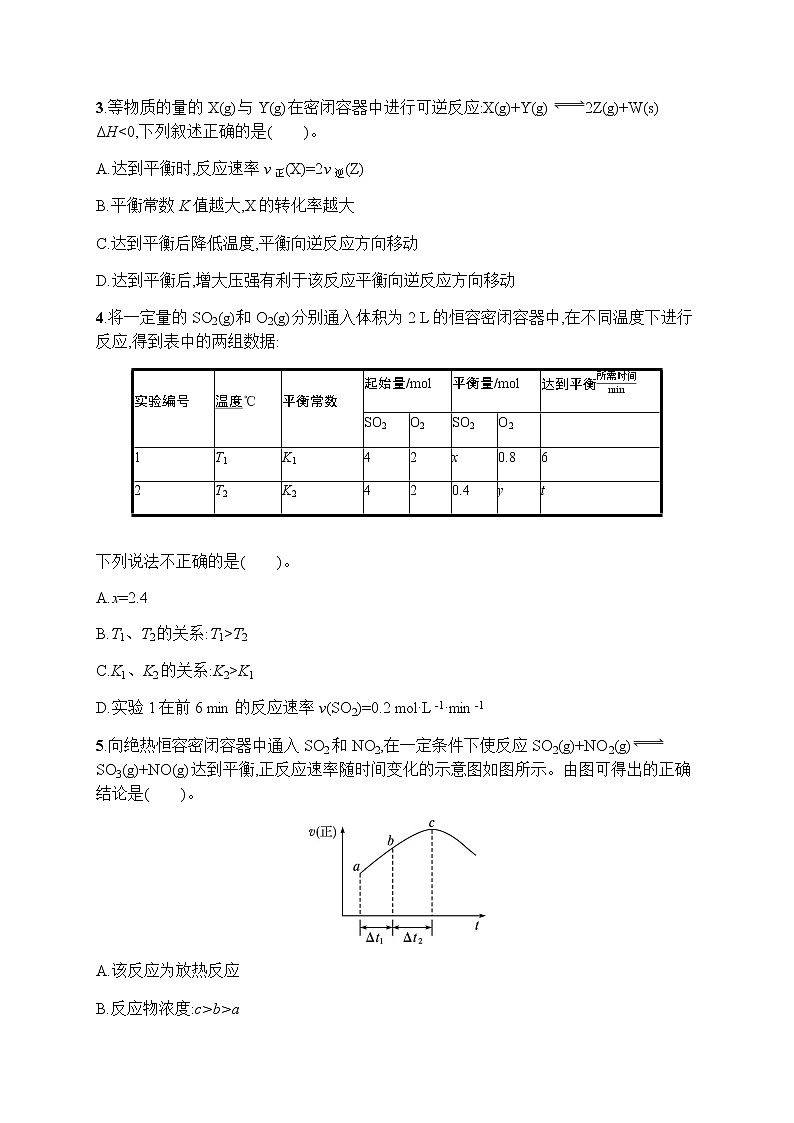
4.将一定量的SO2(g)和O2(g)分别通入体积为2 L的恒容密闭容器中,在不同温度下进行反应,得到表中的两组数据:
下列说法不正确的是( )。
A.x=2.4
B.T1、T2的关系:T1>T2
C.K1、K2的关系:K2>K1
D.实验1在前6 min的反应速率v(SO2)=0.2 ml·L-1·min-1
5.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )。
A.该反应为放热反应
B.反应物浓度:c>b>a
C.a、b点均未建立平衡,c点恰好达到平衡
D.若在恒温恒容容器中,以相同的投料进行该反应,平衡后转化率小于绝热恒容容器中的转化率
二、非选择题
6.Ⅰ.研究发现,氮氧化物和硫氧化物是雾霾的主要成分。请回答下列问题:
(1)有下列反应:①N2(g)+O2(g)2NO(g) ΔH1=+180.5 kJ·ml-1
②C(s)+O2(g)CO2(g) ΔH2=-393.5 kJ·ml-1
③2C(s)+O2(g)2CO(g) ΔH3=-221.0 kJ·ml-1
已知某反应的平衡常数表达式为K=c(N2)·c2(CO2)c2(NO)·c2(CO),请写出此反应的热化学方程式: 。
(2)往1 L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g)2NO(g)+O2(g),实验测得NO2的浓度(单位为ml·L-1)随时间的变化如下表(不考虑生成N2O4)。
①下列说法正确的是 (填字母)。
A.实验2容器内压强比实验1的小
B.由实验2和实验3可判断该反应是放热反应
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
E.在0→10 min内实验2的反应速率v(O2)=0.015 ml·(L·min)-1
②不能判断反应已达到化学平衡状态的是 (填字母)。
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为p0 kPa,在800 ℃温度下该反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2 ml,平衡将 (填“向正反应方向移动”“向逆反应方向移动”或“不移动”)。
(3)为了减少雾霾中的SO2,工业尾气中SO2可用饱和Na2SO3溶液吸收,该反应的化学方程式为 ;25 ℃时,若用1 ml·L-1的Na2SO3溶液吸收SO2,当恰好完全反应时,溶液的pH (填“大于”“小于”或“等于”)7,溶液中各离子浓度由大到小的顺序为 (已知:常温下H2SO3的电离常数Ka1=1.3×10-2,Ka2=6.2×10-8)。
7.工业上可用一氧化碳合成可再生能源甲醇。
(1)已知:Ⅰ.3CO(g)+6H2(g)
CH3CHCH2(g)+3H2O(g)
ΔH1=-301.3 kJ·ml-1;
Ⅱ.3CH3OH(g)CH3CHCH2(g)+3H2O(g) ΔH2=-31.0 kJ·ml-1。
则CO与H2合成气态甲醇的热化学方程式为 。
(2)某科研小组在Cu2O/ZnO作催化剂的条件下,在500 ℃时,研究了n(H2)∶n(CO)分别为2∶1、5∶2时CO的转化率变化情况(如图1所示),则图中表示n(H2)∶n(CO)=2∶1的变化曲线为 (填“曲线a”或“曲线b”),原因是 。
(3)某科研小组向密闭容器中充入一定量的CO和H2用来合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH3OH的产率与温度的关系如图2所示。下列说法正确的是 (填字母)。
A.使用催化剂A能增大相关化学反应速率,但催化剂A并未参与反应
B.在恒温恒压的平衡体系中充入氩气,CH3OH的产率降低
C.当2v正(CO)=v逆(H2)时,反应达到平衡状态
(4)一定温度下,在容积均为2 L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
若甲容器平衡后气体的压强为开始时的34(分压=总压×物质的量分数),则该温度下,该反应的平衡常数K= ,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为 。
(5)CO与日常生产生活相关。
图3
①检测汽车尾气中CO的含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。则负极的电极反应式为 。
②碳酸二甲酯[(CH3O)2CO]毒性小,是一种绿色化工产品,用CO合成(CH3O)2CO,其电化学合成原理为
4CH3OH+2CO+O22(CH3O)2CO+2H2O,装置如图3所示,写出阳极的电极反应式: 。
专题质检卷七 化学反应速率和化学平衡
1.D 600~1 200 s,N2O5浓度的变化量为(0.96-0.66) ml·L-1=0.30 ml·L-1,在此时间段内NO2的变化量为其2倍,即0.60 ml·L-1,因此,生成NO2的平均速率为0.60ml·L-1600 s=1.0×10-3 ml·L-1·s-1,A项错误;由表中数据可知,反应到2 220 s时,N2O5浓度的变化量为(1.40-0.35) ml·L-1=1.05 ml·L-1,其物质的量的变化量为1.05 ml·L-1×0.1 L=0.105 ml,O2的变化量是其12,即0.052 5 ml,因此,放出的O2在标准状况下的体积为0.052 5 ml×22.4 L·ml-1=1.176 L,B项错误;反应达到平衡时,正反应速率等于逆反应速率,用不同物质表示该反应的速率时,其数值之比等于化学计量数之比,故2v正(N2O5)=v逆(NO2),C项错误;分析表中数据可知,该反应每经过1 110 s(600~1 710,1 710~2 820)后N2O5的浓度会变为原来的12,因此,N2O5的浓度由0.24 ml·L-1变为0.12 ml·L-1时,可以推测表中的x为(2 820+1 110)=3 930,D项正确。
2.D 将第一组数据和第二组数据代入v=k·cm(A)·cn(B)可得×10-31.4×10-3,则m=1,将第二组数据和第四组数据代入v=k·cm(A)·cn(B)可得×10-32.8×10-3,则n=0,A项错误;由A选项的分析可知,m=1,n=0,则v=k·c(A),代入第一组数据可得,k=5.6×10-3 min-1,B项错误;增大反应物的浓度,反应速率增大,并没有改变瞬时速率常数k(k只受温度影响),C项错误;存在过量的B时,反应87.5%的A可以看作经历3个半衰期,即50%+25%+12.5%,因此所需的时间为3×0.75.6×10-3min-1=375 min,D项正确。
3.B 各物质的反应速率之比等于其计量数之比,平衡状态时,正、逆反应速率相等,所以达到平衡时反应速率:2v正(X)=v逆(Z),故A项错误。化学平衡常数越大,说明反应物转化的越多,则反应物的转化率越大,故B项正确。达到平衡状态时,降低温度,平衡向放热方向移动,向正反应方向移动,故C项错误。达到平衡后,增大压强平衡向气体体积减小的方向移动,该反应前后气体体积不变,所以改变压强平衡不移动,故D项错误。
4.A 实验1从开始到反应达到化学平衡时,
2SO2(g) + O2(g)2SO3(g)
起始量/ml 4 2 0
变化量/ml 2.4 1.2 2.4
平衡量/ml x 0.8 2.4
故x=1.6,A项不正确。同样可以计算出y=0.2<0.8,而可逆反应正反应放热,故T1>T2,B项正确。温度越高,反应的平衡常数越小,故K2>K1,C项正确。用SO2表示的反应速率v(SO2)=2.4ml2 L×6min=0.2 ml·L-1·min-1,D项正确。
5.A 一个可逆反应,随着反应进行,反应物浓度降低,正反应速率应该降低,但该图像中开始时正反应速率升高,说明反应过程中温度升高,故正反应为放热反应,A项正确。从a到c点正反应速率增大,反应物浓度不断减小,B项错误。可逆反应达到化学平衡时,正反应速率与逆反应速率相等,且保持不变,而c点后反应速率仍然在变化,C项错误。该反应为放热反应,恒温容器随着反应进行温度不变,而绝热容器随着反应进行,体系温度升高,温度越高,反应物转化率越小,D项错误。
6.答案 (1)2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-746.5 kJ·ml-1
(2)①DE ②B ③0.2p0 不移动
(3)Na2SO3+SO2+H2O2NaHSO3 小于 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
解析 (1)若某反应的平衡常数表达式为K=c(N2)·c2(CO2)c2(NO)·c2(CO),可知反应为2NO(g)+2CO(g)N2(g)+2CO2(g),
①N2(g)+O2(g)2NO(g) ΔH1=+180.5 kJ·ml-1
②C(s)+O2(g)CO2(g) ΔH2=-393.5 kJ·ml-1
③2C(s)+O2(g)2CO(g) ΔH3=-221 kJ·ml-1
根据盖斯定律,将②×2-③-①得到2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-746.5 kJ·ml-1。
(2)①由图表数据可知实验2和实验1温度相同,起始量相同,达到平衡状态c(NO2)相同,但达到平衡状态需要时间,实验2小于实验1,说明是使用了催化剂的作用,实验2容器内压强和实验1的压强相同,A项错误。
实验3在850 ℃反应,达到平衡时c(NO2)比800 ℃小,说明升高温度,化学平衡向正反应方向移动,则正反应应为吸热反应,B项错误。
升高温度,平衡向正反应方向移动,平衡常数会增大,所以实验3的化学平衡常数比实验1的大,C项错误。
因实验1和实验2平衡时NO2的浓度相同,但实验2反应速率大,说明实验2使用了催化剂,D项正确。
2NO2(g)2NO(g)+O2(g),在0→10 min内实验2的反应速率v(O2)=12v(NO2)=12×1.00ml·L-1-0.70 ml·L-110min=0.015 ml·(L·min)-1,E项正确。
②对于反应2NO2(g)2NO(g)+O2(g),
由于该反应是在恒容条件下进行的反应前后气体体积增大的反应,若容器内的气体压强不变,说明反应达到平衡状态,A项不符合题意;
速率之比等于化学方程式计量数之比,为正反应速率之比,v正(NO2)=2v逆(O2)能说明氧气的正逆反应速率相同,但2v正(NO2)=v逆(O2)不能说明反应达到平衡状态,B项符合题意;
其他条件不变,若反应未达到平衡状态,气体的物质的量改变,气体的平均相对分子质量就发生变化,因此气体平均相对分子质量保持不变,说明反应达到平衡状态,C项不符合题意;
NO2和NO的浓度比保持不变说明正逆反应速率相同,反应处于平衡状态,D项不符合题意。
③已知容器内的起始压强为p0 kPa,800 ℃达到平衡状态c(NO2)=0.50 ml·L-1,由于容器的容积为1 L,所以n(NO2)=0.50 ml,结合三段式法列式计算:
2NO2(g) 2NO(g) + O2(g)
起始量/ml1.0000
变化量/ml0.500.500.25
平衡量/ml0.500.500.25
平衡状态气体的总物质的量n(总)=0.50 ml+0.50 ml+0.25 ml=1.25 ml
在800 ℃温度下该反应的平衡常数Kp=p0×××。在该温度下达到平衡后,平衡常数K=0.502×,再向容器中通入NO2和NO各2 ml,浓度商Q=0.25×,说明平衡不移动。
(3)工业尾气中SO2可用饱和Na2SO3溶液吸收,该反应的化学方程式为Na2SO3+SO2+H2O2NaHSO3,25 ℃时,若用1 ml·L-1的Na2SO3溶液吸收SO2,当恰好完全反应,溶液中生成亚硫酸氢钠,根据题意可知HSO3-的电离平衡常数Ka2=6.2×10-8,HSO3-在溶液中也存在水解平衡:HSO3-+H2OH2SO3+OH-,水解平衡常数Kh=c(H2SO3)·c(OH-)c(HSO3-)=c(H2SO3)·c(OH-)·c(H+)c(HSO3-)·c(H+)=c(OH-)·c(H+)c(HSO3-)·c(H+)c(H2SO3)=KWK1=1×10-141.3×10-2=7.7×10-13<6.2×10-8,说明HSO3-电离程度大于HSO3-水解程度,溶液显酸性,pH<7,所以溶液中离子浓度大小:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。
7.答案 (1)CO(g)+2H2(g)CH3OH(g)
ΔH=-90.1 kJ·ml-1
(2)曲线b H2的含量越低,CO的转化率越小
(3)BC
(4)0.25 1
解析 (1)已知:Ⅰ.3CO(g)+6H2(g)CH3CHCH2(g)+3H2O(g) ΔH1=-301.3 kJ·ml-1,Ⅱ.3CH3OH(g)CH3CHCH2(g)+3H2O(g) ΔH2=-31.0 kJ·ml-1,根据盖斯定律,Ⅰ×13-Ⅱ×13得,CO(g)+2H2(g)CH3OH(g),则ΔH=-13×301.3 kJ·ml-1+13×31.0 kJ·ml-1=-90.1 kJ·ml-1,即CO与H2合成气态甲醇的热化学方程式为CO(g)+2H2(g)CH3OH(g) ΔH=-90.1 kJ·ml-1。
(2)n(H2)∶n(CO)=5∶2时,相当于增大H2的浓度,平衡正向移动,CO的转化率增大,则n(H2)∶n(CO)=2∶1时,H2的含量越低,平衡逆向移动,CO的转化率越小,即图中表示n(H2)∶n(CO)=2∶1的变化曲线为曲线b。
(3)催化剂参与化学反应才能增大反应速率,故A项错误。在恒温恒压的平衡体系中充入氩气,体积增大,分压减小,平衡逆向移动,CH3OH的产率降低,故B项正确。根据反应速率与化学计量数成正比,当2v正(CO)=v逆(H2)时,反应达到平衡,故C项正确。
(4)已知甲中反应物投入量为2 ml CO、6 ml H2,设参与反应的CO的物质的量为x ml,则
CO(g) + 2H2(g) CH3OH(g)
起始量/ml260
转化量/mlx2xx
平衡量/ml2-x6-2xx
根据分压=总压×物质的量分数可知,压强与物质的量成正比,即2-x+6-2x+x2+6=0.75,解得x=1,平衡常数K=c(CH3OH)c(CO)·c2(H2)=1212×422=0.25;依题意知,甲、乙为等同平衡,且起始时维持反应逆向进行,所以当全部由CH3OH投料时,c的物质的量等于CO的物质的量为2 ml,c的值不能小于平衡时CO的物质的量1 ml,所以c的取值为1
②阳极上是甲醇与一氧化碳反应失电子发生氧化反应,根据电子转移、电荷守恒书写电极反应式为2CH3OH+CO-2e-(CH3O)2CO+2H+。t/s
0
600
1 200
1 710
2 220
2 820
x
c(N2O5)(ml·L-1)
1.40
0.96
0.66
0.48
0.35
0.24
0.12
c(A)/(ml·L-1)
c(B)/(ml·L-1)
v/(10-3 ml·L-1·min-1)
0.25
0.050
1.4
0.50
0.050
2.8
1.00
0.050
5.6
0.50
0.100
2.8
实验编号
温度℃
平衡常数
起始量/ml
平衡量/ml
达到平衡所需时间min
SO2
O2
SO2
O2
1
T1
K1
4
2
x
0.8
6
2
T2
K2
4
2
0.4
y
t
实验序号
时间/min
0
10
20
30
40
50
实验1/800 ℃
1.00
0.80
0.65
0.55
0.50
0.50
实验2/800 ℃
1.00
0.70
0.50
0.50
0.50
0.50
实验3/850 ℃
1.00
0.50
0.40
0.35
0.35
0.35
容器
甲
乙
反应物起始投入量
2 ml CO、
6 ml H2
a ml CO、b ml H2、c ml CH3OH(g)(a、b、c均不为零)
第七单元 化学反应速率和化学平衡 单元质检卷7(含解析)-2024届高考化学一轮复习: 这是一份第七单元 化学反应速率和化学平衡 单元质检卷7(含解析)-2024届高考化学一轮复习,共26页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2024届高考化学一轮总复习单元质检卷7第七单元化学反应速率和化学平衡: 这是一份2024届高考化学一轮总复习单元质检卷7第七单元化学反应速率和化学平衡,共15页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
广西专用2022年高考化学一轮复习单元质检卷7化学反应速率和化学平衡含解析新人教版: 这是一份广西专用2022年高考化学一轮复习单元质检卷7化学反应速率和化学平衡含解析新人教版,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












