

2022届福建省厦门第一中学高三上学期12月考试化学试题含答案
展开2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cu-64
一、单项选择题(本题包括10小题,每小题4分,共40分。每小题只有一个选项符合题意)
1.化学与科技、生活、生产、环境等领域息息相关。下列说法错误的是
A.航天飞机上大量使用的碳纤维是一种新型有机高分子材料
B.推广使用可降解的淀粉塑料和提倡使用乙醇汽油,能减轻环境污染
C.“天宫二号”空间实验室的硅电池板将光能直接转换为电能
D.《本草纲目》中“凡酸坏之酒,皆可蒸烧”,所用的分离操作方法是蒸馏
2.有机物X可以作为药物合成中间体,其结构简式如图所示。有关X说法错误的是
A.分子式为C10H12O4
B.分子中含有3个手性碳原子
C.1mlX最多可与3mlBr2发生加成反应
D.一定条件下,能发生加聚反应,也能发生缩聚反应
3.设表示阿伏加德罗常数的值。葡萄糖的结构简式用G—CHO表示,用新制的氢氧化铜检验葡萄糖的化学方程式为。正确的是
A.1mlG—CHO中含有的O—H键的数目为
B.该反应中,完全反应时,转移电子的数目为
C.溶液中含有的阴离子的数目小于0
D.1mlG—CHO完全反应时,生成的H2O中含有的极性键的数目为
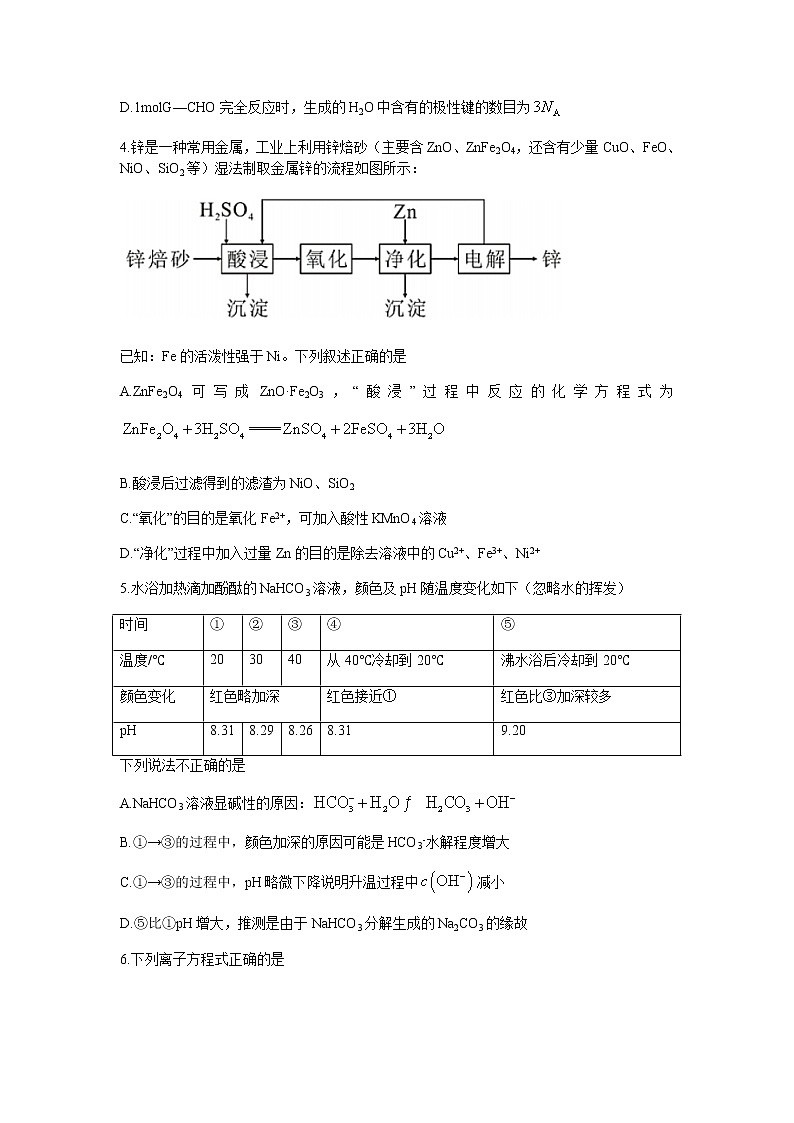
4.锌是一种常用金属,工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CuO、FeO、NiO、SiO2等)湿法制取金属锌的流程如图所示:
已知:Fe的活泼性强于Ni。下列叙述正确的是
A.ZnFe2O4可写成ZnO·Fe2O3,“酸浸”过程中反应的化学方程式为
B.酸浸后过滤得到的滤渣为NiO、SiO2
C.“氧化”的目的是氧化Fe2+,可加入酸性KMnO4溶液
D.“净化”过程中加入过量Zn的目的是除去溶液中的Cu2+、Fe3+、Ni2+
5.水浴加热滴加酚酞的NaHCO3溶液,颜色及pH随温度变化如下(忽略水的挥发)
下列说法不正确的是
A.NaHCO3溶液显碱性的原因:
B.①→③的过程中,颜色加深的原因可能是HCO3-水解程度增大
C.①→③的过程中,pH略微下降说明升温过程中减小
D.⑤比①pH增大,推测是由于NaHCO3分解生成的Na2CO3的缘故
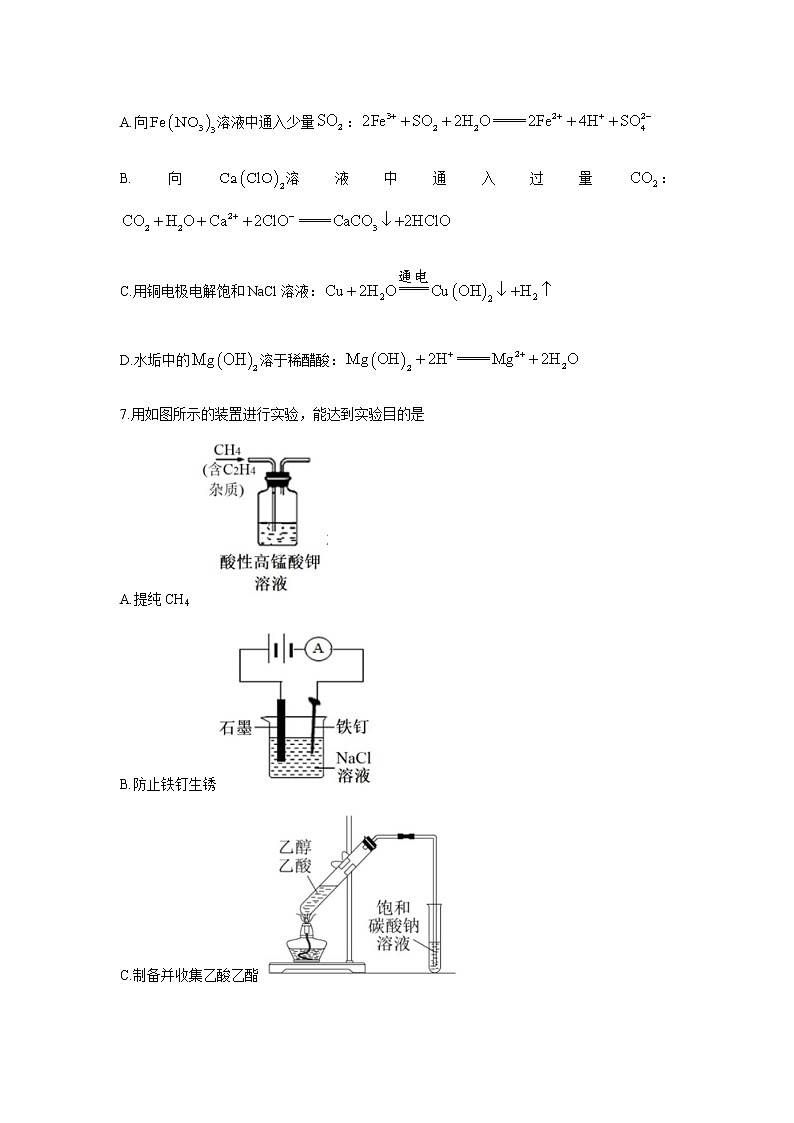
6.下列离子方程式正确的是
A.向溶液中通入少量:
B.向溶液中通入过量:
C.用铜电极电解饱和NaCl溶液:
D.水垢中的溶于稀醋酸:
7.用如图所示的装置进行实验,能达到实验目的是
A.提纯CH4
B.防止铁钉生锈
C.制备并收集乙酸乙酯
D.收集氨气
8.化合物甲是一种重要的医药中间体,其结构式如图所示。其中Q、W、X、Y、Z为原子半径依次递增的短周期元素,Q、X、Z分列于三个不同周期。下列说法错误的是
A.非金属性:X
C.化合物甲中除Q外,其它原子均满足8电子稳定结构
D.相同浓度的最高价氧化物对应水化物的酸性:Y>Z
9.科学家设想利用图示装置进行CO2的固定,同时产生电能。该装置工作时,生成的碳附着在电极上。下列说法错误的是
A.电解板(Li)作该电池的负极
B.若导线中流过4mle-,理论上负极区减少4mlLi+
C.负极区不适合选用水溶液作电解质溶液
D.采用多孔催化剂电极有利于CO2扩散到电极表面
10.常温下,等浓度MOH碱溶液和HA酸溶液互相滴定,溶液中pH与或的关系如图所示,下列说法错误的是
A.B.水的电离程度:
C.e、f点对应溶液中相等D.g点酸碱恰好完全中和且溶液呈中性
二、填空题(本题包括5小题,共60分)
11.(14分)五氧化二钒(V2O5)在冶金、催化剂、磁性材料等领域有重要作用。实验室以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备V2O5的一种工艺流程如下:
已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
请回答下列问题:(1)pH<4.0时中钒元素的化合价为________________。
(2)含钒废料中的有机物主要在________________________________工序中除去。
(3)“焙烧”产物之一是,写出它在“酸浸”(溶液pH<2)过程中发生反应的化学方程式____________________________________________________________________________
(4)常温时,若“调pH净化I”工序中最终溶液pH=7,通过计算判断,此时Cu2+是否已经沉淀完全,并写出计算过程(已知离子浓度认为沉淀完全;___________(填“是”或“否”),___________________________________________________。
(5)“净化Ⅱ”时若加入过量的,可能导致的后果为_______________________________。
(6)“滤渣2”中含有,写出生成的离子方程式_____________________________________________________________________________。
(7)“煅烧”时,除生成V2O5外,还生成了参与大气循环的气体,写出煅烧时的化学方程式_____________________________________________________________________________。
12.(12分)(1)金属与硝酸反应通常不能生成H2,用3ml·L-1HNO3与过量铁粉反应,HNO3的还原产物主要是NO,请写出反应的离子方程式:________________________________________。
有同学在查阅文献时发现文献有记载:HNO3与铁反应能产生H2。于是其小组进行了金属铁与硝酸反应能否产生H2及其有利条件的探究。
实验Ⅰ:20℃,将过量铁粉溶于0.5ml·L-1HNO3中,立即有无色气体生成,充分反应后,溶液几乎无色。
(2)检验气体:方法如图所示。
确认气体是H2,不含NO。实验证据是_______________________________________________。
(3)检验溶液:取上层清液,等分两份
①向一份滴加溶液,_______________________________(填现象),说明含有Fe2+。
②向另一份加入NaOH溶液,产生灰绿色沉淀;加热至沸,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验Ⅰ中发生的反应有,另外还有____________________________________________________(写出离子方程式)。
(4)对H2产生的原因提出假设:在稀的酸性溶液中,HNO3中H+的氧化性大于,验证如下:实验Ⅱ:将铜粉溶于中。经检测,发现没有____________生成,初步证实假设不成立。
(5)再次查阅文献发现:在酸性介质中,尽管电极电势数据显示离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。
于是小组改变条件重复实验Ⅰ,向中加入过量铁粉,结果如下:
经检验,实验Ⅲ、Ⅳ、Ⅴ中,的还原产物与实验Ⅰ相同。从反应速率的角度解释温度升高H2体积减少的原因__________________________________________________________。
13.(12分)汽车尾气是否为导致空气质量问题的主要原因,由此引发的“汽车限行”争议,是当前备受关注的社会性科学议题。(1)反应 可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如下图所示(TS表示过渡态、IM表示中间产物)。三个基元反应中,属于放热反应的是________(填标号①、②或③)图中_________.
(2)探究温度、压强(2MPa、5MPa)对反应的影响,如下图所示,表示2MPa的是反应__________(填标号a、b、c、或d)。
(3)在一定温度下向容积为2L的密闭容器中加入0.5mlNO、0.5mlCO,此时容器总压为1×105Pa,发生上述反应,4min时达平衡,此时测得氮气的物质的量为0.2ml,则0~4min内用CO2表示的的平均速率为__________________该反应的为__________________
[标准平衡常数,其中为标准压强,、p(CO2)、p(CO)和p(NO)为各组分的平衡分压[已知,其中p为平衡总压,为平衡系统中NO的物质的量分数]
(4)用NH3可催化消除NO污染:
①某条件下该反应速率,,
该反应的平衡常数,则a=____________,b=____________。
②一定温度下,在体积为1L的恒容密闭容器中加入4mlNH3和6mlNO发生上述反应,若在相同时间内测得NH3的转化率随温度的变化曲线如右图,400℃~900℃之间NH3的转化率下降由缓到急的原因是_______________________________________________
14.(10分)在过渡元素中可以寻找催化剂和耐高温、耐腐蚀的合金材料;氟、氯、硫、磷等可用于农药的制作。回答下列问题:
(1)基态铬的价电子排布图为_______________。
(2)Ni(CO)4与Ni之间的相互转化可用于金属Ni的分离提纯,Ni(CO)4常用作催化剂。
①Ni(CO)4中σ键和π键的数目之比为_______________。
②Ni(CO)4中CO的三键键长_______________(填“>”“<”或“=”)游离态CO的三键键长,可能的原因为____________________________________________________________。
(3)TiO2与光气(COCl2)、氯化亚砜(SOCl2)等反应可以制得TiCl4,用于制造虹彩剂、烟雾、颜料等。
①光气中所含元素的电负性由大到小的顺序为______________________________。
②氯化亚砜中心原子的杂化方式为_______________杂化,光气是_______________分子(填“极性”或“非极性”)。
(4)某离子型铁氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为_______________。
15.(10分)香豆素又名1,2-苯并吡喃酮,白色斜方晶体或结晶粉末,最早是1820年从香豆的种子中发现的,由此得名。实验室中可以通过如下路线合成香豆素。
已知:①B可以发生银镜反应;
②I和K分子中均含两个六元环结构。
回答下列问题:
(1)H的化学名称为_______________;L中含氧官能团的名称是____________________________。
(2)K的结构简式为______________。
(3)由B到C的反应类型为______________。
(4)I到J的反应方程式为______________。
(5)芳香族化合物X是L的同分异构体,满足下列条件的有______________种(注:碳碳双键或碳碳三键上连接羟基结构不予考虑)。
其中能够和NaHCO3溶液反应的结构简式为______________(写出一种即可)。
①分子结构中除了苯环外,无其它环状结构;
②能使溴的CCl4溶液褪色;
③核磁共振氢谱为四组峰,峰面积比为1:2:2:1。
12月考参考答案
1-10:ABADC CBDBC
11.(14分)(1)+5(1分)
(2)焙烧(2分)
(3)(2分)
(4)是;(1分)
(2分)
(5)会生成NH4VO3沉淀,降低钒的利用率(2分)
(6)(生成CO2其他均正确也给分)(2分)
(7)(2分)
12.(12分)(1)(2分)
(2)气体遇空气未见红棕色;点燃肥皂泡,发出爆鸣声(2分)
(3)产生蓝色沉淀(2分)(2分)
(4)H2(2分)
(5)温度升高,H+、表现氧化性自身被还原的速率均增大,参与反应的速率增大得更多,且同时消耗H+;使H+浓度下降,得电子(表现氧化性)的机会减少,导致产生H2的体积减少(2分)
13.(14分)(1)②③(2分);554.9(2分)
(2)a(2分)
(3)0.05(2分);320(2分)
(4)①5 0;(2分,各1分)
②400℃~700℃随温度升高,平衡向逆向移动,转化率逐渐减小;700℃以后,催化剂失活,反应速率急剧下降导致转化率迅速变小(2分)
14.(10分)(1)(1分)
(2)①1:1(1分)②>(1分)在Ni(CO)4分子中,由于C提供孤电子对形成配位键,导致C和O原子轨道重叠程度减小(2分)
(3)①O>Cl>C(1分)②sp3(1分)极性(1分)
(4)Fe3O4(2分)
15.(10分)(1)邻羟基苯甲醛或2-羟基苯甲醛(1分)酯基(1分)
(2)(1分)
(3)加成反应(1分)
(4)(2分)
(5)10(2分)
写出其中一种
时间
①
②
③
④
⑤
温度/℃
20
30
40
从40℃冷却到20℃
沸水浴后冷却到20℃
颜色变化
红色略加深
红色接近①
红色比③加深较多
pH
8.31
8.29
8.26
8.31
9.20
溶液pH
<4.0
6.0—8.0
8.0—10.0
钒元素主要存在形式
实验序号
Ⅲ
Ⅳ
Ⅴ
温度
20℃
40℃
60℃
生成H2体积
6.0mL
3.4mL
2.6mL
福建省厦门第一中学2023-2024学年高三上学期期中考试化学试题(Word版附解析): 这是一份福建省厦门第一中学2023-2024学年高三上学期期中考试化学试题(Word版附解析),共19页。试卷主要包含了可能用到的相对原子质量, 某电池材料结构如图所示等内容,欢迎下载使用。
福建省厦门市第一中学2023-2024上学期高三上学期12月考化学试题(Word版附解析): 这是一份福建省厦门市第一中学2023-2024上学期高三上学期12月考化学试题(Word版附解析),共20页。试卷主要包含了可能用到的相对原子质量, 下列有关离子方程式不正确的是, 苯甲酸是一种常用的食品防腐剂, 设NA为阿伏加德罗常数的值等内容,欢迎下载使用。
福建省厦门第二中学2023-2024学年高三上学期8月阶段考试化学试题: 这是一份福建省厦门第二中学2023-2024学年高三上学期8月阶段考试化学试题,共4页。











