





江苏专用高考化学总复习专题二化学物质及其变化第3讲第2课时氧化还原反应方程式的配平与拓展课件
展开近几年高考化学试题的主观题中,新情境下陌生氧化还原反应方程式的书写 与配平是最常见的考查方式。除了已知反应物和生成物,利用氧化还原反应 方程式的配平方法书写方程式外,有时还会出现缺项方程式的配平。该类氧 化还原反应方程式一般结合实际情境或化工流程中物质的转化判定所缺物 质,同时结合离子反应进行考查,题目综合性强,难度较大。备考过程中要结 合实例,确定解题流程,分类突破。
一、氧化还原方程式的配平类型一 直接型氧化还原反应方程式的配平
如配平下列反应的离子方程式:MnO(OH)2+I-+H+ Mn2++I2+H2O[流程应用]
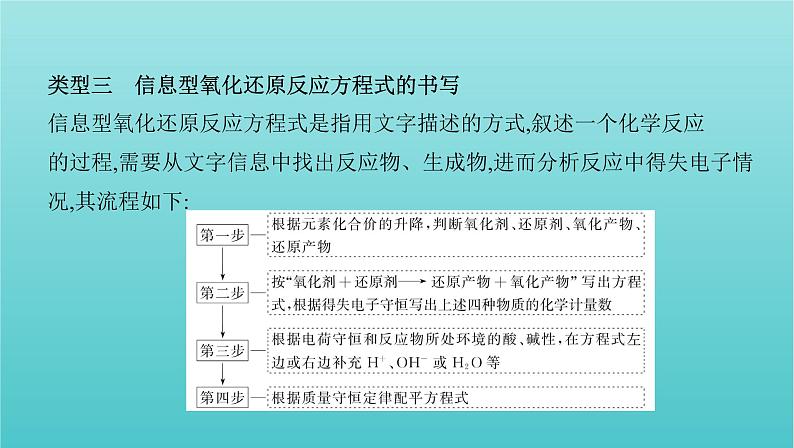
类型三 信息型氧化还原反应方程式的书写信息型氧化还原反应方程式是指用文字描述的方式,叙述一个化学反应 的过程,需要从文字信息中找出反应物、生成物,进而分析反应中得失电子情 况,其流程如下:
如+6价Cr的化合物毒性较大,常用NaHSO3将废液中的Cr2 还原成Cr3+,该反应的离子方程式为 。[流程应用]
二、竞争型离子反应和氧化还原反应如果溶液中存在多种离子,则相互之间发生的反应可能有多种,此时溶液中可能发生“平行反应”,也可能发生“竞争反应”。“平行反应”是指离子之间同时反应互不影响,而“竞争反应”是指各个反应要按照一定的顺序完成。“竞争反应”的常见类型如下:
1.一种氧化剂(还原剂)与多种还原剂(氧化剂)反应,如把Cl2通入含有I-、Br-、 Fe2+的溶液中,按照还原能力由强到弱的顺序,I-优先反应,其次是Fe2+,最后是Br-。
2.一种酸(碱)与多种碱性(酸性)物质反应,如把盐酸逐滴加入含有NaOH、Na2CO3、NaHCO3的混合溶液中,按照碱性由强到弱的顺序,NaOH优先反应,其次 是Na2CO3,最后是NaHCO3。3.若某一溶液中同时存在几种能与所加试剂形成类型相似的沉淀的离子,则 溶解度(严格来说应为溶度积)小的物质先沉淀。如向AlCl3、FeCl3的混合溶 液中逐滴加入氢氧化钠溶液,应优先生成Fe(OH)3沉淀,而不是Al(OH)3沉淀。4.互相促进水解的反应与复分解反应如果既符合发生互相促进水解反应的条件,又符合直接发生复分解反应的条 件,究竟发生哪个反应,要具体情况具体分析。
1.易错易混辨析(正确的画“√”,错误的画“✕”)。(1)向水中加入一小块钠:Na+2H2O NaOH+H2↑ ( )(2)向FeCl2溶液中通入Cl2:FeCl2+Cl2 FeCl3 ( )(3)MnO2和浓盐酸混合加热:MnO2+4H++4Cl- Mn2++2Cl2↑+2H2O ( )(4)向稀硝酸中加入铜片:Cu+2H++N Cu2++NO↑+H2O( )
3.某高温还原法制备新型氮化铝(AlN)陶瓷的反应体系中的物质有Al2O3、C、N2、AlN、CO。请将AlN之外的反应物与生成物分别填入以下空格 内,并配平。
4.(1)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发 生反应的离子方程式为 2Fe2++H2O2+2H+ 2Fe3++2H2O 。(2)已知Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标准状况下的密度为1.518 g·L-1),写出该反应的离子方程式: Fe3S4+6H+ 3H2S↑+3Fe2++S 。(3)一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中B (B元素的化合价为+3价)与Fe2+反应生成纳米铁粉、H2和B(OH ,其离子方程式为 2Fe2++B +4OH- 2Fe+2H2↑+B(OH 。
考点一 氧化还原反应方程式的配平与书写
题组一 氧化还原反应方程式的配平
1.配平下列方程式。(1) Mn + Fe2++ Mn2++ Fe3++ (2) Cl + Fe2++ Cl-+ Fe3++ (3) NaBO2+ SiO2+ Na+ H2 NaBH4+ Na2SiO3(4) LiCO2+ H2SO4+ H2O2 Li2SO4+ CSO4+ O2↑+
2.(2020浙江舟山模拟)已知氧化性:Br2>Fe3+。FeBr2溶液中通入一定量的Cl2, 发生反应的离子方程式为aFe2++bBr-+cCl2 dFe3++eBr2+fCl-,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的 是 ( )A.2 4 3 2 2 6 B.0 2 1 0 1 2C.2 0 1 2 0 2 D.2 2 2 2 1 4
解析 根据题意,Cl2先氧化Fe2+,不可能先氧化Br-,B选项错误。
方法技巧氧化还原反应方程式的配平技巧(1)全变从左边配:氧化剂、还原剂中某元素化合价全变的,一般从左边反应 物着手配平。(2)自变从右边配:自身氧化还原反应(包括分解反应、歧化反应)一般从右边 着手配平。(3)缺项配平法:先将得、失电子数配平,再观察两边电荷。若反应物一侧缺 正电荷,一般加H+,生成物一边加水;若反应物一侧缺负电荷,一般加OH-,生成 物一边加水,然后将两边电荷数配平。(4)当化学方程式中有多个缺项时,应根据化合价的变化找准氧化剂、还原 剂、氧化产物、还原产物。
题组二 氧化还原反应方程式的书写
4.高铁酸钾(K2FeO4)是一种易溶于水、高效的多功能水处理剂。工业上通常 先制得高铁酸钠,然后在一定温度下,向高铁酸钠溶液中加入KOH至饱和,从 而使高铁酸钾析出。(1)高铁酸钾中铁元素的化合价为 +6价 ,推测其具有的化学性质是 强氧化性 。(2)高铁酸钾与水反应生成O2、Fe(OH)3(胶体)和KOH。①该反应的离子方程式为 4Fe +10H2O 4Fe(OH)3(胶体)+8OH-+3O2↑ 。②高铁酸钾作为水处理剂起到的作用是 杀菌消毒、净水 。
(3)①在无水条件下制备高铁酸钠的主要反应为2FeSO4+aNa2O2 2Na2FeO4+bX+2Na2SO4+cO2↑,该反应中物质X的化学式为 Na2O ,b与c的关系是 b=2c 。②一定温度下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,原因是 相同条件下高铁酸钾的溶解度小于高铁酸钠的溶解度 。(4)在碱性条件下,由氯化铁、氯气可制备高铁酸钾,写出该反应的离子方程 式: 2Fe3++3Cl2+16OH- 2Fe +6Cl-+8H2O 。
解析 (1)根据化合物中各元素正、负化合价的代数和为零,可得K2FeO4中铁 元素的化合价为+6价;高铁酸钾中铁元素处于高价态,因此高铁酸钾具有强氧 化性。(2)①高铁酸钾与水反应生成O2、Fe(OH)3(胶体)和KOH,反应的离子方程式为 4Fe +10H2O 4Fe(OH)3(胶体)+8OH-+3O2↑。②高铁酸钾具有强氧化性,作为水处理剂能起到杀菌消毒的作用,同时其还原产物为Fe(OH)3胶体,又 能起到净水的作用。(3)①根据元素守恒和得失电子守恒可知,X应是Na2O,根据钠元素守恒有2a=8+2b,根据氧元素守恒有2a=8+b+2c,两式联立,可得b=2c。②一定温度下,向高
铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,原因是相同条件下高铁酸钾 的溶解度小于高铁酸钠的溶解度。(4)用氯气在碱性条件下氧化氯化铁可制备高铁酸钾,根据得失电子守恒、原 子守恒及电荷守恒,反应的离子方程式为2Fe3++3Cl2+16OH- 2Fe +6Cl-+8H2O。
考点二 氧化还原反应的相关计算
1.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反 应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为 ( )A.2 B.3 C.4 D.5
2.(2020江苏第二次大联考)某三价铁配合物的化学式可表示为Ka[Feb(C2O4)c]· xH2O,为测定其组成,进行如下实验:步骤1:称取1.964 0 g该配合物晶体,配制成250.00 mL溶液。步骤2:取25.00 mL所配溶液于锥形瓶中,加入5.0 mL 1 ml·L-1硫酸,加热到70~ 85 ℃,用0.010 0 ml·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液48.00 mL。步骤3:向反应后的溶液中加入一定量锌粉。加热至黄色恰好消失,过滤,洗涤, 将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。步骤4:继续用0.010 0 ml·L-1 KMnO4溶液滴定步骤3所得溶液至终点,消耗 KMnO4溶液8.00 mL。
(1)步骤2中,KMnO4将C2 氧化为CO2,该滴定反应的离子方程式为 5C2 +2Mn +16H+ 10CO2↑+2Mn2++8H2O 。(2)步骤3中黄色消失的原因是 2Fe3++Zn 2Fe2++Zn2+ (用离子 方程式表示)。(3)配制配合物溶液的过程中,若定容时俯视容量瓶的刻度线,则最终所得晶 体组成中水的含量 偏小 (填“偏大”“偏小”或“无影响”)。(4)通过计算确定该三价铁配合物的化学式(写出计算过程)。
答案 (4)根据滴定反应5C2 +2Mn +16H+ 10CO2↑+2Mn2++8H2O和5Fe2++Mn +8H+ 5Fe3++Mn2++4H2O,可知250.00 mL溶液中各微粒的物质的量分别为n(C2 )= n(Mn )×10= ×0.010 0 ml·L-1×48.00 mL×10-3 L·mL-1×10=0.012 mln(Fe3+)=n(Fe2+)=5n(Mn )×10=5×0.010 0 ml·L-1×8.00 mL×10-3 L·mL-1×10=0.004 ml据电荷守恒得:n(K+)=2×0.012 ml-3×0.004 ml=0.012 ml
名师总结应用得失电子守恒解题的一般步骤(1)“一找各物质”:找出氧化剂、还原剂及相应的还原产物和氧化产物。(2)“二定得失数”:确定一个原子或离子得失电子数(注意化学式中原子的 个数)。(3)“三列关系式”:根据题中物质的物质的量和得失电子守恒列出等式。n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价原子个数×化合价变化值。
题组二 多步氧化还原反应的计算
4.将足量Cl2缓缓通入含0.02 ml H2SO3和0.02 ml HBr的混合溶液中。在此 过程中溶液的pH与Cl2通入量的关系示意图是(溶液体积变化忽略不计,且不 考虑Cl2与水反应) ( )
名师总结抓住“始态”与“终态”突破多步氧化还原反应的计算在多步连续进行的氧化还原反应中,只要中间各步反应过程中电子没有损耗, 则可以利用反应过程中转移电子的数目相等,找出“始态物质”与“终态物 质”化合价发生变化的元素,再根据化合价升高总数和化合价降低总数相等, 建立两者之间物质的量的关系而进行快速求解。例如:a ml的铜与足量的浓HNO3反应,将产生的NO2气体与b ml的O2混合通 入水中,气体完全被吸收。则“始态物质Cu” Cu2+,
“中间物质HNO3” NO2↑, 故“始态物质Cu”与“终态物质O2”之间物质的量的关系为2Cu~O2,即a=2b。
1.(2020江苏单科,20节选)(1)CO2催化加氢。在密闭容器中,向含有催化剂的 KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式 为 HC +H2 HCOO-+H2O 。
2.(2019江苏单科,16,12分)N2O、NO和NO2等氮氧化物是空气污染物,含有氮 氧化物的尾气需处理后才能排放。(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为 2NH3+2O2 N2O+3H2O 。(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应 为NO+NO2+2OH- 2N +H2O2NO2+2OH- N +N +H2O
①下列措施能提高尾气中NO和NO2去除率的有 BC (填字母)。A.加快通入尾气的速率B.采用气、液逆流的方式吸收尾气C.吸收尾气过程中定期补加适量NaOH溶液②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质 是 NaNO3 (填化学式);吸收后排放的尾气中含量较高的氮氧化物是 NO (填化学式)。(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除 率。其他条件相同,NO转化为N 的转化率随NaClO溶液初始pH(用稀盐酸
调节)的变化如图所示。①在酸性NaClO溶液中,HClO氧化NO生成Cl-和N ,其离子方程式为 3HClO+2NO+H2O 3Cl-+2N +5H+ 。②NaClO溶液的初始pH越小,NO转化率越高。其原因是 溶液pH越小,溶液中HClO的浓度越大,氧化NO的能力越强 。
人教版高考化学一轮总复习第1章第3节第2课时氧化还原反应的计算与方程式的配平课时教学课件: 这是一份人教版高考化学一轮总复习第1章第3节第2课时氧化还原反应的计算与方程式的配平课时教学课件,共60页。PPT课件主要包含了环节1高考热点突破,环节2新情境专项练等内容,欢迎下载使用。
第一章 化学物质及其变化 第5讲 氧化还原反应的计算与方程式的配平: 这是一份第一章 化学物质及其变化 第5讲 氧化还原反应的计算与方程式的配平,文件包含第5讲氧化还原反应的计算与方程式的配平pptx、第5讲热点强化3信息型方程式的书写pptx、第5讲氧化还原反应的计算与方程式的配平docx、第5讲热点强化3信息型方程式的书写docx等4份课件配套教学资源,其中PPT共71页, 欢迎下载使用。
新教材高考化学总复习专题二化学物质及其变化第3讲氧化还原反应课件: 这是一份新教材高考化学总复习专题二化学物质及其变化第3讲氧化还原反应课件,共60页。












