





2022届高三化学二轮总复习 专题突破 专题三 离子反应 氧化还原反应课件PPT
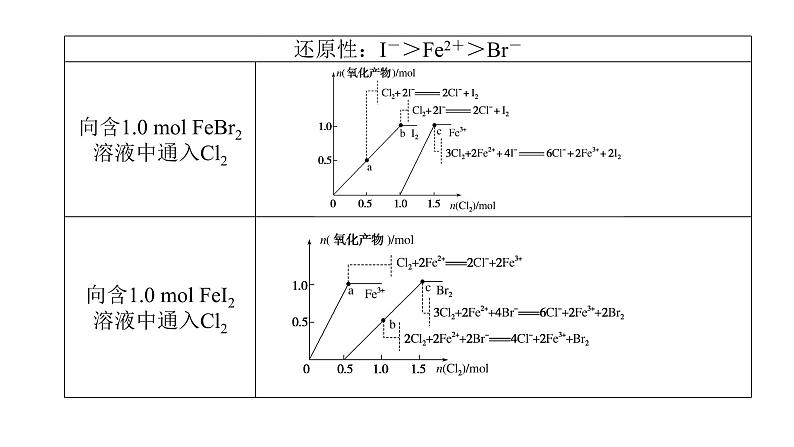
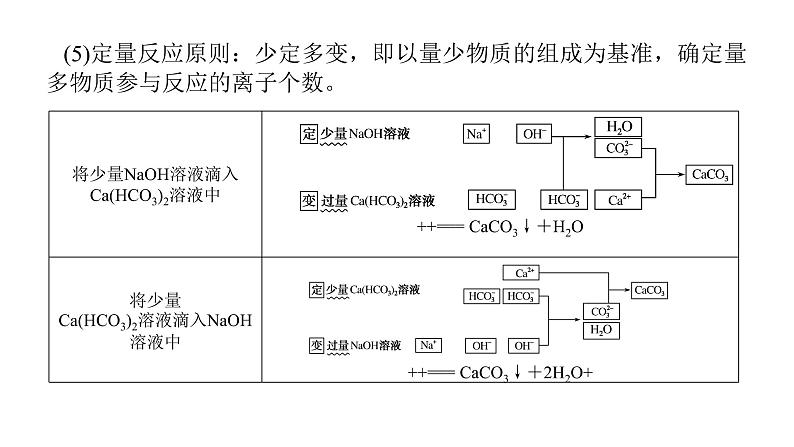
展开专题三 离子反应 氧化还原反应知识点一 离子反应 (5)定量反应原则:少定多变,即以量少物质的组成为基准,确定量多物质参与反应的离子个数。2.条件控制原则(1)温度,如NH4Cl与NaOH溶液反应时,只有在浓溶液且加热条件下才生成NH3,否则生成NH3·H2O。(2)浓度,如浓盐酸可与MnO2在加热条件下反应制备Cl2,稀盐酸不反应。按要求书写离子方程式:(1)Na和水的反应:________________________________;(2)Na和CuSO4溶液的反应:_________________________________________;2Na+2H2O===2Na++2OH-+H2↑2Na+2H2O+Cu2+===2Na++Cu(OH)2↓+H2↑(3)实验室用MnO2和浓盐酸反应制Cl2:_________________________________________________;(4)Cl2的尾气处理:________________________________;(5)将SO2气体通入溴水中:_________________________________________________;(6)将Cl2通入H2SO3溶液中:_________________________________________________; Cl2+2OH-===Cl-+ClO-+H2O (7)将H2O2滴入H2SO3溶液中:________________________________________________;(8)将H2S气体通入CuSO4溶液中:________________________________________________;(9)将少量SO2气体通入Na2CO3溶液中:________________________________________________; H2S+Cu2+===2H++CuS↓ (10)将过量CO2气体通入Na2SiO3溶液中:__________________________________________________;(11)Al和NaOH溶液的反应:__________________________________________________;(12)AlCl3和过量氨水的反应:__________________________________________________; (13)将AlCl3与NaHCO3溶液混合:___________________________________;(14)Fe和过量稀HNO3的反应:___________________________________;(15)将H2O2滴入FeCl2溶液中:___________________________________; 2Fe2++H2O2+2H+===2Fe3++2H2O(16)在酸性溶液中,将FeCl3溶液与KI溶液混合:________________________________________;(17)向苯酚钠溶液中通入少量CO2:_______________________________________________________;(18)苯酚溶液滴入Na2CO3溶液中:________________________________________________________。2Fe3++2I-===2Fe2++I23.离子共存问题审题“三大”注意(1)审清题干中的要求:①一定能大量共存;②可能大量共存;③不能大量共存。(2)应注意题干中提示的水的电离程度:当由水电离出的c(H+)或c(OH-)小于1×10-7 mol·L-1时,水的电离受到抑制,溶液可能为酸性溶液或碱性溶液;当由水电离出的c(H+)或c(OH-)大于1×10-7 mol·L-1时,水的电离得到促进,溶液可能为弱酸盐溶液或弱碱盐溶液。(3)注意正确理解“透明溶液”,如:NaCl溶液、KOH溶液为无色透明溶液,CuSO4溶液、FeCl3溶液是有色透明溶液,不能认为“有色”就“不透明”。 4.掌握常见离子的检验Ⅰ.常见阳离子的检验Ⅱ.常见阴离子的检验 ×××××××√√√ H+ I- Mg2+、Al3+ ⑤另取③中的部分碱性溶液,加入Na2CO3溶液,有白色的沉淀产生,则溶液中一定含有__________,一定不含有__________。通过上述实验可以判断溶液中一定存在的离子是________________,一定不存在的离子是_________________________________;不能确定的离子是__________,要进一步确定该离子,需补充的实验是____________(写实验名称)。Ba2+ K+、Na+焰色反应 答案:A 2.[2021·湖南卷]对下列粒子组在溶液中能否大量共存的判断和分析均正确的是( )答案:B 答案:C 答案:C 答案:A 答案:D 题组二 离子共存3.在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是( )答案:C 答案:C解析:pH=2的溶液呈酸性,酸性条件下S2-不能大量共存,故A错误;Br-能大量存在的溶液具有强氧化性或含有Ag+等,如为强氧化性,则Fe2+不能大量共存,如含有Ag+,则Cl-不能大量共存,故B错误;c(H+)=10-12 mol·L-1的溶液呈碱性,碱性条件下,离子之间不发生任何反应,可大量共存,故C正确;SCN-与Fe3+发生络合反应而不能大量共存,故D错误。 答案:B 答案:D 方法技巧:(1)坚持四原则,突破离子推断问题①肯定性原则:结合实验现象推出肯定存在或肯定不存在的物质或离子。②互斥性原则:在肯定某些离子存在的同时,结合离子共存规律,否定一些离子的存在。③进出性原则:注意实验过程中反应生成的离子或引入的离子对后续实验的干扰。④电中性原则:溶液中既要有阳离子,也要有阴离子。(2)电荷守恒法确定离子定量推断最后一种离子存在的方法:如果多种离子共存,且只有一种离子的物质的量未知,可以用电荷守恒来确定最后一种离子是否存在,即阳离子所带正电荷总数等于阴离子所带负电荷总数。解透题型知识点二 氧化还原反应核心知识再现1.氧化还原反应规律(1)氧化还原反应规律①守恒规律化合价升高总数与降低总数相等,实质是氧化还原反应中得失电子总数相等。②先后规律同一体系中,当有多种还原剂(氧化剂)时,氧化剂(还原剂)通常先和还原性(氧化性)最强的还原剂(氧化剂)反应,反应顺序遵循“强者先行”的规律。如向含等物质的量浓度的S2-、I-、Fe2+、Br-的溶液中,缓慢通入氯气,还原性最强的离子最先被氧化,先后顺序为S2->I->Fe2+>Br-;向含等物质的量浓度的Fe3+、Cu2+、H+、Ag+的溶液中,缓慢加入足量镁粉,氧化性越强的离子越先发生反应,先后顺序为Ag+>Fe3+>Cu2+>H+。③价态规律变价元素处于最高价态时只有氧化性(如H2SO4中的硫元素),处于最低价态时只具有还原性(如H2S中的硫元素),处于中间价态时既具有氧化性又具有还原性(如SO2中的硫元素)。④邻位转化规律同种元素不同价态间发生氧化还原反应时,元素的化合价遵循只靠近不交叉,最多达到2.氧化还原方程式配平高考真题演练1.[2020·山东卷]下列叙述不涉及氧化还原反应的是( )A.谷物发酵酿造食醋B.小苏打用作食品膨松剂C.含氯消毒剂用于环境消毒D.大气中NO2参与酸雨形成答案:B解析:本题考查氧化还原反应的判断。谷物发酵酿造食醋过程中CH3CH2OH转化为CH3COOH属于氧化还原反应,A项不符合题意;小苏打用作食品膨松剂利用的是NaHCO3受热分解会放出CO2的性质,不涉及氧化还原反应,B项符合题意;含氯消毒剂具有较强的氧化性,消毒时发生氧化还原反应,C项不符合题意;大气中的NO2形成酸雨时发生反应3NO2+H2O===2HNO3+NO,该反应属于氧化还原反应,D项不符合题意。2.[2020·北京卷]水与下列物质反应时,水表现出氧化性的是( )A.Na B.Cl2C.NO2 D.Na2O答案:A解析:A项,2Na+2H2O===2NaOH+H2↑,H2O中H元素化合价由+1降为0价,得电子被还原,做氧化剂,在反应中表现出氧化性,故A符合题意;B项,Cl2+H2O⇌HCl+HClO,H2O中的元素没有发生化合价的变化,水在反应中既不是氧化剂也不是还原剂,既不表现氧化性也不表现还原性,故B不符合题意;C项,3NO2+H2O===2HNO3+NO,H2O中的元素没有发生化合价的变化,水在反应中既不是氧化剂也不是还原剂,既不表现氧化性也不表现还原性,故C不符合题意;D项,Na2O+H2O===2NaOH,该反应没有元素化合价变化,不是氧化还原反应,水在反应中既不表现氧化性也不表现还原性,故D不符合题意。3.[2020·北京卷]下列物质的应用中,利用了氧化还原反应的是( )A.用石灰乳脱除烟气中的SO2B.用明矾[KAl(SO4)2·12H2O]处理污水C.用盐酸去除铁锈(主要成分Fe2O3·xH2O)D.用84消毒液(有效成分NaClO)杀灭细菌答案:D解析:A项,SO2是酸性氧化物,可与碱反应,用石灰乳脱除烟气中的SO2时,SO2与氢氧化钙反应生成亚硫酸钙或亚硫酸氢钙,反应过程中无元素的化合价变化,没有利用氧化还原反应,故A不符合题意;B项,用明矾[KAl(SO4)2·12H2O]溶于水中,电离出的铝离子发生水解生成氢氧化铝胶体,利用胶体的吸附性可吸附污水中的固体颗粒物,该过程利用胶体的吸附性,发生的反应没有发生化合价变化,没有利用氧化还原反应,故B不符合题意;C项,用盐酸去除铁锈(主要成分Fe2O3·xH2O),发生的主要反应为:6HCl+Fe2O3===2FeCl3+3H2O,反应中没有元素化合价的变化,没有利用氧化还原反应,故C不符合题意;D.用84消毒液(有效成分NaClO),具有强氧化性,能使蛋白质发生变性从而杀死细菌病毒,杀菌消毒的过程利用了氧化还原反应,故D符合题意。 答案:A 答案:C 6.[2021·山东卷](双选)实验室中利用固体KMnO4进行如图实验,下列说法错误的是( ) A.G与H均为氧化产物B.实验中KMnO4只作氧化剂C.Mn元素至少参与了3个氧化还原反应D.G与H的物质的量之和可能为0.25 mol答案:BD解析:KMnO4固体受热分解生成K2MnO4、MnO2、O2,K2MnO4、MnO2均具有氧化性,在加热条件下能与浓盐酸发生氧化还原反应,反应过程中Cl-被氧化为Cl2,K2MnO4、MnO2被还原为MnCl2,因此气体单质G为O2,气体单质H为Cl2。加热KMnO4固体的反应中,O元素化合价由-2升高至0被氧化,加热K2MnO4、MnO2与浓盐酸的反应中,Cl元素化合价由-1升高至0被氧化,因此O2和Cl2均为氧化产物,故A正确;KMnO4固体受热分解过程中,Mn元素化合价降低被还原,部分O元素化合价升高被氧化,因此KMnO4既是氧化剂也是还原剂,故B错误;Mn元素在反应过程中物质及化合价变化为,Mn元素至少参加了3个氧化还原反应,故C正确;每生成1 mol O2转移4 mol电子,每生成1 mol Cl2转移2 mol电子,若KMnO4转化为MnCl2过程中得到的电子全部是Cl-生成Cl2所失去的,则气体的物质的量最大,由2KMnO4~5Cl2可知,n(气体)max=0.25 mol,但该气体中一定含有O2,因此最终所得气体的物质的量小于0.25 mol,故D错误。 4防止单质碘析出 8.[2020·全国卷Ⅱ,26(3)(4)(5)](3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为________________________________。(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为________mol;产生“气泡”的化学方程式为___________________________________________。2Cl2+HgO===HgCl2+Cl2O1.25NaHCO3+NaHSO4===CO2↑+Na2SO4+H2O解析:(3)HgO与Cl2的反应为歧化反应,Cl2既是氧化剂又是还原剂,汞元素与氧元素化合价不变,故HgO与Cl2反应生成Cl2O的同时还生成HgCl2,依据得失电子守恒可知,生成HgCl2与Cl2O的物质的量之比为1∶1。(4)由题意可知NaClO2生成ClO2的反应为歧化反应,故 ,依据得失电子守恒可得,生成ClO2与NaCl的物质的量之比为4∶1,依据氯原子守恒可得,NaClO2与ClO2的物质的量之比为5∶4,每生成1 mol ClO2消耗NaClO2的量为1.25 mol;ClO2易溶于水,故“气泡”的成分只能是CO2,NaHSO4与NaHCO3反应生成Na2SO4、H2O和CO2。(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是________________________________(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1 000 kg该溶液需消耗氯气的质量为________kg(保留整数)。 ClO-+Cl-+2H+===Cl2↑+H2O203考点题组针对练题组一 复杂氧化还原反应分析1.[2021·烟台一中高三3月模拟]KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3氧化法”制备KIO3包括以下两个反应:①11KClO3+6I2+3H2O===6KH(IO3)2+3Cl2↑+5KCl②KH(IO3)2+KOH===2KIO3+H2O下列说法正确的是( )A.化合物KH(IO3)2中含有共价键、离子键和氢键等化学键B.反应①中每转移4 mol电子生成2.24 L Cl2C.向淀粉溶液中加入少量碘盐,溶液会变蓝D.可用焰色反应实验证明碘盐中含有钾元素答案:D 2.白磷(P4)是白色或浅黄色且有剧毒的固体,当白磷中毒时可用CuSO4溶液解毒,反应的化学方程式为:11P4+60CuSO4+96H2O===20Cu3P+24H3PO4+60H2SO4。下列关于该反应的叙述不正确的是( )A.该反应中P4既作氧化剂又作还原剂,作氧化剂的P4和作还原剂的P4的物质的量之比为5∶6B.5 mol CuSO4参加反应,被CuSO4氧化的P4的物质的量为0.5 molC.每产生1 mol H2SO4,转移电子的物质的量为2 mol D.生成物Cu3P中Cu的化合价为+1答案:B 答案:CD 答案:B 答案:C 6.某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100 mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。(1)该盐酸的物质的量浓度为________ mol·L-1。(2)该磁黄铁矿FexS中,x=________。8.50.85 (3)电子守恒法解题的思维流程①找出反应中的氧化剂、还原剂及相应的还原产物和氧化产物。②找出一个原子或离子得失电子数目,从而确定1 mol氧化剂或还原剂得失电子数目(注意化学式中原子或离子个数,如1 mol K2Cr2O7被还原为+3价的Cr得电子数是2×3NA)。③根据题目中各物质的物质的量和得失电子守恒列出等式:n(氧化剂)×变价原子数×化合价变化值=n(还原剂)×变价原子数×化合价变化值,从而求算出答案。题组三 氧化还原反应方程式配平7.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3===bO2↑+cCl2↑+dHClO4+eH2O。下列有关说法正确的是( )A.由反应可确定:氧化产物是HClO4B.由非金属性Cl>S,可推知酸性HClO3>H2SO4C.若化学计量数a=8,b=3,则该反应转移电子数为8e-D.若该反应所得1 mol混合气体质量为45 g,则反应可表示为:3HClO3 ===2O2↑+Cl2↑+HClO4+H2O答案:D 8.斑铜矿(Cu5FeS4)中Fe呈+2价,S呈-2价。斑铜矿在沸腾炉中转化成Cu2S、FeS和一种气体物质的化学方程式为___________________________________。高温下部分硫化物在沸腾炉中可变成氧化物,此时炉气的主要成分是________。 SO2、N2 9.配平以下化学方程式 方法技巧:缺项型氧化还原反应方程式的配平方法(1)配平方法:先用“化合价升降法”配平含有变价元素的物质的化学计量数,然后由原子守恒确定未知物,再根据原子守恒进行配平。(2)补项原则:
新高考化学二轮总复习 专题突破课件 专题三 离子反应 氧化还原反应(含解析): 这是一份新高考化学二轮总复习 专题突破课件 专题三 离子反应 氧化还原反应(含解析),共60页。PPT课件主要包含了Ⅱ常见阴离子的检验,Al3+,Ba2+,Na+,焰色反应,答案A,答案C,答案D,答案B,答案BD等内容,欢迎下载使用。
2023届高考化学二轮复习专题三氧化还原反应离子反应课件: 这是一份2023届高考化学二轮复习专题三氧化还原反应离子反应课件,共60页。PPT课件主要包含了内容索引,核心考点聚焦,专项热考突破,专题体系构建,N2O4,C2H8N2,6NA,答案B,答案D,AgNO3溶液等内容,欢迎下载使用。
高考化学二轮总复习优化设计 专题三 离子反应课件PPT: 这是一份高考化学二轮总复习优化设计 专题三 离子反应课件PPT













