
2022届高三二轮专题卷 化学(十一) 化学反应速率与平衡 学生版
展开专题十一
化学反应速率与平衡
一、选择题(本题共20小题,每题只有一个选项符合题意)
1.实验得知,溶解在CCl4中的N2O5分解反应如下:2N2O5=4NO2+O2;其反应浓度及速率如表:
组别
c0(N2O5)/(mol·L-1)
速率常数k
/(mol·L-1·min-1)
1
0.40
k
2.48×10-4
2
0.16
k
9.92×10-5
3
a
k
7.44×10-5
下列说法错误的是
A.该反应的速率方程为=k·c0(N2O5)
B.k=6.2×10-4min-1
C.a=0.12
D.浓度由0.16mol·L-1减小到amol·L-1,用时1min
2.在一定温度下的密闭容器中发生反应:,平衡时测得A的浓度为。保持温度不变,将容器的容积扩大到原来的二倍,再达平衡时,测得A的浓度为。下列有关判断正确的是
A. B.平衡向逆反应方向移动
C.B的转化率增大 D.C的体积分数增大
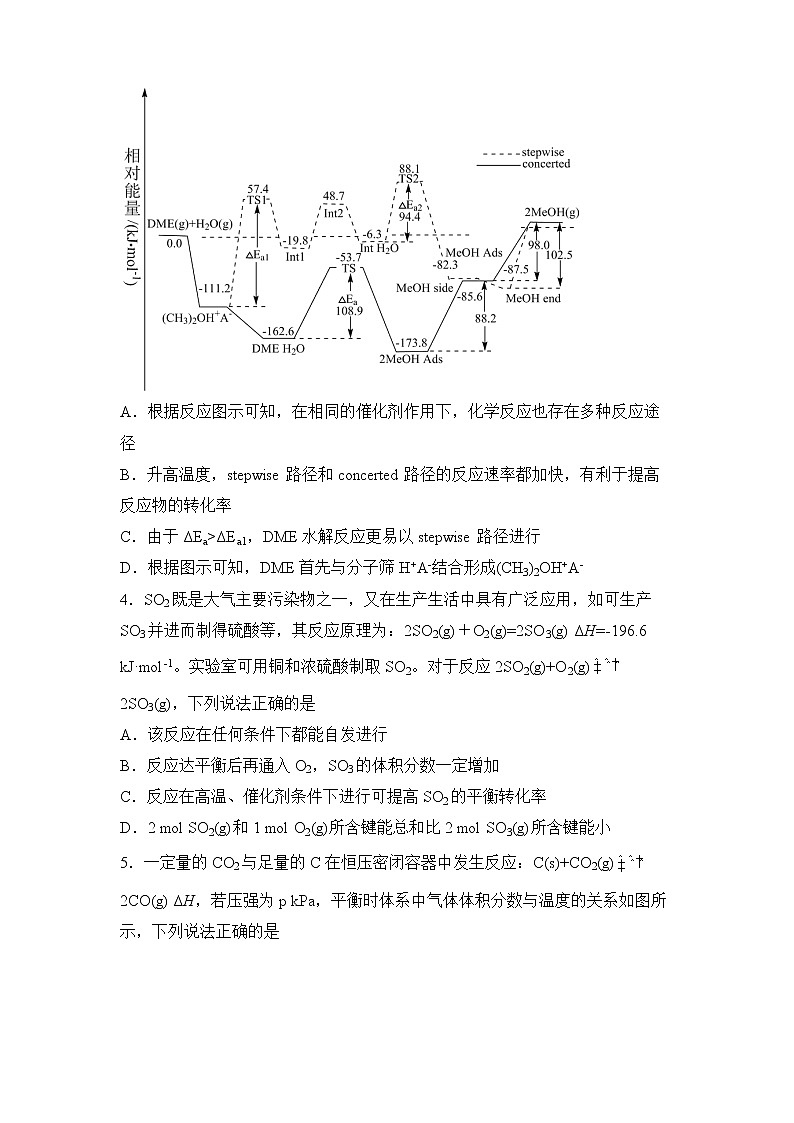
3.科学家研究二甲醚(DME)在H-ZSM-5分子筛(用H+A-表示)上的水解反应,其反应进程中能量变化如图所示。下列说法正确的是
A.根据反应图示可知,在相同的催化剂作用下,化学反应也存在多种反应途径
B.升高温度,stepwise路径和concerted路径的反应速率都加快,有利于提高反应物的转化率
C.由于ΔEa>ΔEa1,DME水解反应更易以stepwise路径进行
D.根据图示可知,DME首先与分子筛H+A-结合形成(CH3)2OH+A-
4.SO2既是大气主要污染物之一,又在生产生活中具有广泛应用,如可生产SO3并进而制得硫酸等,其反应原理为:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ·mol-1。实验室可用铜和浓硫酸制取SO2。对于反应2SO2(g)+O2(g)2SO3(g),下列说法正确的是
A.该反应在任何条件下都能自发进行
B.反应达平衡后再通入O2,SO3的体积分数一定增加
C.反应在高温、催化剂条件下进行可提高SO2的平衡转化率
D.2 mol SO2(g)和1 mol O2(g)所含键能总和比2 mol SO3(g)所含键能小
5.一定量的CO2与足量的C在恒压密闭容器中发生反应:C(s)+CO2(g)2CO(g) ΔH,若压强为p kPa,平衡时体系中气体体积分数与温度的关系如图所示,下列说法正确的是
A.该反应ΔH<0
B.650℃时CO2的平衡转化率为30%
C.t1℃时达平衡后若再充入等物质的量的CO和CO2气体,则平衡逆向移动
D.若密闭容器中混合气体密度不再变化时,该反应处于平衡状态
6.2021年为我国实现碳达峰、碳中和关键的一年,CO2综合利用的技术不断创新。某实验小组研究CO2和CH4反应得到合成气的原理为:。向体积为1L的密闭容器中充入和,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。下列有关说法正确的是
A.该反应的
B.压强:
C.1100℃时,该反应的平衡常数为12.96
D.反应达到平衡后在容器内再充入和,此时CO2的转化率会增大
7.一定温度下,反应MgCl2(l)Mg(l)+Cl2(g)达到平衡时,下列说法不正确的是
A.及时移除反应体系中的Mg(l),可以增大MgCl2(l)的转化率
B.恒压装置中,若减小装置体积为原来的一半,与原平衡相比,Cl2(g)的浓度不变
C.恒容装置中,若Cl2(g)浓度不再改变,则该反应达到平衡状态
D.温度升高可以增大MgCl2(l)的转化率
8.在一定温度和催化剂的条件下,发生。将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。下列的说法不正确的是
A.曲线I表示NH3的分压随时间的变化
B.用H2的浓度变化表示0-t1时间内的反应速率(用含t1的代数式表示)
C.t2时将容器体积迅速缩小至原来的一半并保持不变,N2分压变化趋势的曲线是b
D.在此温度下该反应的化学平衡常数
9.N2是合成氨工业的重要原料,NH3不仅可制造化肥,还能通过催化氧化生产HNO3;HNO3能溶解Cu、Ag等金属,也能与许多有机化合物发生反应;在高温或放电条件下,N2与O2反应生成NO,NO进一步氧化生成NO2。2NO(g)+O2(g)=2NO2(g) ΔH=-116.4kJ·mol-1。大气中过量的NOx和水体中过量的NH、NO均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2,也可将水体中的NO转化为N2。对于反应2NO(g)+O2(g)
2NO2(g),下列说法正确的是
A.该反应的ΔH<0,ΔS<0
B.反应的平衡常数可表示为K=
C.使用高效催化剂能降低反应的焓变
D.其他条件相同,增大,NO的转化率下降
10.CO2催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生下列反应:
反应①:CO2(g)+3H2(g)= CH3OH(g)+H2O(g);ΔH= - 49.5 kJ·mol-1
反应②:CO2(g)+H2(g)=CO(g)+H2O(g);ΔH=41.2 kJ·mol-1
在0.5 MPa条件下,将n(CO2)∶n(H2)为1∶3的混合气体以一定流速通过装有催化剂的反应器,实验测得CO2的转化率、CH3OH的选择性[×100%]与温度的关系如图所示。下列有关说法正确的是
A.反应②继续加氢生成甲醇的热化学方程式可表示为CO(g)+2H2(g)=CH3OH(g);ΔH=-90.7 kJ·mol -1
B.其他条件不变,增大起始n(CO2)∶n(H2)的比值,可提高CO2的平衡转化率
C.其他条件不变,在280~400°C间,产物中n(CH3OH)随温度的升高先增大后减小
D.为高效生产CH3OH,需研发低温下CO2转化率高和CH3OH选择性高的催化剂
11.三个体积均为0.5 L的恒容密闭容器中分别发生反应:CO(g)+Cl2(g)COCl2(g),容器①5min时到达平衡。
容器编号
温度/℃
起始物质的量/ mol
平衡物质的量/ mol
CO
Cl2
COCl2
COCl2
①
500
1.0
1.0
0
0.8
②
500
1.0
a
0
0.5
③
600
0.5
0.5
0.5
0.7
下列说法正确的是
A.该反应正反应方向为吸热反应
B.容器①中前5min的平均反应速率v(Cl2)=0.16 mol·L-1·min-1
C.a=0.55
D.若起始时向容器①加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率大于80%
12.在容积一定的密闭容器中,充入一定量的NO和足量碳发生化学反应C(s)+2NO(g)CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是
A.增加碳的量,平衡正向移动
B.在T2时,若反应处于状态D,则此时v正>v逆
C.若状态B、C、D的压强分别为pB、pC、pD,则有pC=pD>pB
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
13.在体积均为1.0L的恒容密闭容器甲、乙中,起始投料量如表,在不同温度下发生反应:CO2(g)+C(s)2CO(g)。CO的平衡浓度随温度的变化如图所示。下列说法正确的是
容器
n(CO2)/mol
n(C)/mol
n(CO)/mol
甲
0.1
0.3
0
乙
0
0
0.4
A.曲线Ⅰ对应的是甲容器
B.a、b两点所处状态的压强大小关系:9pa>14pb
C.c点:CO的体积分数>
D.900K时,若起始向容器乙中加入CO、CO2、C各1mol,则v(正)>v(逆)
14.已知:,速率方程为,其中k为反应速率常数且只与温度有关,该反应平衡常数与温度的关系为(式中R、C为常数,且R>0;T为温度,单位为K)。下列说法正确的是
A.恒温恒容条件下再充入CO,c(CO)增大,增大
B.向一容积不变的容器中充入一定量的CO(g)和(g),一定温度下发生反应,压强不再变化时,该反应达到平衡
C.恒温恒压条件下充入He,有利于提高的平衡转化率
D.降低温度,有利于提高平衡转化率
15.二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
I.CO(g)+2H2(g)CH3OH(g)
II.2CH3OH(g)CH3OCH3(g)+H2O(g)
500 K时,在2 L恒容密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则下列说法不正确的是
A.0~4 min,反应I的v(H2)=0.8 mol·L-1·min-1
B.反应II中CH3OH的转化率为80%
C.反应I的平衡常数K=4
D.容器总压强保持不变,可证明反应体系到达平衡状态
16.甲烷-甲醇-碘甲烷热化学循环如图(图中各物质均为气态)所示。下列说法错误的是
A.反应①的
B.①②③均发生氧化还原反应
C.反应③在高温下能自发进行,则其∆H<0,∆S<0
D.上述热化学循环实现了水的分解
17.一定条件下,将三组CO(g)和H2O(g)分别通入体积均为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)CO2(g)+H2(g),得到如下数据:
实验组
温度/°C
起始时/mol
平衡时/mol
达到平衡所需时间/min
CO
H2O
CO2
1
650
4
2
1.6
5
2
900
2
1
0.4
3
3
?
2
1
0.4
0.1
下列说法错误的是
A.实验1中,前5minCO的平均速率为0.16mol·L-1·min-1
B.与实验2相比,实验3改变的条件可能是温度
C.平衡常数:实验1>实验2
D.CO平衡转化率:实验1>实验2
18.在一定的温度和压强下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。已知:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-165kJ·mol-1;
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41kJ·mol-1,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测CO2转化率和生成CH4选择性随温度变化的影响如图所示。
已知:CH4选择性=×100%
下列有关说法正确的是
A.在260℃~320℃间,以Ni-CeO2为催化剂,升高温度CH4的产率不变
B.延长W点的反应时间,一定能提高CO2的转化率
C.选择合适的催化剂,有利于提高CO2的转化率
D.高于320℃后,以Ni为催化剂,随温度的升高CO2转化率上升的原因是平衡正向移动
19.已知反应:2X(1)Y(1),取等量X,分别在0℃和20℃下,测得其转化率随时间变化的关系曲线(α-t)如图所示。下列说法正确的是
A.曲线Ⅰ代表0℃下X的α-t曲线
B.反应进行到66min时,Y的物质的量为0.113mol
C.该反应ΔH>0
D.加入催化剂,X的平衡转化率升高
20.下列关于平衡说法正确的是
A.3CH4(g)+2N2(g)⇌3C(s)+4NH3(g),反应达到平衡时3v(CH4)=4v(NH3)
B.反应2NO2(g)⇌N2O4(g) ΔH<0,改变A点的温度、压强,使其变为B点或C点,由图可知,体系颜色A点比B、C点更深
C.恒温恒压条件下,N2(g)+3H2(g)2NH3(g),平衡时各物质的量均为1mol,再充入3molN2,平衡正向移动
D.恒温恒容条件下,CaO(s)+CO2(g)⇌CaCO3(s),容器中含足量CaO和CaCO3固体,平衡后再充入CO2,达到新平衡时,容器内的压强不变
二、非选择题(共2小题)
21.工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。请回答:
(1)在C和O2的反应体系中:
反应1:C(s)+O2(g)=CO2(g) ΔH1=-394kJ·mol-1
反应2:2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
反应3:2C(s)+O2(g)=2CO(g) ΔH3。
①设y=ΔH-TΔS,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是______。
②一定压强下,随着温度的升高,气体中CO与CO2的物质的量之比______。
A.不变 B.增大 C.减小 D.无法判断
(2)水煤气反应:C(s)+H2O(g)=CO(g)+H2(g) ΔH=131kJ·mol-1。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是________。
(3)一氧化碳变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1。
①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、p(H2O)=0.25MPa、p(CO2)=0.75MPa和p(H2)=0.75MPa,则反应的平衡常数K的数值为________。
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为________。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是________。
A.反应温度愈高愈好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量-反应过程如图2所示。
用两个化学方程式表示该催化反应历程(反应机理):步骤Ⅰ:________;步骤Ⅱ:________。
22.做好碳达峰、碳中和工作,是中央经济工作会议确定的2021年八项重点任务之一,CO2的资源化可以推动经济高质量发展和生态环境质量的持续改善。
(1)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:
反应2:
反应3:
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。则ΔH2________ΔH3(填“大于”、“小于”或“等于”)。
(2)①对于上述CO2加氢合成CH3OH的体系,下列说法错误的是___(填标号)。
A.增大H2浓度有利于提高CO2的转化率
B.当气体的平均相对分子质量保持不变时,说明反应体系已达平衡
C.体系达平衡后,若压缩体积,则反应1平衡不移动,反应3平衡正向移动
D.选用合适的催化剂可以提高CH3OH在单位时间内的产量
②已知对于反应:,其标准平衡常数:,某温度为T,压强为的恒压密闭容器中,通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol(b>a),此时H2O(g)的分压p(H2O)=_______(用含a、b的代数式表示,下同),反应1的标准平衡常数为___________。
(3)电催化还原能将CO2转化为多种碳产物。在铜电极上将CO2还原为CO的机理如图所示:
写出该机理过程总的电极方程式:___________。
(4)利用CO2为原料可以合成苯乙烯,涉及以下反应:
I.
II.
结合数据说明乙苯制苯乙烯过程中加氧气的理由___________。
答案与解析
1.【答案】D
【解析】A.根据第2组c0(N2O5)是第1组c0(N2O5)的0.4倍,第2组速率也是第1组速率的0.4倍,故=k·c(N2O5),A正确;B.将第一组数据代入v=k·c0(N2O5),可得k=6.2×10-4min-1,B正确;C.将k=7.44×10-5和k=6.2×10-4min-1代入=k·c0(N2O5),可得a=0.12,C正确;D.由于浓度改变化学反应速率也改变,且反应速率为平均反应速率,故浓度由0.16mol·L-1减小到amol·L-1,根据目前所学的知识,无法计算出所用的时间,D错误;故答案为D。
2.【答案】B
【解析】由题干信息可知,平衡时测得A的浓度为,保持温度不变,将容器的容积扩大到原来的二倍,再达平衡时,测得A的浓度为,说明减小压强,平衡逆向移动。A.由分析可知,减小压强,平衡逆向移动,故逆反应为气体体积增大的方向,即,A错误;B.由分析可知,平衡向逆反应方向移动,B正确;C.由分析可知,平衡逆向移动,故B的转化率减小,C错误;D.由分析可知,平衡逆向移动,故C的体积分数增大,D错误;故答案为B。
3.【答案】D
【解析】A.根据反应图示可知,在相同的催化剂作用下,化学反应存在一种反应途径,A错误;B.升高温度,stepwise路径和concerted路径的反应速率都加快,不改变其它,平衡不改变,转化率不变,B错误;C.由于ΔEa<ΔEa1,活化能越大,反应速率越慢,DME水解反应更易以concerted路径进行,C错误,D.根据图示信息可知,DME首先与分子筛H+ A-结合形成(CH3)2OH+ A-,D正确;故选D。
4.【答案】D
【解析】A.该反应的熵减小,故不一定在任何条件均能自发,选项A错误;B.当通入无穷大的O2时,参与反应的O2较少,生成的SO3略有增多,但是由于没有反应的O2的量更多,则SO3的体积分数反而减小,选项B错误;C.催化剂不可以改变SO2的平衡转化率,选项C错误;D.反应的ΔH=∑[2mol SO2(g)+1mol O2(g)]-∑[2mol SO3(g)]=-196.6 kJ·mol-1<0,则有∑[2mol SO2(g)+1mol O2(g)]<∑[2mol SO3(g)],选项D正确。答案选D。
5.【答案】D
【解析】A.反应C(s)+CO2(g)2CO(g)的正反应是吸热反应,所以ΔH>0,A错误;B.根据图象可知在温度为650℃时CO2的含量是60%,假设开始时CO2的物质的量是1 mol,反应的CO2的物质的量为x mol,反应产生CO的物质的量是2x,则平衡时CO2的物质的量为(1-x) mol,,解得x=0.25 mol,所以CO2的平衡转化率为,B错误;C.在温度为t1时CO、CO2的含量相同,P(CO)=P(CO2)=0.5p kPa,该温度下的化学平衡常数Kp=。t1℃时达平衡后若再充入等物质的量的CO和CO2气体,仍然存在P(CO2)=P(CO),则Qc=Kp,因此化学平衡不移动,C错误;D.该反应在恒压密闭容器中进行,当混合气体密度不再变化时,气体的质量及气体的物质的量不再发生变化,反应达到了平衡状态,D正确;故选D。
6.【答案】C
【解析】A.由题干图示可知,压强相同时,温度升高,CO2的转化率增大,说明升高温度平衡正向移动,故该反应的,A错误;B.由题干图示可知,温度相同时,p2压强下CO2的转化率更大,结合反应方程式可知,增大压强,化学平衡逆向移动,CO2的转化率减小,故压强:,B错误;C.1100℃时,根据三段式分析可知,,该反应的平衡常数为K===12.96,C正确;D.反应达到平衡后在容器内再充入和,相当于对容器增大压强,化学平衡逆向移动,故此时CO2的转化率会减小,D错误;故答案为C。
7.【答案】A
【解析】A.及时移除反应体系中的Mg(l),平衡不移动,MgCl2(l)的转化率不变,A项错误;B.该反应的平衡常数表达式为K=c(Cl2),恒压装置中,若减小装置体积为原来的一半,温度不变,K不变,则Cl2(g)的浓度不变,B项正确;C.恒容装置中,Cl2(g)浓度不变,说明氯气的物质的量不变,反应达到平衡状态,C项正确;D.该反应为分解反应,是吸热反应,升高温度,平衡正向移动,故温度升高可以增大MgCl2(l)的转化率,D项正确;答案选A。
8.【答案】B
【解析】A.将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),随着反应的进行,NH3不断分解变为N2、H2,所以NH3的分压逐渐减小,H2、N2的分压逐渐增大。根据图示可知I表示物质的分压逐渐减小,II、III分压逐渐增大,且II分压增大的多于III,所以故曲线I表示NH3的分压随时间的变化,II、III分别表示H2、N2的分压随时间的变化,A正确;B.密闭容器中0.1 mol NH3总压为200 kPa,则如图t1时H2的分压为120 kPa,则H2的物质的量为n(H2)==0.06 mol,v(H2)=,B错误;C.容器体积迅速缩小到原来的一半,则氮气的分压迅速增大到原来的2倍,压强增大,平衡向气体总体积减小的方向移动,即平衡逆向移动,N2的分压应比原来2倍小,N2分压变化趋势的曲线是b,C正确;D.在该温度下,达到平衡时,p(N2)=40 kPa,p(H2)=120 kPa,p(NH3)=120 kPa,则化学平衡常数Kp=
,D正确;故选B。
9.【答案】A
【解析】A.2NO(g)+O2(g)=2NO2(g) ΔH=-116.4kJ·mol-1,反应气体物质的量减少,ΔS<0,故A正确;B.2NO(g)+O2(g)2NO2(g)反应的平衡常数可表示为K=,故B错误;C.使用高效催化剂,反应的焓变不变,故C错误;D.其他条件相同,增大,NO的转化率增大,故D错误;选A。
10.【答案】B
【解析】A.根据盖斯定律可知反应①-反应②即得到一氧化碳加氢生成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g) ΔH=-90.7kJ·mol-1,A正确;B.其他条件不变,增大起始n(CO2)∶n(H2)的比值,可提高H2的平衡转化率,但CO2的平衡转化率降低,B错误;C.假设参加反应的二氧化碳是1mol,根据图像可知280℃生成甲醇是0.94×0.03mol=0.0282mol,同理320℃生成甲醇是0.92×0.1mol=0.092mol,360℃生成甲醇是0.15×0.48mol=0.072mol,400℃生成甲醇是0.04×0.17mol=0.0068mol,即其他条件不变,在280~400℃间,产物中n(CH3OH)随温度的升高先增大后减小,C正确;D.根据图像以及结合反应①是放热反应,反应②是吸热反应可知为高效生产CH3OH,需研发低温下CO2转化率高和CH3OH选择性高的催化剂,D正确;答案选B。
11.【答案】C
【解析】A.①、③是等效平衡,升高温度∆n(COCl2)减小,说明升高温度平衡逆向移动,正反应为放热反应,A说法错误;B.①中平衡时得到∆n(COCl2)=0.8mol,根据方程式知,参加反应的∆n(CO)=∆n(COCl2)=0.8mol,则5min内v(CO)=0.8mol÷0.5L÷5min=0.32mol/(L∙min),B说法错误;C.容器①中,平衡时,CO、Cl2、COCl2的浓度分别为0.4mol/L、1.6mol/L,则反应①中,K=1.6÷(0.4×0.4)=10,相同下化学平衡常数相等,根据化学平衡常数计算氯气初始物质的量,
K=1÷(1×)=10,解得a=0.55mol,C说法正确;D.①中加入1.0mol CO、1.0mol Cl2时,CO转化率=×100%=80%,如果起始时向容器①加入CO 0.8 mol、Cl2 0.8 mol,容器内压强小于加入1.0mol CO、1.0mol Cl2时压强,减小压强平衡向气体体积增大的方向移动,即逆反应方向移动,CO转化率小于80%,D说法错误;答案为C。
12.【答案】B
【解析】A.C为固体,增加其用量对平衡无影响,A错误;B.在T2℃时,若反应体系处于状态D,此时c(NO)高于平衡时NO浓度,故平衡正向移动,因此υ正>υ逆,B正确;C.该反应是等体积反应,B、D温度相同,物质的量相同,因此PD=PB,C、D物质的量相等,温度C大于D点,因此压强PC>PD,C错误;D.由图示知,升高温度,c(NO)浓度增大,说明平衡逆向移动,故平衡常数减小,因此K2<K1,D错误;故答案选B。
13.【答案】C
【解析】A.固体物质不应平衡移动,乙投入0.4mol一氧化碳相当于投入0.2mol二氧化碳,所以乙相当于两个甲容器加压,无论平衡如何移动,乙中一氧化碳浓度一定大于甲,故图中曲线Ⅰ对应的是乙容器,A错误;B.甲容器b处乙容器a处,若a、b两点所处温度相同,压强比等于物质的量之比,pa∶pb=(0.12+0.16)∶(0.02+0.16)=14∶9,即9pa=14pb,由于b点温度更高,故a、b两点所处状态的压强大小关系:9pa<14pb,B错误;C.a点一氧化碳体积分数为;c点相当于减压,平衡正向移动,一氧化碳体积分数变大,故CO的体积分数>,C正确;D.a点1100K时的K=,降温则一氧化碳浓度减小,K值减小,900K时K值小于0.213;若起始向容器乙中加入CO、CO2、C各1mol,则Q=,平衡逆向移动,v(正)
【解析】A.恒温恒容条件下再充入CO,c(CO)增大,但由于NO2的浓度不变, ,故不变,A错误;B.向一容积不变的容器中充入一定量的CO(g)和(g),一定温度下发生反应,由于反应前后体积的物质的量保持不变,即容器的压强始终保持不变,故压强不再变化时,不能说明该反应达到平衡,B错误;C.恒温恒压条件下充入He,相当于反应体系的压强减小,减小压强对于上述平衡不移动,NO2的平衡转化率不变,C错误;D.由该反应平衡常数与温度的关系为(式中R、C为常数,且R>0;T为温度,单位为K)可知,温度越低,平衡常数K越大,故降低温度,平衡正向移动,有利于提高平衡转化率,D正确;故答案为D。
15.【答案】C
【解析】A.500 K时,在2 L恒容密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,Δn(CO)=4 mol×80%=3.2 mol,则根据物质反应转化关系可知Δn(H2)=2Δn(CO)=6.4 mol,故0~4 min,反应I的v(H2)=,A正确;B.反应I发生后有发生反应II:假设反应产生CH3OCH3(g)的物质的量为x,则反应消耗CH3OH(g)的物质的量为2x,根据选项A分析可知平衡时反应产生CH3OH(g)的物质的量为3.2 mol,则反应II达到平衡后n(CH3OH)=(3.2-2x)mol,n(CH3OCH3)=x,由于2c(CH3OH)
=c(CH3OCH3),气体处于同一容器中,则2×(3.2-2x)=x,解得x=1.28 mol,所以反应II中CH3OH的转化率为=80%,B正确;C.对于反应I:CO(g)+2H2(g)CH3OH(g),反应开始时,n(CO)=4 mol,n(H2)=8 mol,n(CH3OH)=0 mol/L。4 min时反应达到平衡,CO的转化率为80%,Δn(CO)=4 mol×80%=3.2 mol,根据物质反应转化关系可知:Δn(H2)=2Δn(CO)=6.4 mol,Δn(CH3OH)=3.2 mol,进而发生反应II:2CH3OH(g)CH3OCH3(g)+H2O(g),假设反应产生CH3OCH3的物质的量为x,反应消耗CH3OH的物质的量为2x,由于2c(CH3OH)=c(CH3OCH3),则2×(3.2-2x)=x,解得x=1.28 mol,可知平衡时n(CH3OH)=3.2 mol-2×1.28 mol=0.64 mol,n(H2)=8 mol-6.4 mol=1.6 mol,n(CO)=4 mol-3.2 mol=0.8 mol,反应容器的容积是2 L,则c(CO)=0.4 mol/L,c(H2)=0.8 mol/L,c(CH3OH)=0.32 mol/L则反应I的化学平衡常数K,C错误;D.反应在恒温、恒容密闭容器中进行,反应I是反应前后气体物质的量减小的反应,反应II反应前后气体的物质的量不变,若容器总压强保持不变,则气体的总物质的量不变,反应达到平衡状态,因此可证明反应体系已经到达平衡状态,D正确;故选C。
16.【答案】C
【解析】A.根据流程中反应可知,反应①,选项A正确;B.由循环图可知,①②③均有化合价变化,发生氧化还原反应,选项B正确;C.反应③的ΔS>0,选项C错误;D.由反应①②
③
④,四式相加得,故为水的分解,选项D正确;答案选C。
17.【答案】B
【解析】A.实验1中,参加反应的一氧化碳的物质的量为1.6mol,前5min用一氧化碳表示的速率为1.6mol2L5min=0.16mol·L-1·min-1,A正确;B.实验3和实验2相比,起始量、平衡量均相等,但达到平衡所用的时间实验3短,说明实验3的反应速率快,因此改变的条件为使用了催化剂,B错误;C.实验1列三段式:,平衡常数,CO转化率:,实验2列三段式,平衡常数,CO转化率:平衡常数:实验1>实验2,C正确;D.由C选项可知,CO平衡转化率:实验1>实验2,D正确;答案选B。
18.【答案】C
【解析】A.在260℃~320℃间,升高温度CH4的选择性基本不变,但CO2的转化率在上升,所以CH4的产率上升,选项A错误;B.W点可能是平衡点,延长时间不一定能提高CO2的转化率,选项B错误;C.由图可知,使用不同的催化剂,CO2的转化率不同,选项C正确;D.图示对应的时间内以Ni为催化剂,明显低于相同温度下Ni-CeO2为催化剂的转化率,一定未达平衡,高于320℃后,随温度的升高CO2转化率上升的原因是催化剂活性增大,反应速率加快,选项D错误。答案选C。
19.【答案】A
【解析】A.据图可知,平衡前反应相同时间,曲线Ⅰ所示条件下转化率更小,即反应速率更慢,温度越低反应速率越小,所以曲线Ⅰ代表0℃下X的α-t曲线,A正确;B.据图可知反应进行到66min时,X的转化率为0.113,但初始投料未知,所以无法计算此时Y的物质的量,B错误;C.曲线Ⅱ所示温度更高,但平衡时X的转化率低,说明升高温度平衡逆向移动,正反应为放热反应,ΔH<0,C错误;D.催化剂可以加快反应速率,但不能改变平衡转化率,D错误;故答案为A。
20.【答案】D
【解析】A.系数错误且没有标注反应的正逆方向,应该是4v正(CH4)=3v逆(NH3),故A错误;B.由于A到C是加压,NO2与N2O4浓度均变大,平衡右移,但新平衡时NO2的浓度依旧大于原平衡时浓度,因此颜色C>A;A到B体系降温,平衡右移,NO2浓度下降,反应速率也下降,颜色A>B,故B错误;C.假设总压为P总,由于温度不变,Kp不变,原本的Kp=9/(P总2),充入3molN2后,此时的Q=9/(P总2),Q=Kp,平衡不移动,故C错误;D.由于温度不变,压强平衡常数Kp不变,而Kp=p(CO2),因此平衡时CO2 的压强不变,故D正确;答案选D。
21.【答案】(1)a B
(2)水蒸气与煤炭反应吸热,氧气与煤炭反应放热,交替通入空气和水蒸气有利于维持体系热量平衡,保持较高温度,有利于加快化学反应速率
(3)9.0 1.8∶1 BC M+H2O=MO+H2 MO+CO=M+CO2
【解析】(1)①由已知方程式:(2×反应1-反应2)可得反应3,结合盖斯定律得:,反应1前后气体分子数不变,升温y不变,对应线条b,升温促进反应2平衡逆向移动,气体分子数增多,熵增,y值增大,对应线条c,升温促进反应3平衡逆向移动,气体分子数减少,熵减,y值减小,对应线条a,故此处填a;②温度升高,三个反应平衡均逆向移动,由于反应2焓变绝对值更大,故温度对其平衡移动影响程度大,故CO2物质的量减小,CO物质的量增大,所以CO与CO2物质的量比值增大,故答案选B;
(2)由于水蒸气与煤炭反应吸热,会引起体系温度的下降,从而导致反应速率变慢,不利于反应的进行,通入空气,利用煤炭与O2反应放热从而维持体系温度平衡,维持反应速率,故此处填:水蒸气与煤炭反应吸热,氧气与煤炭反应放热,交替通入空气和水蒸气有利于维持体系热量平衡,保持较高温度,有利于加快反应速率;
(3)①该反应平衡常数K=;②假设原料气中水蒸气为x mol,CO为1 mol,由题意列三段式如下:,则平衡常数K=,解得x=1.8,故水蒸气与CO物质的量之比为1.8∶1;③A.反应温度过高,会引起催化剂失活,导致反应速率变慢,A不符合题意;B.适当增大压强,可加快反应速率,B符合题意;C.选择合适的催化剂有利于加快反应速率,C符合题意;D.若为恒容条件,通入氮气对反应速率无影响,若为恒压条件,通入氮气后,容器体积变大,反应物浓度减小,反应速率变慢,D不符合题意;故答案选BC;④水分子首先被催化剂吸附,根据元素守恒推测第一步产生H2,第二步吸附CO产生CO2,对应反应历程依次为:M+H2O=MO+H2、MO+CO=M+CO2。
22.【答案】(1)小于
(2)C
(3)
(4)I+II可得,,反应II使反应I得以实现;,反应II为反应I提供热量
【解析】(1)根据图示可知:反应II、III的化学平衡常数随温度的升高而减小,说明升高温度,平衡逆向移动,正反应为放热反应,所以ΔH2<0,ΔH3<0,且K3受温度影响变化更大,说明反应III的反应热更大,所以ΔH2<ΔH3。
(2)①A.增大H2浓度,化学平衡正向移动,因此有利于提高CO2的转化率,A正确;B.在上述三个反应中,反应1是反应前后气体物质的量不变的反应,反应2、3都是气体体积减小的反应,反应混合物都是气体,当气体的平均相对分子质量保持不变时,气体的物质的量不变,说明反应体系已达平衡,B正确;C.压强增大,化学平衡向气体体积小的方向移动,所以体系达平衡后,若压缩体积,则压强增大,反应3平衡正向移动,使CO2浓度减小、H2O浓度增大,反应1平衡逆向移动,C错误;D.选用合适的催化剂可以加快化学反应速率,提高CH3OH在单位时间内的产量,D正确;故合理选项是C;②在密闭容器中发生反应:反应1:反应2:,某温度为T,压强为的恒压密闭容器中,通入1 mol CO2和3 mol H2发生上述反应,反应开始时气体总物质的量为n(始)=1 mol+3 mol=4 mol,反应达到平衡时,容器中CH3OH(g)为a mol,CO为b mol(b>a),根据反应2:反应产生CH3OH(g)为a mol,消耗H2物质的量为2a mol,消耗CO物质的量为a mol,此时容器中还有CO为b mol,则反应1产生CO、H2O的物质的量都是(a+b) mol,消耗CO2、H2的物质的量都是(a+b) mol,由于反应1是反应前后气体体积不变的反应,反应2是气体体积减小的反应。每反应产生1 mol CH3OH,反应后气体的总物质的量会减小2 mol,现在反应产生a mol CH3OH,反应后气体物质的量减小2a mol,则平衡时气体总物质的量n(平)=(4-2a) mol,此时H2O(g)的分压P(H2O)=;③反应1,达到平衡时各种气体的物质的量分别为:n(CO2)=(1-a-b)mol,n(H2)=(3-3a-b)mol,n(CO)=b mol,n(H2O)=(a+b)mol,则各气体的分压为P(CO2)=×,P(H2)= ×,P(CO)=×,n(H2O)=×,反应1的标准平衡常数=。
(3)根据图示可知:该机理过程总的来说是CO2得到电子,与H+结合形成CO、H2O,故总的电极方程式为:。
(4)反应I是吸热反应,使物质环境温度降低,而反应II是放热反应,放出热量,是周围环境温度升高。根据盖斯定律,将反应I与反应II相加,整理可得,,反应II发生放出热量,使反应I得以实现;,反应II为反应I提供热量,因此在由乙苯制取苯乙烯时需要加入一定量的氧气。
2023届高三化学二轮专题训练-化学反应速率与化学平衡: 这是一份2023届高三化学二轮专题训练-化学反应速率与化学平衡,共24页。试卷主要包含了单选题,原理综合题等内容,欢迎下载使用。
高中化学 2021届高考二轮精品专题六 化学反应速率与化学平衡 学生版: 这是一份高中化学 2021届高考二轮精品专题六 化学反应速率与化学平衡 学生版,共27页。
高考化学二轮复习专题13《化学反应速率化学平衡》练习卷(含详解): 这是一份高考化学二轮复习专题13《化学反应速率化学平衡》练习卷(含详解),共12页。












