
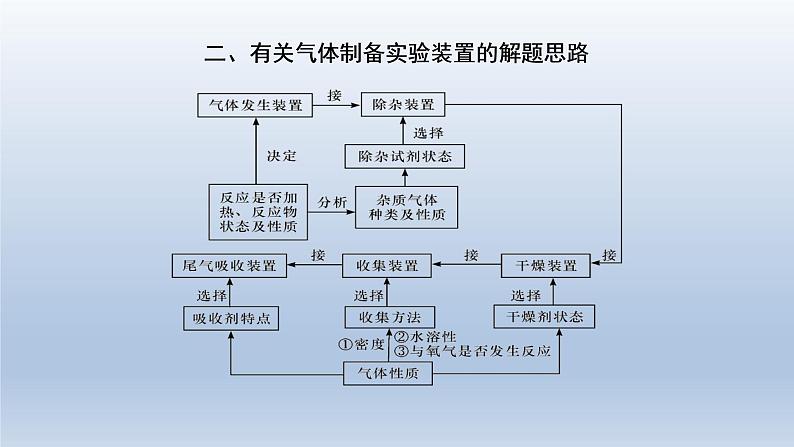
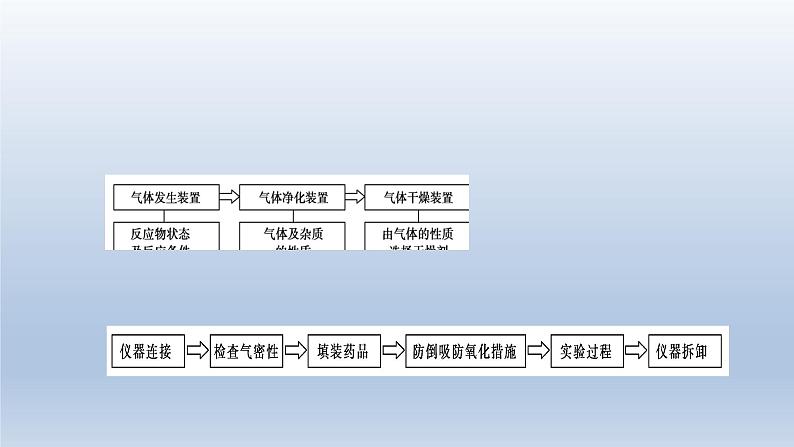

2022届高三化学高考备考一轮复习化学实验化学设计和评价课件
展开3.制备实验中涉及的几个重要问题
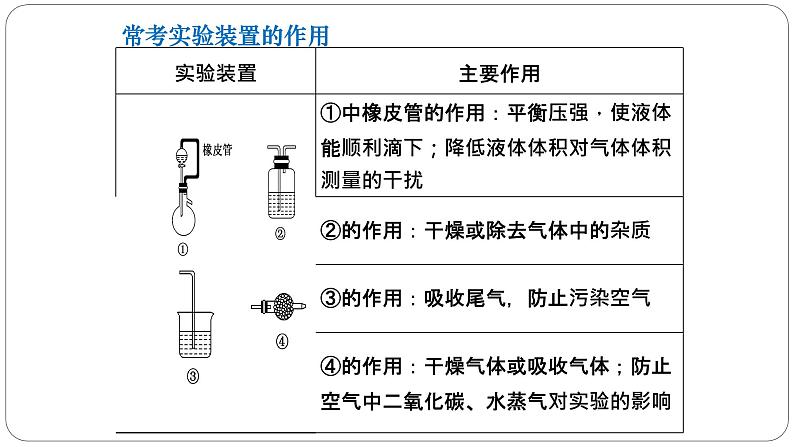
①加液顺序:如果两种液体混合放出大量的热,就需要将密度大的液体逐滴加入密度小的液体中。(浓硫酸稀释就是这样的。)②冷凝回流:如果反应物易挥发,在加热时,部分未反应的物质会产生挥发现象,所以需要冷凝回流装置。如果需要冷凝回流,就需要球型(蛇型)冷凝管。如果生成物需要冷凝,就需要直型冷凝管。冷凝回流装置中,一定是下口进水,上口出水。③平衡气压:如果需要方便液体加入,就需要使用有平衡气压导管的滴液漏斗。
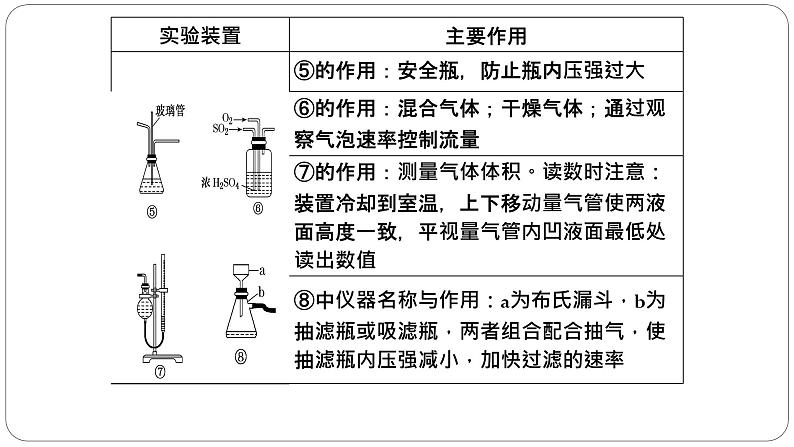
④保护装置:如果产物与空气反应或吸收空气中的成分,就需要在装置最后接干燥管(装合适试剂)加以保护。⑤惰性气体:如果空气中的成分会对实验产生影响,就需要在开始反应前通入惰性气体将导管中的空气全部排出。如果定量实验中需要将导管中的气体充分吸收,就需要在反应结束时通入惰性气体将导管中的气体全部排出。⑥实验安全:在加热时为了防止液体暴沸,通常加入沸石或碎瓷片防暴沸;如果产生容易堵塞导管的物质,就需要使用安全瓶。
⑦有机制备:由于反应过程中要长时间加热,且使用的仪器较多,所以要使用三颈烧瓶;由于有机化学反应通常要进行加热,并控制温度,通常要使用温度计。加热时,为了受热均匀,便于控温,通常采用水浴加热或油浴加热;若温度低于100℃,则用水浴;若温度高于100℃,则用油浴。⑧气体干燥:如果产生的气体或产物中有水,就需要干燥。如果产生的气体或产物需要使用固体干燥剂,就需要使用干燥管或U型管。 如果产生的气体或产物需要使用液体干燥剂,就需要使用洗气瓶。⑨尾气处理:如果产生的尾气有毒或有污染,就需要尾气吸收。如果气体易溶于水且通入溶液中,就需要防倒吸。
⑩转化率、产率和纯度计算: a.转化率:转化率=(实际参加反应的反应物的量÷反应物的总量)×100%b.产率:实际产量与理论产量的比值,即可得出产率。产率=(实际产量÷理论产量)×100%c.纯度:纯度=(某种成分的质量÷样品总量)×100%
说明:计算时,应注意代入原始数据,并注意单位和有效数字。
考向三 实验装置与实验目的的相关判定
1.常见装置(1)常见的气体发生装置
98.3% 浓硫酸
用两层催化剂用热交换器
用98.3%的浓硫酸吸收SO3
-----------
注意:取药品 药品的用量 过程中的现象
使硫粉易于分散到溶液中
取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4
S2O32-+2H+ = S+SO2+H2O
全面 空间顺序 时间顺序 固液气三态
蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液。
试管内气体的黄绿色变浅
浅层次 操作带来的直接结果深层次 为什么要这样操作
8.(2011·全国大纲卷· 29节选) 请回答下列实验中制取气体的有关问题。 (1)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。
装置B、C、D的作用分别是:B_____________________;C_____________________;D_____________________
安全作用,防止D中的液体倒吸进入集气管B中
吸收尾气,防止氯气扩散到空气中污染环境
2NaHSO3=Na2S2O5+H2O
增大NaHSO3浓度,形成过饱和溶液
c中产生的氢气使压强大于大气压;
敞开体系,可能使醋酸亚铬与空气接触
考查要点:审题能力 信息迁移应用能力
气体制取时自带的杂质或空气、溶液中的成分对实验有影响
用导管将A的上口和B相连(或将A换成恒压滴液漏斗);在G和H之间增加干燥装置
饱和食盐水 浓硫酸
控制浓盐酸的滴速不要过快
常见仪器及基本操作1.使用化学仪器时的注意事项(1)应注意仪器的精确度,如滴定管的精确度为0.01 mL,量筒的精确度为0.1 mL,托盘天平的精确度为0.1 g。
(3)使用前需要检漏的仪器:分液漏斗、滴定管、容量瓶。(4)注意仪器的特定用途,如滴定管、量筒可以用来量取液体,绝对不能用于溶解、配制溶液或作反应容器。(5)注意仪器的多种用途,如在用量筒量取一定体积的液体和配制一定物质的量浓度的溶液时均用到了胶头滴管;过滤、蒸发、配制一定物质的量浓度的溶液时均用到了玻璃棒。
(6)应变换思维角度,注意常用仪器的非常规使用及“一材多用”。例如:干燥管除用于干燥气体外,还可以用于组装防倒吸装置(如图①)、组装类似启普发生器装置(如图②);集气瓶除用于收集气体外,还可用于贮存气体(如图③)、测量气体体积(如图④)、作洗气瓶(如图⑤)等用途,图⑥既可以收集密度比空气大的气体(“长进短出”),也可以收集密度比空气小的气体(“短进长出”),还可以作为安全瓶(“短进长出”)等。
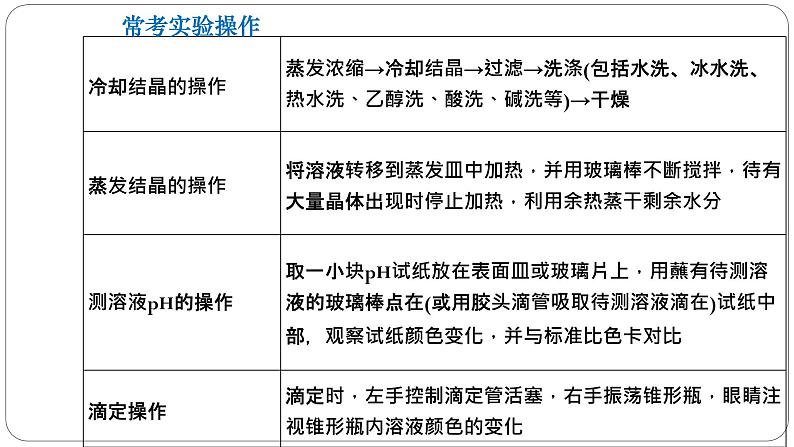
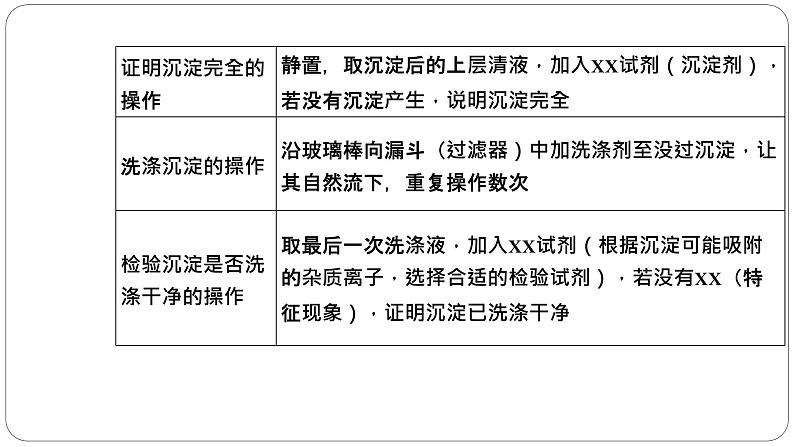
2.熟记十大基本操作(1)测定溶液pH的操作。将一小块pH试纸放在洁净的表面皿上,用清洁干燥的玻璃棒蘸取少量待测液点到pH试纸中央,把试纸显示的颜色与标准比色卡对照,读出对应的pH。(2)沉淀剂是否过量的判断方法。①静置,向上层清液中继续滴加少量沉淀剂,若无沉淀产生,则证明沉淀剂已过量,否则沉淀剂不过量。②静置,取上层清液适量放入另一支洁净试管中,向其中加入少量与沉淀剂作用产生沉淀的试剂,若产生沉淀,证明沉淀剂已过量,否则沉淀剂不过量。
(3)洗涤沉淀操作。把蒸馏水沿着玻璃棒注入过滤器中至浸没沉淀,静置,使蒸馏水自然流出,重复2~3次即可。(4)判断沉淀是否洗净的操作。取最后一次洗涤液,滴加……(试剂),若没有……现象,证明沉淀已经洗净。
(5)检查装置气密性。①简易装置:将导气管一端放入水中(液封气体),用手焐热试管,观察现象。若导气管口有气泡冒出,冷却到室温后,导气管口有一段稳定的水柱,表明装置气密性良好。②有长颈漏斗的装置如图:用止水夹夹紧烧瓶右侧导气管上的橡胶管,向长颈漏斗中加入适量水,长颈漏斗中会形成一段液柱,停止加水,过一段时间后,若长颈漏斗中的液柱无变化,则装置气密性良好。
[答题模板]形成密闭体系→操作→描述现象→得出结论。
(6)气体验满和验纯操作。①氧气验满:将带火星的木条平放在集气瓶口,若木条复燃,则表明气体已集满。②可燃性气体(如氢气)的验纯方法:用排水法收集一小试管的气体,用大拇指摁住管口移近火焰,放开手指,若听到尖锐的爆鸣声,则气体不纯;若听到轻微的“噗”的一声,则气体纯净。③二氧化碳验满:将燃着的木条平放在集气瓶口,若木条熄灭,则表明气体已集满。④氨气验满:将湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,则表明气体已集满。⑤氯气验满:将湿润的淀粉-碘化钾试纸放在集气瓶口,若试纸变蓝,则表明气体已集满。
(7)萃取分液操作。关闭分液漏斗活塞,将混合液倒入分液漏斗中,塞上塞子,用右手心顶住塞子,左手握住活塞部分,将分液漏斗倒置,充分振荡、静置、分层,在漏斗下面放一个小烧杯,先打开上口塞子,再打开分液漏斗活塞,使下层液体从下口沿烧杯内壁流下,上层液体从上口倒出。(8)浓硫酸的稀释操作。将浓硫酸沿烧杯壁缓缓注入水中,并用玻璃棒不断搅拌。(9)粗盐的提纯。①实验室提纯粗盐的实验操作依次为取样、溶解、沉淀、过滤、蒸发结晶。②若过滤时发现滤液中有少量浑浊,从实验操作的角度分析,可能的原因是过滤时漏斗中液面高出滤纸边缘、玻璃棒靠在单层滤纸一侧弄破滤纸。
(10)从某物质稀溶液中结晶的实验操作。①溶解度受温度影响较小的:蒸发→结晶→过滤。②溶解度受温度影响较大或带结晶水的:蒸发浓缩→冷却结晶→过滤。
3.实验基本操作中的八个注意要点(1)酸式滴定管不能装碱性溶液,碱式滴定管不能装酸性和强氧化性溶液。(2)容量瓶不能长期存放溶液,更不能作为反应容器,也不可加热,瓶塞不可互用。(3)烧瓶、烧杯、锥形瓶不可直接加热。(4)药品不能入口和用手直接接触,实验剩余药品不能放回原处(K、Na等除外),不能随意丢弃,要放入指定容器中。(5)中和滴定实验中锥形瓶不能用待测液润洗。(6)不能用温度计代替玻璃棒来搅拌,测液体温度时不能与容器内壁接触。(7)用天平称量药品时,药品不能直接放在托盘上。
2024届高三化学高考备考一轮复习专题:物质制备实验的设计与评价课件: 这是一份2024届高三化学高考备考一轮复习专题:物质制备实验的设计与评价课件,共35页。
高考化学一轮复习考点备考课件专题九考点指导2化学实验方案的设计与评价 (含解析): 这是一份高考化学一轮复习考点备考课件专题九考点指导2化学实验方案的设计与评价 (含解析),共9页。PPT课件主要包含了典例剖析,CO2,CuO,方法指导,试题备选,含铝97%,剩余固体质量偏高,EDG,V1-V2,实验时的温度和压强等内容,欢迎下载使用。
2023届高三化学高考备考二轮复习 实验设计与评价课件: 这是一份2023届高三化学高考备考二轮复习 实验设计与评价课件












