

2022高考化学一轮复习专练27化学反应中的能量变化基本概念及图像含解析
展开专练27 化学反应中的能量变化基本概念及图像
一、单项选择题
1.[2021·湖北部分重点中学考试]一种生产和利用氢能的途径如图所示。下列说法错误的是( )
A.氢能属于二次能源
B.图中能量转化的方式至少有6种
C.太阳能电池的供电原理与燃料电池相同
D.太阳能、风能、氢能都属于新能源
2.中国学者在水煤气变换[CO(g)+H2O(g)===CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:
下列说法正确的是( )
A.过程Ⅰ、过程Ⅲ均为放热过程
B.过程Ⅲ生成了具有极性共价键的H2、CO2
C.使用催化剂降低了水煤气变换反应的ΔH
D.图示过程中的H2O均参与了反应过程
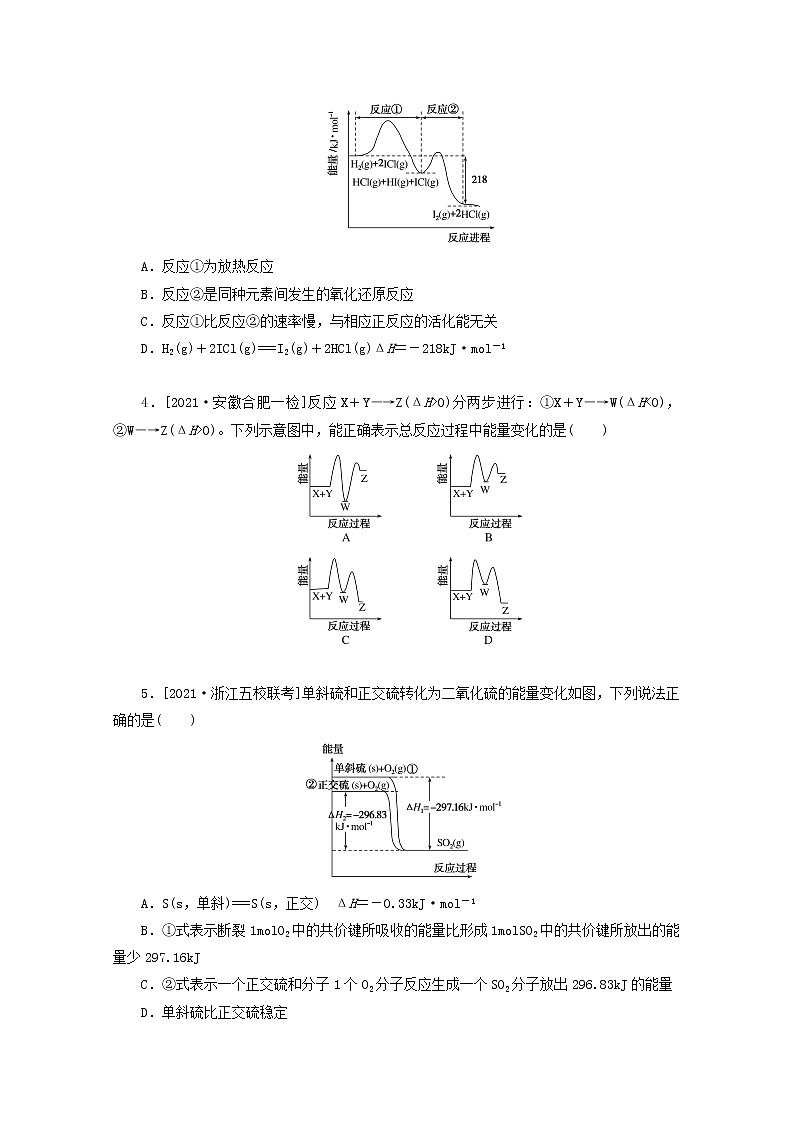
3.[2021·河南开封高三定位考试]已知H2(g)+2ICl(g)===I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是( )
A.反应①为放热反应
B.反应②是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能无关
D.H2(g)+2ICl(g)===I2(g)+2HCl(g)ΔH=-218kJ·mol-1
4.[2021·安徽合肥一检]反应X+Y―→Z(ΔH>0)分两步进行:①X+Y―→W(ΔH<0),②W―→Z(ΔH>0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
5.[2021·浙江五校联考]单斜硫和正交硫转化为二氧化硫的能量变化如图,下列说法正确的是( )
A.S(s,单斜)===S(s,正交) ΔH=-0.33kJ·mol-1
B.①式表示断裂1molO2中的共价键所吸收的能量比形成1molSO2中的共价键所放出的能量少297.16kJ
C.②式表示一个正交硫和分子1个O2分子反应生成一个SO2分子放出296.83kJ的能量
D.单斜硫比正交硫稳定
6.[2021·江苏东海学分认定考试]2SO2(g)+O2(g)2SO3(g)反应过程中能量变化如图所示(图中E表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是( )
A.该反应的逆反应为放热反应,升高温度可提高活化分子的百分数
B.ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
C.该反应中,反应物的总键能大于生成物的总键能
D.500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)2SO3(g) ΔH=-2akJ·mol-1
7.[2021·全国百强校宁夏育才中学月考]298K、101kPa时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )
A.加入催化剂,不能改变该化学反应的反应热
B.b曲线是加入催化剂时的能量变化曲线
C.该反应的热化学方程式为:N2(g)+3H2(g)2NH3(g) ΔH=-92kJ/mol
D.在常温、体积一定的条件下,通入1molN2和3molH2,反应后放出的热量为92kJ
8.[2021·长春实验中学高三开学考试]已知分解1molH2O2放出热量98kJ。在含有少量I-的溶液中,H2O2分解机理为:
①H2O2+I-===H2O+IO- 慢
②H2O2+IO-===H2O+O2+I- 快
下列说法不正确的是( )
A.v(H2O2)=v(H2O)=v(O2)
B.反应的速率与I-浓度有关
C.I-是该反应的催化剂
D.反应①的活化能大于反应②的活化能
9.[2021·河北卷]室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N===X+Y;②M+N===X+Z。反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法错误的是( )
A.0~30min时间段内,Y的平均反应速率为6.67×10-3mol·L-1·min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
10.研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是( )
A.反应总过程ΔH<0
B.Fe+使反应的活化能减小
C.FeO+也是该反应的催化剂
D.Fe++N2O―→FeO++N2、FeO++CO―→Fe++CO2两步反应均为放热反应
二、不定项选择题
11.[2021·长春实验中学高三开学考试]H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g)
ΔH=-akJ/mol。已知:
(a、b、c均大于零)。下列说法正确的是( )
A.H2、I2和HI分子中的化学键都是共价键
B.断开2molHI分子中的化学键所需能量约为(c+b+a) kJ
C.相同条件下,1molH2(g)和1molI2(g)总能量小于2molHI(g)的总能量
D.向密闭容器中加入2molH2(g)和2molI2(g),充分反应后放出的热量为2akJ
12.[2021·辽宁六校协作体上学期联考]下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
A.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s)+Cl2(g)===MgCl2(s)+Br2(g) ΔH=+117kJ·mol-1
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D.金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
13.[2021·浙江嘉兴高三月考]几种物质的能量关系如下图所示。下列说法正确的是( )
A.C(s)+O2(g)===CO2(g) ΔH=-965.1kJ·mol-1
B.2CO(g)+O2(g)===2CO2(g) ΔH=-221.2kJ·mol-1
C.由图可知,甲烷的燃烧热为890.3kJ·mol-1
D.通常由元素最稳定的单质生成1mol纯化合物时的反应热称为该化合物的标准生成焓,由图可知,CH4(g)的标准生成焓为+74.8kJ·mol-1
14.[2021·全国百强校宁夏育才中学月考]依据如图判断,下列说法正确的是( )
A.氢气的燃烧热ΔH=-241.8 kJ·mol-1
B.2molH2(g)与1molO2(g)所具有的总能量比2molH2O(g)所具有的总能量低
C.液态水分解的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+571.6kJ·mol-1
D.H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
15.如图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列说法不正确的是( )
A.过程Ⅰ中断裂极性键C—Cl键
B.过程Ⅱ可表示为O3+Cl===ClO+O2
C.过程Ⅲ中O+O===O2是吸热过程
D.上述过程说明氟利昂中氯原子是破坏O3的催化剂
三、非选择题
16.[设题创新](1)甲醇与O2的反应体系中存在以下反应:2CH3OH+O2===2HCHO+2H2O、CH3OH+O2===CO+2H2O、2CO+O2===2CO2。工业生产中常用催化剂来选择反应进行的方向。如图所示为一定条件下1molCH3OH与O2发生反应时,分别生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
①在催化剂作用下,反应初始阶段CH3OH与O2反应主要生成________(填“CO”“CO2”或“HCHO”)。
②2HCHO(g)+O2(g)===2CO(g)+2H2O(g)ΔH=________。
(2)查阅文献,化学键的键能数据如表所示:
化学键 | H—H | N—H | N≡N |
键能/(kJ·mol-1) | 436 | 391 | 946 |
已知氨分解反应NH3(g)H2(g)+N2(g)的活化能Eal=300kJ·mol-1,则反应3H2(g)+N2(g)2NH3(g)的活化能Ea2=________。
专练27 化学反应中的能量变化基本概念及图像
1.C 氢能是一种高效且没有污染的二次能源,A项正确;图中能量转化方式有太阳能转化为电能、风能转化为机械能、水能转化为机械能、机械能转化为电能、电能转化为化学能、化学能转化为电能、电能转化为光能等,B项正确;太阳能电池是用半导体将光能转化为电能,燃料电池是将化学能转化为电能,二者供电原理不同,C项错误;太阳能、风能、氢能都是人类开发利用的新型能源,D项正确。
2.D 根据反应过程示意图,过程Ⅰ是水分子中化学键的断裂过程,为吸热过程,A错误;H2中的化学键是非极性键,B错误;催化剂不能改变反应的ΔH,C错误;根据反应过程示意图,过程Ⅰ中水分子中的化学键断裂,过程Ⅱ也是水分子中的化学键断裂过程,过程Ⅲ中形成了水分子,所以H2O均参与了反应过程,D正确。
3.C 根据图像可知,反应①中反应物总能量大于生成物总能量,则反应①为放热反应,故A正确;反应②中HI中的碘元素化合价升高,氯化碘中的碘元素化合价降低,故B正确;由题图知,反应①的正反应活化能大于反应②的,故反应①比反应②的速率慢,C错误;由题图知,D正确。
4.A 总反应的ΔH>0,则生成物Z的总能量比反应物X、Y的总能量高,排除C项和D项;反应①的ΔH<0,则W的总能量比反应物X、Y的总能量低,反应②的ΔH>0,则生成物Z的总能量比反应物W的总能量高,A项正确。
5.A 由能量图可知,单斜硫的能量比正交硫的能量高,因此S(s,单斜) ===S(s,正交)为放热反应,ΔH=-0.33kJ·mol-1,A正确;①式反应断裂1mol单斜硫(s)中的共价键和1molO2(g)中的共价键吸收的能量比形成1molSO2(g)中的共价键所放出的能量少297.16kJ,B错误;热化学方程式中各物质前的化学计量数不再表示粒子的数目,只表示物质的“物质的量”,C错误;S(s,单斜)===S(s,正交)为放热反应,正交硫能量更低更稳定,D错误。
6.B 根据图中信息可知,反应物的总能量高于生成物的总能量,该反应的正反应为放热反应,则逆反应为吸热反应,A错误;该反应放热,ΔH<0,所以ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热,B正确;该反应中,反应物的总键能小于生成物的总键能,C错误;反应是可逆反应,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应,生成的SO3(g)小于1mol,放热akJ,则2SO2(g)+O2(g)2SO3(g) ΔH<-2akJ·mol-1,D错误。
7.D 催化剂能改变反应的路径,降低反应的活化能,但不能改变化学反应的反应热,A项正确;加入催化剂,降低反应的活化能,但不改变ΔH,反应速率加快,b曲线符合要求,B项正确;根据图像可知,1molN2和3molH2完全反应生成2molNH3时放出的热量为92kJ,C项正确;因为该反应为可逆反应,反应不能进行到底,所以通入1molN2和3molH2,反应后放出的热量小于92kJ,D项错误。
8.A 由于水是纯液体,不能用来表示反应速率,且根据总反应的计量关系,c(H2O2)=2v(O2),A错误;I-是反应的催化剂,但I-参与的第一步反应是慢反应,因此第一步为控速步骤,反应物I-的浓度影响反应速率,B正确;I-是反应的催化剂,C正确;反应①速率慢,反应②速率快,所以反应①活化能大于反应②的活化能,D正确。
9.A 0~30min时间段内,Δc(Z)=0.125mol·L-1,Δc(M)=0.500mol·L-1-0.300mol·L-1=0.200mol·L-1,反应①中Δc(M)=0.200mol·L-1-0.125mol·L-1=0.075mol·L-1,则Δc(Y)=0.075mol·L-1,v(Y)===2.5×10-3mol·L-1·min-1,A说法错误;反应①、②速率之比为==,为定值,则Y、Z的浓度变化量之比也为定值,故反应开始后,体系中Y和Z的浓度之比保持不变,B说法正确;由上述分析可知,===,如果反应能进行到底,反应结束时①、②的转化率之比为3:5,因此有(即62.5%)的M转化为Z,C说法正确;结合C选项,反应①的速率小于反应②的速率,所以反应①的活化能比反应②的活化能大,D说法正确。
10.C 总反应的化学方程式为N2O+CO===N2+CO2,根据图示可知,反应物总能量高于生成物总能量,为放热反应,ΔH<0,A项正确;根据反应历程,Fe+为催化剂,能够降低反应的活化能,B项正确;FeO+为中间产物,而不是催化剂,C项错误;根据图示,Fe++N2O―→FeO++N2、FeO++CO―→Fe++CO2,两反应中反应物总能量均高于生成物总能量,均为放热反应,D项正确。
11.AB H2、I2分子中的化学键都是非极性共价键,HI中存在H-I极性键,A正确;ΔH=反应物断裂化学键需要的能量-生成物形成化学键放出的能量=bkJ/mol+ckJ/mol-2H-I=-akJ/mol,得到断开2molH—I键所需能量约为(c+b+a) kJ,B正确;反应是放热反应,反应物的总能量大于生成物的总能量,即相同条件下,1molH2(g)和1molI2(g)总能量大于2molHI(g)的总能量,C错误;反应是可逆反应不能进行彻底,根据焓变意义分析,向密闭容器中加入2molH2和2molI2,充分反应后放出的热量小于2akJ,D错误。
12.D 依据图像可知①Mg(s)+Cl2(g)===MgCl2(s) ΔH=-641kJ·mol-1,②Mg(s)+Br2(g)===MgBr2(s) ΔH=-524kJ·mol-1,①-②得MgBr2(s)+Cl2(g)===MgCl2(s)+Br2(g) ΔH=-117kJ·mol-1,A错误;物质能量越低越稳定,根据图像数据分析,热稳定性:MgI2<MgBr2<MgCl2<MgF2,B错误;工业上冶炼金属Mg是电解熔融MgCl2,C错误;金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零,D正确。
13.BC 根据能量关系,无法计算出C和O2生成CO2的焓变,故A错误;根据能量关系,CO(g)+1/2O2(g)===CO2(g) ΔH=(854.5-965.1)kJ·mol-1=-110.6kJ·mol-1,故B正确;根据图可知,甲烷的燃烧热为890.3kJ·mol-1,故C正确;该反应为化合反应,属于放热反应,即CH4(g)的标准生成焓为(890.3-965.1) kJ·mol-1=-74.8kJ·mol-1,故D错误。
14.C 氢气的燃烧热是指1mol氢气完全燃烧生成液态水放出的热量,故氢气的燃烧热为(483.6+88)/2=285.8kJ·mol-1, A错误;2molH2(g)与1molO2(g)反应生成2molH2O(g),放出热量483.6kJ,所以2molH2(g)与1molO2(g)所具有的总能量比2molH2O(g)所具有的总能量高,B错误;液态水分解的热化学方程式为:2H2O(l)===2H2(g)+O2(g),ΔH=+(483.6+88)=+571.6kJ·mol-1,C正确;H2O(g)生成H2O(l)时,为物理变化,不存在化学键的断裂和生成,D错误;正确选项为C。
15.C 过程Ⅰ中CFCl3转化为CFCl2和氯原子,断裂极性键C—Cl键,选项A正确;根据图中信息可知,过程Ⅱ可表示为O3+Cl===ClO+O2,选项B正确;原子结合成分子的过程是放热的,选项C错误;上述过程说明氟利昂中氯原子是破坏O3的催化剂,选项D正确。
16.(1)①HCHO ②-470kJ·mol-1 (2)508kJ·mol-1
解析:(1)①活化能越低,普通分子越容易转化成活化分子,反应越容易发生,反应速率越快,单位时间内生成的产物越多,由题图可知在催化剂作用下,CH3OH与O2反应生成HCHO的活化能较低,故反应初始阶段主要生成HCHO。②根据图示可知2HCHO(g)+O2(g)===2CO(g)+2H2O(g)中反应物能量高,生成物能量低,故该反应为放热反应,然后依据图中给出数据可得ΔH=-[(676-158-283)×2]kJ·mol-1=-470kJ·mol-1。(2)根据ΔH=反应物总键能-生成物总键能,可知反应3H2(g)+N2(g)2NH3(g)的ΔH=3×436+946-2×3×391=-92(kJ·mol-1),再结合ΔH=正反应的活化能-逆反应的活化能=Ea2-2Ea1,可知Ea2=508kJ·mol-1。
新高考2024版高考化学一轮复习微专题小练习专练27化学反应中的能量变化基本概念及图像: 这是一份新高考2024版高考化学一轮复习微专题小练习专练27化学反应中的能量变化基本概念及图像,共5页。试卷主要包含了33 kJ·ml-1,16 kJ,83 kJ的能量,如图为氟利昂等内容,欢迎下载使用。
统考版2024版高考化学一轮复习微专题小练习专练27化学反应中的能量变化及图像: 这是一份统考版2024版高考化学一轮复习微专题小练习专练27化学反应中的能量变化及图像,共5页。
(通用版)高考化学一轮复习一遍过专题27化学平衡图像专练(含解析): 这是一份(通用版)高考化学一轮复习一遍过专题27化学平衡图像专练(含解析),共26页。试卷主要包含了已知反应,如图所示的各图中,表示2A,生产硫酸的主要反应,已知,为探究外界条件对可逆反应等内容,欢迎下载使用。












