

2022届高三化学一轮复习化学反应原理题型必练50原电池原理含解析
展开原电池原理
一、单选题(共15题)
1.将用导线连接的两根铂电极放置在KOH溶液中,然后分别向两极通入H2和O2,即可产生电流,形成燃料电池,其电池反应为:2H2+O2=2H2O。下列叙述正确的是
A.通入H2的电极为正极,通入O2的电极为负极
B.正极的电极反应为:O2 +2H2O+4e- = 4OH-
C.电池工作时溶液中的阳离子向负极移动,阴离子向正极移动
D.电池工作时电流由负极通过导线流向正极
2.我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4A1+3O2+6H2O=4Al(OH)3,下列判断正确的是
A.该电池通常只需要更换铂网就可继续使用
B.正极反应为:O2+H2O+2e-=2OH-
C.铂电极做成网状,可增大与氧气的接触面积
D.电池工作时,电子由铂网沿导线流向铝板
3.一种肼(N2H4)—空气碱性燃料电池工作原理如图所示。下列说法错误的是
A.a为空气,b为N2H4
B.M为正极,电极反应为O2+4e-+4H+=2H2O
C.电路中通过1mole-时,同时有1molOH-从左室通过阴离子交换膜移到右室
D.当有16gN2H4完全反应生成N2,消耗标准状况下11.2LO2
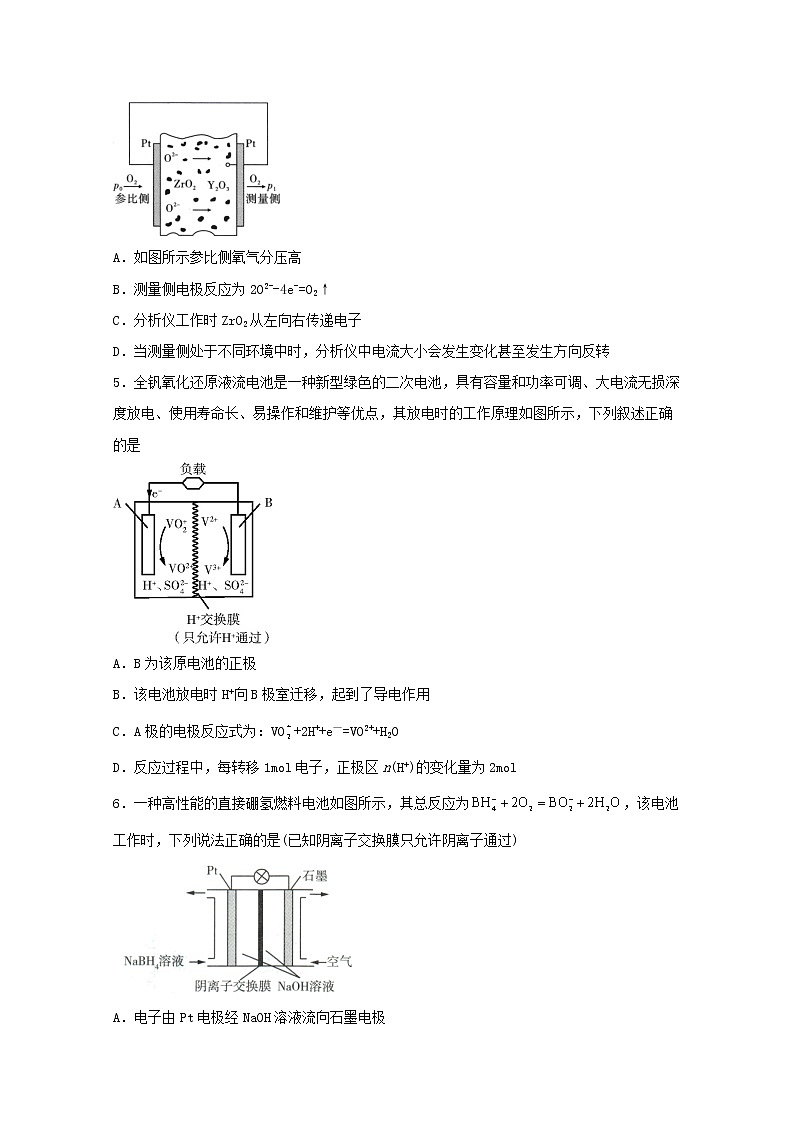
4.烟气中的含氧浓度常用氧化锆氧量分析仪测定,工作原理如图所示,下列说法不正确的是
A.如图所示参比侧氧气分压高
B.测量侧电极反应为2O2--4e-=O2↑
C.分析仪工作时ZrO2从左向右传递电子
D.当测量侧处于不同环境中时,分析仪中电流大小会发生变化甚至发生方向反转
5.全钒氧化还原液流电池是一种新型绿色的二次电池,具有容量和功率可调、大电流无损深度放电、使用寿命长、易操作和维护等优点,其放电时的工作原理如图所示,下列叙述正确的是
A.B为该原电池的正极
B.该电池放电时H+向B极室迁移,起到了导电作用
C.A极的电极反应式为:VO+2H++e—=VO2++H2O
D.反应过程中,每转移1mol电子,正极区n(H+)的变化量为2mol
6.一种高性能的直接硼氢燃料电池如图所示,其总反应为,该电池工作时,下列说法正确的是(已知阴离子交换膜只允许阴离子通过)
A.电子由Pt电极经NaOH溶液流向石墨电极
B.负极的电极反应为
C.透过阴离子交换膜向石墨电极迁移
D.外电路通过0.4 mol电子时,有在石墨电极上参与反应
7.某固体酸燃料电池以固体为电解质传递,其基本结构如图所示,电池总反应可表示为,下列有关说法正确的是
A.电子通过外电路从a极流向b极
B.b上电极反应为
C.每转移0.1 mol电子,消耗
D.由b极通过固体电解质传递到a极
8.某微生物电池在运行时可同时实现净化有机物污水、净化含废水(pH约为6)和淡化食盐水,其装置如图所示。图中D和E为阳离子交换膜或阴离子交换膜,Z为待淡化食盐水。已知完全沉淀时的pH为5.6,下列说法错误的是
A.E为阴离子交换膜
B.X为有机物污水,Y为含废水
C.理论上处理的同时可脱除6 mol的NaCl
D.正极的电极反应为
9.下列关于图中所示原电池的说法正确的是
A.当a为Cu,b为含有碳杂质的Al,c为稀硫酸时,b极上不能观察到气体产生
B.当a为石墨,b为Fe,c为稀硫酸时,外电路中有电流
C.当a为Mg,b为Al,c为NaOH溶液时,根据现象可推知Al的活泼性强于Mg的活泼性
D.当a为石墨,b为Cu,c为溶液时,外电路中没有电流
10.最近,科学家报道了一种新型可充电钠电池,其工作原理如图所示,已知电池的比能量是参与电极反应的单位质量的电极材料放出电能的大小。下列说法错误的是
A.上述过程为放电过程
B.充电时,Na+向X极迁移
C.放电时,Y极反应为CaFeO3+Na++e-=CaFeO2.5+0.5Na2O
D.该钠电池的比能量大于传统的锂电池
11.如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中,下列分析正确的是
A.K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的保护法
D.K2闭合,电路中通过2NA个电子时,两极共产生1 mol气体
12.微生物燃料电池可以净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中浓度与去除率的关系。下列说法不正确的是
A.M为电池负极,被氧化
B.该电池工作时,M极的电极反应式为
C.当M极产生气体(标准状况)时,有4 mol电子从N极进入溶液
D.浓度较大时,可能会造成还原菌失去活性
13.如图是一个用废旧材料制作的可用于驱动玩具的电池示意图,该电池工作时,有关说法正确的是
A.木炭棒做电池的正极发生氧化反应
B.铝罐将逐渐被腐蚀
C.电池工作时,电子从铝经电解质溶液流向木炭棒
D.因为一开始反应就会生成大量氯气,该电池有一定的危险性
14.把低密度的太阳能高效转化为可存储的化学能,是发展可再生能源的重要途径。下图所示的联合装置可实现太阳能的利用、转化及储存。下列有关说法不正确的是
A.太阳能电池可将光能直接转换为电能 B.X的电极反应式为
C.X是阳极 D.Y电极连接太阳能电池的P极
15.某同学利用家中废旧材料制作可使扬声器发出声音的电池,装置如图所示。下列说法不正确的是
A.扬声器发声,说明该装置将化学能转化为电能
B.铝质易拉罐逐渐被腐蚀,说明铝失去电子作正极
C.在碳棒上有气体生成,该气体可能为氢气
D.电子由铝制易拉罐经导线流向碳棒
二、填空题(共5题)
16.氮及其化合物在化肥、医药、材料和国防工业中具有广泛应用。回答下列问题:
(1)氮元素在周期表中的位置为_______,N2的电子式为_______。
(2)自上个世纪德国建立了第一套合成氨装置,合成氨工业为解决人类的温饱问题作出了极大贡献。写出实验室制备氨气的方程式_______。
(3)有人设想寻求合适的催化剂和电极材料,以、为电极反应物,以为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。
①a电极是该电池的_______(填正极或者负极);该电池正极的电极反应式是_______。
②该电池在工作过程中的浓度将不断_______(填增大或减小),假设放电过程中电解质溶液的体积不变,当溶液中的物质的量改变时,理论上电池能为外电路提供___mol电子。
17.人们应用原电池原理制作了多种电池,以满足不同的需要。以下各种电池广泛使用于日常生活.生产和科学技术等方面,请根据题中提供的信息填空:
(1)如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓CuSO4溶液,(实验过程中,不考虑铁丝反应及两球的浮力变化)一段时间后,当杠杆为绝缘体时,___端高;当杠杆为导体时,____端高(填“A”或“B”)。
(2)铁、铜、铝是生活中使用广泛的金属,溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为______,若将此反应设计成原电池,则负极所用电极材料为____,正极反应式为_____。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为_____。
A.铝片、铜片B.铜片、铝片C.铝片、铝片D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式:_______。
(4)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl,当电路中转移amole-时,交换膜左侧溶液中约减少_______mol离子。交换膜右侧溶液中c(HCl)_______(填“>”“<”或“=”)1mol·L-1(忽略溶液体积变化)。
18.如图所示,C、D、E、F都是惰性电极,A、B为电源。将电源接通后,向乙中滴人酚酞溶液,在F极附近显红色,D质量增加。
(1)AB作为电源,可以利用多种原电池来提供电能,兴趣小组同学设计如下电源:
①小红同学设计利用反应“Cu+2Fe3+=Cu2++2Fe2+”制成化学电池来提供电能,该电池的负极材料是____,电解质溶液是____。
②小秦同学设计将铝片和铜片用导线相连,一组插人浓硝酸中,一组插人烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为___(填字母)。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
③小明同学利用CO、氧气燃料电池作电源,电解质为KOH溶液,A电极上的反应式为___,工作一段时间后溶液的pH___(填“增大”“减小”或“不变”)。
(2)若甲中装有足量的硫酸铜溶液,工作一段时间后,停止通电,欲使溶液恢复到起始状态,可向溶液中加入____(填字母)。
A.Cu B.Cu2(OH)2CO3 C.Cu(OH)2 D.CuCO3
(3)通电后乙中发生的总反应方程式为____。
(4)欲用丙装置给铜镀银,则金属银应为___(填“G”或“H”)极,反应一段时间后(用CO、氧气燃料电池作电源)铜制品质量增加43.2g,理论上消耗氧气的质量为____g。
19.(1)利用8NH3+6NO2=7N2+12H2O可以消除氮氧化物的污染,若设计成原电池,使用2mol·L-1的KOH溶液为电解质溶液。该电池正极的电极反应式为_______,放电一段时间后,负极附近溶液pH将_______(填“增大”、“减小”或“不变”)。
(2)一种熔融碳酸盐燃料电池原理示意如图所示
①写出催化重整的化学方程式_______。
②电池工作时,向_______(填A或B)极移动,电极A上H2参与的电极反应为:_______。
③用电器中每转移2mol电子,理论上电极B处消耗的气体体积(标准状况下)为_______L。
20.I.人们运用原电池原理制作了多种电池,以满足不同的需要。以下各种电池广泛运用于日常生活、生产和科学技术等方面,请根据题中提供的信息填空:
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)+2H2O2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是___。
(2)一种熔融碳酸盐燃料电池原理示意如图:电极A上CO参与的电极反应为__。
(3)磷酸亚铁锂电池工作时的总反应为Li1-xFePO4+LixC6LiFePO4+6C,则放电时,正极的电极反应式为____。
(4)如图是瑞典ASES公司设计的曾用于驱动潜艇的液氨—液氧燃料电池的示意图,该燃料电池工作时,电池的总反应方程式___,负极的电极反应式为___。
II.现有短周期元素X形成的单质A与NaOH溶液反应,有如图转化关系(若产物中有水生成则省略未表示出来)。
(5)常温常压下,若A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为___。
参考答案
1.B
【详解】
略
2.C
【详解】
略
3.B
【详解】
A.燃料电池中,通入燃料的一极为负极、电子从负极流出,通入助燃物的一极为正极,则a为空气,b为N2H4,A正确;
B.此电池为碱性燃料电池,M为正极,则电极反应为O2+4e-+2H2O =4OH-,B不正确;
C.燃料电池中,阴离子移向负极、按电子数守恒, 有关系式 ,则电路中通过1mole-时,同时有1molOH-从左室正极区通过阴离子交换膜移到右室负极区,C正确;
D.负极反应式为:,正极电极反应为O2+4e-+2H2O =4OH-,按电子数守恒,,当有1mol即32gN2H4完全反应生成N2,消耗1molO2,则当有16gN2H4完全反应生成N2,消耗0.5molO2、即标准状况下11.2LO2,D正确;
答案选B。
4.C
【详解】
A.根据氧浓度电势,氧分压高的一侧的氧以离子形式向氧分压低的一侧迁移,所以参比侧氧分压高,故A正确;
B.氧离子迁移到测量侧失电子生成氧气,故B正确;
C.ZrO2是固体电解质能传递氧离子,故C错误;
D.环境中氧浓度不同,电流会发生变化,当氧浓度大于参比侧时,电池的正负极会互换,故D正确;
故选C。
5.C
【分析】
由图可知,A极为电池的正极,酸性条件下,VO在正极得到电子发生还原反应生成VO2+,电极反应式为VO+2H++e—=VO2++H2O,B极为负极,V2+离子在负极失去电子发生氧化反应生成V3+离子,电极反应式为V2+—e—= V3+,放电的总反应为VO+2H++ V2+= VO2++ V3++H2O。
【详解】
A.由分析可知,B极为原电池的负极,故A错误;
B.电池放电时,氢离子透过氢离子交换膜向正极A极室迁移,起到了导电作用,故B错误;
C.由分析可知,A极为电池的正极,酸性条件下,VO在正极得到电子发生还原反应生成VO2+,电极反应式为VO+2H++e—=VO2++H2O,故C正确;
D.由分析可知,反应过程中,每转移1mol电子,正极消耗2mol氢离子,有1mol氢离子通过氢离子交换膜进入正极区,则正极区氢离子的变化量为1mol,故D错误;
故选C。
6.B
【详解】
A.由电池总反应及题图可知Pt为负极,石墨为正极。原电池工作时,电子由Pt电极(负极)经过导线流向石墨电极(正极),电子不能进入NaOH溶液,A项错误;
B.Pt电极为原电池的负极,电极反应为,B项正确;
C.原电池工作时,P电极为负极,石墨电极为正极,电解质溶液中的阴离子移向负极,即透过阴离子交换膜向Pt电极迁移,C项错误;
D.正极上氧气发生得电子的还原反应,电极反应为,外电路通过0.4 mol电子时,有在石墨电极上参与反应,标准状况下的体积为,但题中未说明所处的状况,所以的体积不一定为,D项错误。
故选B。
7.A
【详解】
A.根据电池总反应可知,通入氢气的一极为电池的负极,通入氧气的一极为电池的正极,即a极是负极,b极是正极。电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,A项正确;
B.b极通入氧气,为电池的正极,酸性条件下,氧气得电子生成水,电极反应为,B项错误;
C.没有指明物质所处的状况,无法计算的体积,C项错误;
D.原电池中阳离子向正极移动,即由a极通过固体电解质传递到b极,D项错误;
故选A。
8.A
【详解】
A.由装置图中电子的移动方向可知,该原电池中碳布为正极,放电时阳离子移向正极,阴离子移向负极,为淡化食盐水,则移向C室,移向A室,所以E为阳离子交换膜,A项错误;
B.该原电池中碳布为正极,在正极得电子发生还原反应,有机物在负极失电子发生氧化反应,所以X为有机物污水,Y为含废水,B项正确;
C.该原电池正极得电子,发生还原反应,则正极的电极反应为,则理论上处理-的同时转移6 mol电子,即有、分别定向移动,即可脱除6 mol NaCl,C、D项正确。
故选A。
9.B
【详解】
A.因b为含有碳杂质的Al,C、Al在稀硫酸中可以构成原电池,溶液中的在b极上得到电子而产生,所以在b极上可观察到有气体产生,故A错误;
B.Fe能与稀硫酸发生氧化还原反应,则石墨、Fe在稀硫酸中能形成原电池,外电路中有电流通过,故B正确;
C.Al可与NaOH溶液反应,Mg、Al在氢氧化钠溶液中可以构成原电池,Al做原电池的负极,但实际上Mg的活泼性强于Al的活泼性,故C错误;
D. Cu能与溶液发生氧化还原反应,则石墨、Cu在溶液能形成原电池而产生电流,故D错误;
故选B。
10.D
【详解】
A.根据原电池反应原理可知放电时Na在X电极失去电子变为Na+,CaFeO3在Y电极上得到电子变为CaFeO2.5,所以上述过程为放电过程,A正确;
B.充电时,原电池负极X电极连接电源的负极为阴极,则Na+向X极迁移,并在阴极上得到电子被还原为Na,B正确;
C.原电池放电时,Y极为正极,得到电子,发生还原反应,正极的电极反应式为:CaFeO3+Na++e-=CaFeO2.5+0.5Na2O,C正确;
D.不同碱金属反应产生1 mol电子,需消耗1 mol Na,其质量是23 g;需消耗1 mol Li,其质量是7 g,故该钠电池的比能量小于传统的锂电池,D错误;
故合理选项是D。
11.B
【详解】
A.若闭合K1,该装置没有外接电源,所以构成了原电池,较活泼的金属铁作负极,负极上铁失电子,Fe-2e-=Fe2+,故A错误;
B.若闭合K1,该装置没有外接电源,所以构成了原电池,不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,所以石墨棒周围溶液pH逐渐升高,故B正确;
C.K2闭合,Fe与负极相连为阴极,铁棒不会被腐蚀,属于外加电源的阴极保护法,故C错误;
D.K2闭合,电路中通过2NA个电子时,阴极生成1mol氢气,阳极生成1mol氯气,两极共产生2mol气体,故D错误;
故选:B。
12.C
【详解】
A.根据图示,电子由M极流向N极,说明M为电池负极,负极发生氧化反应,A正确;
B.负极电极反应为可知,B正确;
C.M极产生气体(标准状况)时,有4 mol电子从M极流向N极,但电子不进入溶液,C错误;
D.由图2可知当浓度为时,去除率为0,因为其有强氧化性和毒性,使还原菌的蛋白质变性而失去活性,D正确;
故选C。
13.B
【详解】
A.木炭棒做电池的正极发生还原反应,故A错误;
B.铝罐是负极,负极失电子发生氧化反应,铝罐将逐渐被腐蚀,故B正确;
C.电池工作时,铝是负极、木炭棒是正极,电子从铝经导线流向木炭棒,故C错误;
D.负极铝失电子生成铝离子,正极氧气得电子生成氢氧根离子,反应不会生成氯气,故D错误;
选B。
14.C
【详解】
A.太阳能电池可将光能直接转换为电能,A项正确;
B.由图可知,X电极上,V3+转化为V2+,其电极反应式为,B项正确;
C.X电极上,V3+转化为V2+,V元素的化合价降低,发生还原反应,X电极为阴极,C项错误;
D.Y电极为阳极,连接电池的正极,在a中,阳离子移向p电极,则p电极为正极,故Y电极连接太阳能电池的P极,D项正确;
答案选C。
15.B
【详解】
A.该装置为原电池,将化学能转化为电能,从而使扬声器发声,故A正确;
B.铝为负极,铝失去电子生成铝离子,铝质易拉罐逐渐被腐蚀,故B错误;
C.碳棒为正极,在碳棒上有气体生成,可能是稀醋酸溶液中的H+得电子生成氢气,故C正确;
D.原电池中,电子从负极经导线流向正极,故电子由铝制易拉罐经导线流向碳棒,故D正确;
故选:B。
16.第二周期第VA族 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O 正极 N2+8H++6e-=2 减小 2.4
【详解】
(1)氮元素原子序数为7,核外电子排布为2、5,位于第二周期VA族,氮气的电子式为:,故答案为:第二周期第VA族;;
(2)实验室制取氨气利用的是熟石灰与氯化铵的混合固体加热,反应方程式为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;
(3)①该电池的的原理为氮气和氢气在HCl做电解质的条件下发生反应最终生成氯化铵,a极区氮气在电极上得电子反应还原反应,作正极,电极反应为:N2+8H++6e-=2,b极上氢气失电子发生氧化反应,作负极,故答案为:正极;N2+8H++6e-=2;
②该电池的总反应为: ,由总反应可知反应过程中消耗氢离子,溶液中的浓度减小,由反应可知每消耗2mol氢离子,转移6mol电子,当溶液中的物质的量改变时,转移电子的物质的量为2.4mol,故答案为:减小;2.4。
17.A B 2Fe3++Cu=2Fe2++Cu2+ Cu Fe3++e-=Fe2+ B Al+4OH--3e-=+2H2O 2a >
【详解】
(1)当杠杆为绝缘体时,加入硫酸铜溶液后,铁和硫酸铜发生置换反应生成铜附着在铁表面,质量增加,因此是A端比B揣高;当杠杆为导体时,加入硫酸铜溶液后,铁和铜构成原电池。铁的金属性强于铜,因此铁是负极失去电子,被还原。铜是正极,溶液中的铜离子得到电子,发生还原反应析出铜。因此是A端比B端低;
(2)氯化铁溶液常用于腐蚀印刷电路铜板,离子方程式为:2Fe3++Cu=2Fe2++Cu2+;该反应为氧化还原反应,铜发生氧化反应,做原电池的负极,正极材料只要能够导电且活泼性小于铜即可,氯化铁在正极得电子发生还原反应,电极反应式:Fe3++e-=Fe2+;
(3)将铝片和铜片用导线相连,插入浓硝酸中,形成原电池,常温下,Al遇浓硝酸钝化,所以Cu电极作负极;将铝片和铜片用导线相连,插入烧碱溶液中,AI能和NaOH溶液反应生成NaAlO2和H2,Cu不能和NaOH溶液反应,所以Al作负极,答案选B;烧碱溶液中形成原电池的负极反应式:Al+4OH--3e-=+2H2O;
(4)负极电极反应式为Ag-e-+Cl-=AgCl,原电池工作时,电路中转移amole-,则负极消耗amolCl-,形成闭合回路移向正极的n(H+)=amol,所以负极区即交换膜左侧溶液中约减少2amol离子;正极区电极反应为Cl2+2e-=2Cl-,生成n(HCl)=amol,所以交换膜右侧溶液c(HCl)增大,即交换膜右侧溶液c(HCl)>1mol/L,故答案为:2a;>。
18.Cu 氯化铁等含铁离子的溶液 B 减小 D G 3.2g
【分析】
电解池中,与电源正极相连的电极是阳极,阳极上失去电子发生氧化反应,与电源负极相连的电极是阴极,阴极上氧化剂得到电子发生还原反应,图中C、D、E、F都是惰性电极,将电源接通后,向乙中滴酚酞溶液,在F极附近显红色,则F电极反应为: 、F为阴极,D质量增加,则D电极反应为:,D为阴极;则A为正极、B为负极;C、E和G为阳极、D、F和H为阴极;原电池中,还原剂在负极失去电子发生氧化反应,正极上氧化剂得到电子发生还原反应,据此回答;
【详解】
(1)①小红同学设计利用反应“”制成化学电池来提供电能,Cu+2Fe3+=Cu2++2Fe2+中Cu为还原剂,故电池的负极材料是Cu,正极上Fe3+得到电子转变为Fe2+,则电解质溶液是含铁离子的溶液,例如氯化铁。
②铝与浓硝酸发生钝化反应,铜与浓硝酸反应生成硝酸铜、水和二氧化氮,故该原电池中铜为负极,铝能与氢氧化钠溶液反应:,铜不能与氢氧化钠溶液反应,则该原电池中,负极为铝。则B满足;答案为B。
③小明同学利用CO、氧气燃料电池作电源,电解质为KOH溶液,A电极上的反应式为,CO在负极失去电子发生氧化反应:,按得失电子数守恒,负极消耗的氢氧根离子大于正极生成的氢氧根离子,故工作一段时间后溶液的pH减小。
(2)若甲中装有足量的硫酸铜溶液,反应为,设电解消耗2mol CuSO4,则欲使溶液恢复到起始状态,可向溶液中加入相当于2molCuO的物质,则D满足,答案为D。
(3)通电后乙中发生的是惰性电极电解氯化钠溶液,产物为氢氧化钠,氢气和氯气:总反应方程式为。
(4) 电镀时,镀层金属作阳极、待镀金属作阴极;欲用丙装置给铜镀银,则金属银应为G极,按得失电子数守恒,得, 反应一段时间后(用CO、氧气燃料电池作电源)铜制品质量增加43.2g,则消耗银,理论上消耗氧气0.1mol、氧气的质量为3.2g。
19.2NO2+8e-+4H2O=N2+8OH- 减小 CH4+H2OCO+3H2 A H2-2e-+=H2O+CO2 33.6
【详解】
(1)电池的总反应为8NH3+6NO2=7N2+12H2O,使用2mol·L-1的KOH溶液为电解质溶液,则电池正极的电极反应式为2NO2+8e-+4H2O=N2+8OH-;负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O,负极消耗OH-,则负极附近溶液pH将减小;
(2)①由图可知,CH4和H2O经催化重整生成CO和H2,化学方程式为CH4+H2OCO+3H2;
②电极A上CO和H2,参与反应生成CO2和H2O,电极A上H2参与的电极反应为H2-2e-+=H2O+CO2,电极A上消耗,则向A极移动;
③电极B的电极反应式为2CO2+O2+4e-=2,用电器中每转移2mol电子,电极B上消耗1mol CO2和0.5mol O2,则标准状况下,消耗的气体体积为。
20.2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH- CO-2e-+CO=2CO2 Li1-xFePO4+xLi++xe-=LiFePO4 4NH3+3O2=2N2+6H2O 2NH3-6e-+6OH-=N2+6H2O 2C+SiO22CO↑+Si
【详解】
I.(1)由电池的总反应可知,该电池放电时,镉在负极上被氧化生成氢氧化镉、氢氧化氧镍在正极上被还原生成氢氧化镍,故正极的反应式是2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH-;
(2)由该燃料电池原理示意图可知,燃料由电极A通入、氧气和二氧化碳由电极B通入,则A为负极、B为正极,电极A上CO参与的电极反应为CO-2e-+CO=2CO2;
(3)放电时,正极上Li1-xFePO4得电子生成LiFePO4,则正极的电极反应式Li1-xFePO4+xLi++xe-=LiFePO4;
(4)液氨—液氧燃料电池中液氨为负极,失电子生成氮气;氧气为正极,得电子生成水,故电池的总反应方程式4NH3+3O2=2N2+6H2O,负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O;
Ⅱ.(5)A为非金属固态单质,且其在电子工业中有着重要的用途,则A为Si,工业上制取硅的化学方程式为2C+SiO22CO↑+Si。
2022届高三化学一轮复习化学反应原理题型必练71化学反应原理基础题含解析: 这是一份2022届高三化学一轮复习化学反应原理题型必练71化学反应原理基础题含解析,共34页。试卷主要包含了已知化学反应①等内容,欢迎下载使用。
2022届高三化学一轮复习化学反应原理题型必练70化学反应原理基础题含解析: 这是一份2022届高三化学一轮复习化学反应原理题型必练70化学反应原理基础题含解析,共33页。试卷主要包含了下列说法正确的是_______等内容,欢迎下载使用。
2022届高三化学一轮复习化学反应原理题型必练66原电池的有关计算含解析: 这是一份2022届高三化学一轮复习化学反应原理题型必练66原电池的有关计算含解析,共21页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。












