





人教版新高考化学一轮复习课件--电离平衡
展开1.能用化学用语正确表示电离平衡,能通过实验证明水溶液中存在的电离平衡,能举例说明电离平衡在生产、生活中的应用。2.能从电离、离子反应、化学平衡的角度分析溶液的性质,如酸碱性、导电性等。3.能进行溶液pH的简单计算,能正确测定溶液pH,能调控溶液的酸碱性。能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。4.能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题。
1.本节主要考查内容有:(1)强、弱电解质的判断与比较;(2)外界条件对弱电解质电离平衡的影响;(3) 电离平衡以及溶液的导电性的变化等;(4)电离平衡常数的计算及应用。题型以选择题为主,难度适中。2.弱电解质的电离平衡,复习时注意与溶液的酸碱性、盐类水解的知识结合理解。注意电离平衡常数与化学平衡常数的异同。
第一环节 必备知识落实
第二环节 关键能力形成
第三环节 核心素养提升
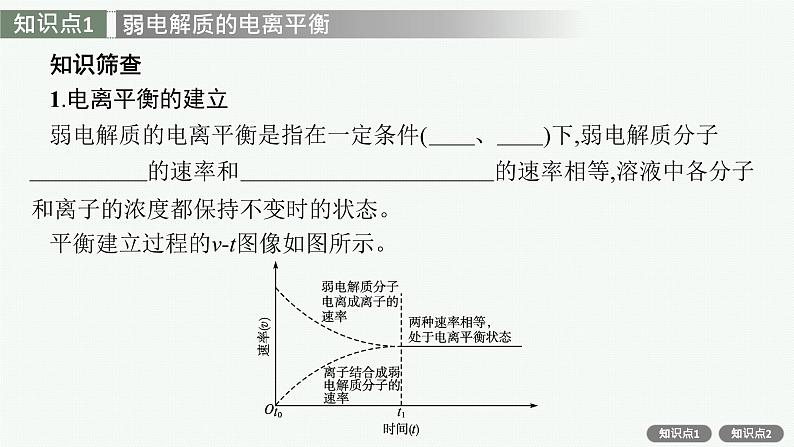
知识筛查1.电离平衡的建立弱电解质的电离平衡是指在一定条件(温度、浓度)下,弱电解质分子电离成离子的速率和离子结合成弱电解质分子的速率相等,溶液中各分子和离子的浓度都保持不变时的状态。平衡建立过程的v-t图像如图所示。
2.弱电解质电离平衡的特征
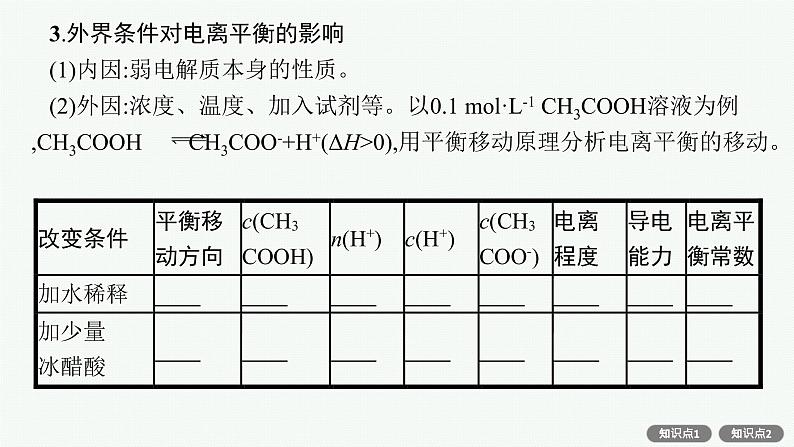
3.外界条件对电离平衡的影响(1)内因:弱电解质本身的性质。(2)外因:浓度、温度、加入试剂等。以0.1 ml·L-1 CH3COOH溶液为例,CH3COOH CH3COO-+H+(ΔH>0),用平衡移动原理分析电离平衡的移动。
特别提醒(1)稀醋酸加水稀释时,溶液中的各离子浓度并不是都减小,如c(OH-)是增大的。(2)电离平衡右移,电解质分子的浓度不一定减小,电离程度也不一定增大,如稀醋酸中加入冰醋酸。
知识巩固1.判断正误,正确的画“√”,错误的画“×”。(1)强电解质的稀溶液中不存在溶质分子,弱电解质的稀溶液中存在溶质分子。( )(2)NH3溶于水,当NH3·H2O电离出的c(OH-)=c( )时,表明NH3·H2O电离处于平衡状态。( )(3)室温下,由0.1 ml·L-1一元碱BOH的pH=10可知,溶液中存在BOH══B++OH-。( )(4)电离平衡向右移动,电解质分子的浓度一定减小,离子浓度一定增大。( )
(5)25 ℃时,向10 mL 0.1 ml·L-1醋酸中加水稀释,各离子浓度均减小。( )(6)电离平衡向右移动,弱电解质的电离程度一定增大。( )(7)强电解质溶液的导电能力一定比弱电解质溶液的导电能力强。( )
2.下列有关电离平衡的叙述正确的是( )。A.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动B.达到电离平衡时,由于分子和离子的浓度仍在不断发生变化,所以说电离平衡是动态平衡C.电解质在溶液中达到电离平衡时,分子的浓度和离子的浓度相等D.电解质达到电离平衡后,各种离子的浓度相等
解析:电离平衡是化学平衡的一种,达到平衡时,反应仍在进行,弱电解质分子电离成离子的速率和离子结合成分子的速率相等,各分子和离子的浓度不再变化,与分子和离子浓度是否相等没有关系,所以只有A项正确。
3.意义同一温度下,K越大→越易电离→酸(碱)性越强
2.相同温度下,三种酸的电离常数如表所示,下列判断正确的是( )。
A.三种酸的酸性强弱关系:HX>HY>HZB.反应HZ+Y-══HY+Z-能够发生C.相同温度下,0.1 ml·L-1的NaX、NaY、NaZ溶液,NaZ溶液的pH最大D.相同温度下,1 ml·L-1 HX溶液的电离常数大于0.1 ml·L-1 HX的电离常数
解析:由表中三种酸的电离常数可知,三种酸的酸性强弱关系为HZ>HY>HX,A项不正确,B项正确。酸的电离程度越大,酸根离子的水解程度就越小,则相同浓度的钠盐溶液,酸根离子水解程度越大的溶液其碱性越强,所以NaZ溶液的pH最小,C项不正确。电离常数只与温度有关,与浓度无关,D项不正确。
整合建构运用电离常数能解决的电解质的电离问题(1)判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。(2)判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,碱性(或酸性)越弱。(3)判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
(4)判断粒子浓度比值的变化。弱电解质加水稀释时,能促进弱电解质的电离,溶液中离子和分子的浓度会发生相应的变化,但电离常数不变,考题中经常利用电离常数来判断溶液中粒子浓度比值的变化情况。
问题引领利用电离平衡常数解决问题的一般思路是什么?点拨利用电离平衡常数解题的思维模型。
Ⅰ为CH3COOH,Ⅱ为HClO,两种酸开始时的pH相等,故较弱的酸浓度大,即HClO浓度大,故A点酸的总浓度小于B点酸的总浓度,C项正确。溶液中存在电荷守恒,即c(Na+)+c(H+)=c(ClO-)+c(CH3COO-)+c(OH-)=0.2 ml·L-1 +c(H+),由元素质量守恒c(CH3COO-)+c(CH3COOH)=0.1 ml·L-1,结合两式可得c(OH-)=0.1 ml·L-1-c(ClO-)+c(H+)+c(CH3COOH),D项正确。
2.常温下,某酸HA的电离常数Ka=1×10-5。下列说法中正确的是( )。
B.常温下,0.1 ml·L-1 HA溶液中水电离出的c(H+)为10-13 ml·L-1C.NaA溶液中加入盐酸至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-)D.常温下,0.1 ml·L-1 NaA溶液的水解常数为10-9
整合建构1.等物质的量浓度、相同体积的一元强酸溶液与一元弱酸溶液的比较
2.相同pH、相同体积的一元强酸溶液与一元弱酸溶液的比较
说明:一元强碱与一元弱碱的比较规律与上述类似。
3.用图像法理解一强一弱的稀释规律(1)相同体积、相同浓度的盐酸、醋酸。
(2)相同体积、相同pH的盐酸、醋酸。
问题引领从哪些角度能证明某种电解质属于弱电解质?点拨通过实验证明水溶液中存在的离子平衡的三个角度。角度一 通过证明弱电解质不能完全电离。如测0.1 ml·L-1的CH3COOH溶液的pH>1。角度二 通过改变条件,电离平衡发生移动,即存在电离平衡。如pH=1的CH3COOH溶液加水稀释至原体积的10倍后1
训练突破1.现有室温下四种溶液,有关叙述不正确的是( )。
A.在③④溶液中分别加入适量的醋酸钠晶体后,两溶液的pH均增大B.将②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)C.分别加水稀释至原体积的10倍,四种溶液的pH:①>②>④>③D.将a L④与b L①溶液混合,若所得溶液显中性,则a
解析:若X为强碱,则10 mL pH=12的X溶液稀释至1 000 mL,pH应该为10,故若10
解析:随着NaOH溶液的加入,混合溶液中离子浓度和种类发生变化,因此混合溶液的导电能力与离子浓度和种类有关,A项正确;P点的混合溶液中能导电的离子主要为HA-和K+,Q点为反应终点,因此Q点的混合溶液中能导电的离子主要为A2-、K+、Na+,故Na+与A2-的导电能力之和大于HA-的,B项正确;Q点的混合溶液中含有的A2-能发生水解反应而使溶液呈碱性,C项错误;Q点为反应终点,因此Q点的混合溶液中c(Na+)=c(K+)>c(OH-),继续加入氢氧化钠溶液后,M点的混合溶液中c(Na+)>c(K+)>c(OH-),D项正确。
1.(2019全国Ⅲ)设NA为阿伏加德罗常数的值。关于常温下pH=2的H3PO4溶液,下列说法正确的是( )。A.每升溶液中的H+数目为0.02NA
C.加水稀释使电离度增大,溶液pH减小D.加入NaH2PO4固体,溶液酸性增强
常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )。A.C点时,溶液中由水电离的c(OH-)约为1×10-10 ml·L-1B.电离平衡常数:Ka(HA)
2020版高考化学一轮复习考点备考课件8.1.2电离平衡常数电离度 (含解析): 这是一份2020版高考化学一轮复习考点备考课件8.1.2电离平衡常数电离度 (含解析),共9页。PPT课件主要包含了速查速测,浓度增大电离度减小,与浓度无关,典例剖析,醋酸过量,7×10-7,反思归纳,电离常数的4大应用,K值越大酸性越强,三段式列式计算等内容,欢迎下载使用。
人教版高考化学一轮复习8.1弱电解质的电离平衡课件: 这是一份人教版高考化学一轮复习8.1弱电解质的电离平衡课件
人教版高考化学一轮总复习第9章第1节电离平衡课时教学课件: 这是一份人教版高考化学一轮总复习第9章第1节电离平衡课时教学课件,共60页。PPT课件主要包含了环节1课前自主复习,环节2高考热点突破,环节3新情境专项练等内容,欢迎下载使用。












