
2021-2022年最新人教版九年级化学下册第九单元溶液期中复习试卷【A4版】
展开最新人教版九年级化学下册第九单元溶液期中复习试卷【A4版】
(考试时间:90分钟,总分100分)
班级:__________ 姓名:__________ 分数:__________
一、单选题(每小题3分,共计24分)
1、下列四个图像分别对应不同实验过程,其中不正确的是
A. 分别向等质量且足量的Mg片和Zn片中加入等质量、等浓度的稀硫酸
B. 室温下,往等体积水中分别加入等质量的NH4NO3、NaOH,搅拌溶解
C. 煅烧石灰石
D. 往20°C饱和NaCl溶液中加入NaCl固体,充分搅拌
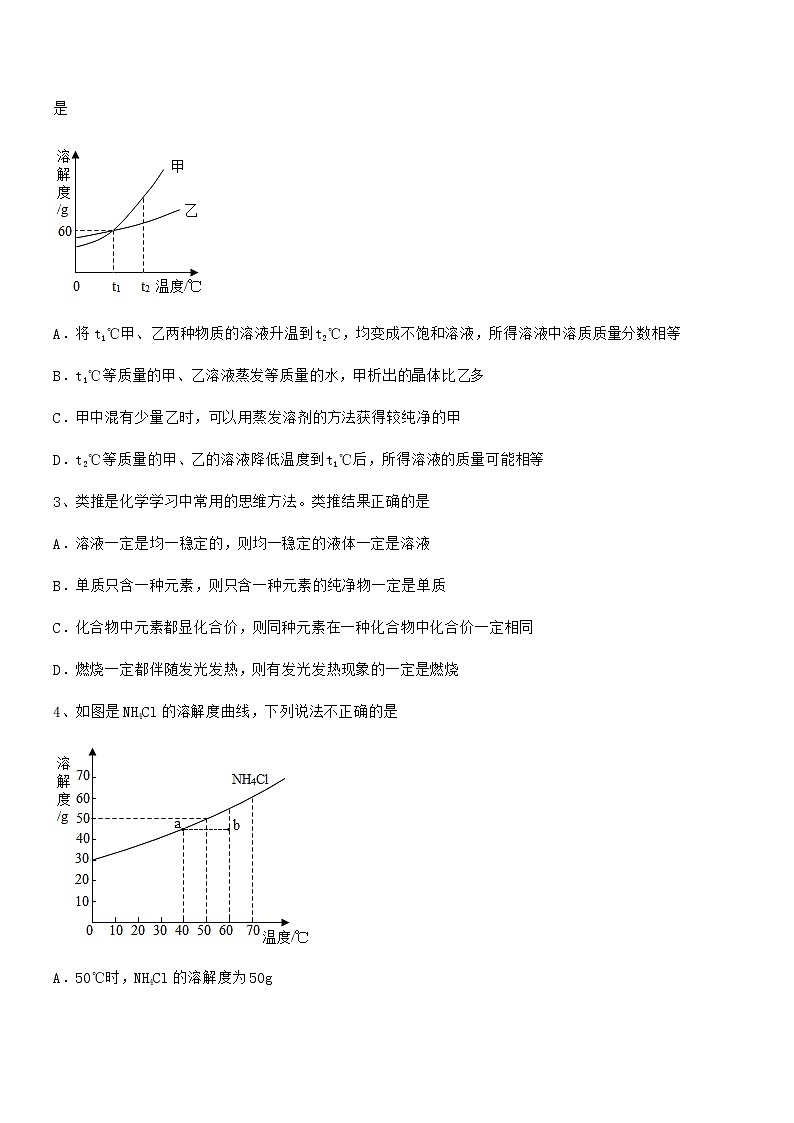
2、下图为甲、乙(均不含结晶水)两种物质的溶解度曲线,根据如图的溶解度曲线,判断下列叙述正确的是
A.将t1℃甲、乙两种物质的溶液升温到t2℃,均变成不饱和溶液,所得溶液中溶质质量分数相等
B.t1℃等质量的甲、乙溶液蒸发等质量的水,甲析出的晶体比乙多
C.甲中混有少量乙时,可以用蒸发溶剂的方法获得较纯净的甲
D.t2℃等质量的甲、乙的溶液降低温度到t1℃后,所得溶液的质量可能相等
3、类推是化学学习中常用的思维方法。类推结果正确的是
A.溶液一定是均一稳定的,则均一稳定的液体一定是溶液
B.单质只含一种元素,则只含一种元素的纯净物一定是单质
C.化合物中元素都显化合价,则同种元素在一种化合物中化合价一定相同
D.燃烧一定都伴随发光发热,则有发光发热现象的一定是燃烧
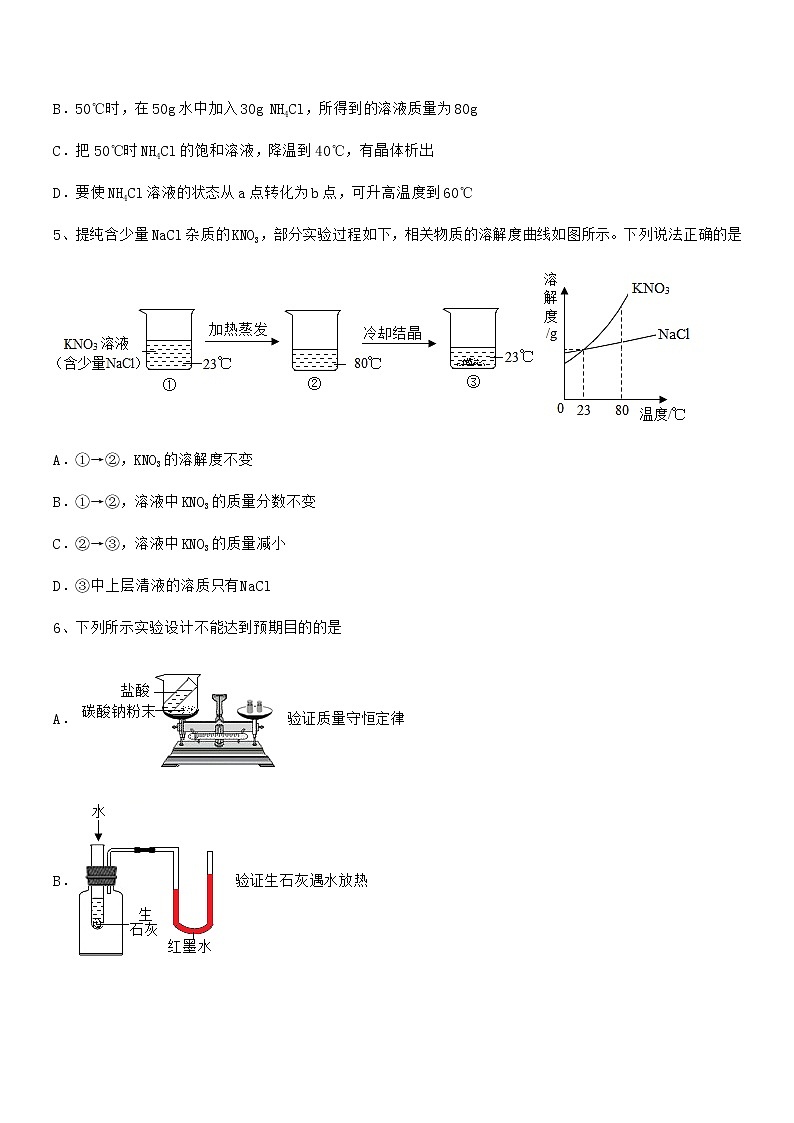
4、如图是NH4Cl的溶解度曲线,下列说法不正确的是
A.50℃时,NH4Cl的溶解度为50g
B.50℃时,在50g水中加入30g NH4Cl,所得到的溶液质量为80g
C.把50℃时NH4Cl的饱和溶液,降温到40℃,有晶体析出
D.要使NH4Cl溶液的状态从a点转化为b点,可升高温度到60℃
5、提纯含少量NaCl杂质的KNO3,部分实验过程如下,相关物质的溶解度曲线如图所示。下列说法正确的是
A.①→②,KNO3的溶解度不变
B.①→②,溶液中KNO3的质量分数不变
C.②→③,溶液中KNO3的质量减小
D.③中上层清液的溶质只有NaCl
6、下列所示实验设计不能达到预期目的的是
A. 验证质量守恒定律
B. 验证生石灰遇水放热
C. 探究二氧化碳能否溶于水
D. 比较黄铜和纯铜的硬度
7、溶液在我们生活中有着广泛的应用,下列物质不属于溶液的是
A.食盐水 B.冰水 C.碘酒 D.白醋
8、如图是甲、乙两种圉体物质在水中的溶解度曲线。下列说法正确的是
A.甲、乙两物质的溶解度相等
B.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多
C.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为90g
D.t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙少
二、填空题(每小题4分,共计20分)
1、下图为自然界中CO2的循环图,图中箭头指向表示产生(排放)或消耗CO2的途径,回答下列问题:
(1)途径①需要消耗空气中的__________。
(2)途径⑤中,有些城市的部分汽车改用压缩天然气(主要成分为甲烷)作燃料,其充分燃烧的化学方程式为__________。
(3)途径⑥中发生的主要反应的化学方程式为___________。
(4)若海水温度升高一点,释放到大气中的CO2的量是巨大的,其主要原因是__________。
(5)为达成“2030年前实现碳达峰”的目标,下列措施可行的是 。
A.发展公共交通,提倡绿色出行 B.大力植树造林
C.用新能源电动车逐渐取代传统燃油车 D.禁止使用化石燃料
2、随着水资源的污染越来越严重,水资源的保护和合理利用已受到人们的普遍关注。请参与讨论下列有关问题:
(1)下列能确认水是由氧元素和氢元素组成的实验是___________(填序号)
①水的蒸馏 ②水的蒸发 ③水的电解 ④水的净化
(2)在一些地方,用抽取的地下水洗衣服时,肥皂不易起泡沫且产生浮渣,其可能的原因是该地下水是___________(填“硬水”或“软水”)。
(3)有媒体曝光过,有一辆某品牌大货车,行驶在高速公路上,汽车后轮突然冒出滚滚浓烟并燃烧起来,幸好消防人员及时赶到并用高压水枪喷射货车油箱和轮胎,才得以扑灭。请解释向轮胎喷水能灭火的原因是___________。
(4)水是常用的溶剂。若要配制50g5%的氯化钠溶液,需要进行如下的操作:①计算(需要氯化钠2.5g):②用托盘天平称量2.5g氯化钠;③用___________(填“10mL”或“50mL”)量筒量取___________mL水(水的密度为lg/mL);④将两者置于烧杯中,用玻璃棒搅拌,玻璃棒搅拌的目的是___________。
3、生活与化学密切相关,请用你学到的知识回答:
(1)日前使用的煤、石油、天然气均为___________(填“可再生”或“不可再生”)能源。
(2)石油的综合利用是利用石油中各成分的___________不同,将它们分离,得到不同的产品。
(3)通常所说的煤气中毒是指____________(填化学式)引起的中毒。
(4)为保证安全,凡是可燃性气体,点燃前都要检验气体的________。
(5)煤发电时,将煤块粉碎成煤粉,其目的是_______。
(6)炭雕以活性炭为原料,对甲醛等有害气体有很强的__________作用,能净化室内空气。
(7)洗涤灵能洗去盘子上的油渍,原理是洗涤灵对食用油有____作用,它能增强乳浊液的___性。
4、烧杯中盛放了足够量的某物质的溶液,陆续恒温蒸发10g水。第一次蒸发后,烧杯底部结晶析出3g溶质,第二次蒸发后,烧杯底部沉积了8g溶质,第三次蒸发后,烧杯底部将会沉积_________g溶质,第三次蒸发后,溶液的溶质质量分数是____________。
5、水与溶液在生产生活中有广泛的用途。
(1)如图为A、B两种物质的溶解度曲线如图所示,请根据图回答下列问题:
①甲的溶解度受温度的影响比乙的溶解度受温度影响______(填“大”或“小”);若甲中含有少量的乙,提纯甲应采用的结晶方法是______。
②t2℃时,将60g的甲、乙分别加入到100g水中,充分溶解,能形成的饱和溶液是______物质。
③将t1oC时甲、乙的饱和溶液升温到t2oC,所得溶液的溶质质量分数的关系是甲______(填“﹥”“﹤”“=”)乙。
(2)欲配制50 g溶质质量分数为0.9%的氯化钠溶液,需溶质质量分数为11%的氯化钠溶液的质量为______(列式即可)。
三、计算题(每小题4分,共计36分)
1、 “石头纸”是用沿海水产养殖中大量废弃贝壳制得的。为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量,某同学进行了如下实验。取25.0 g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的质量关系如图所示。
(1)根据图示观察,生成气体的质量是______克。
(2)计算“石头纸”中碳酸钙的质量分数。
(3)此稀盐酸的溶质质量分数?
(4)完全反应后烧杯内溶液的溶质质量分数是多少?(结果精确到0.1%)
2、实验室制取二氧化碳结束后,17中学化学兴趣小组的同学对锥形瓶内剩余的固液混合物(以下简称废液)做了如下实验:
请回答下列问题:
(1)实验中发生反应的化学方程式为___________。
(2)根据已知条件列出求解12.5g大理石中碳酸钙质量(x)的比例式___________。
(3)根据实验可知废液中含有的可溶性物质有___________(填化学式);
(4)所用废液中盐酸的质量分数为___________。
(5)操作A的名称为___________。
(6)下图中可以表示H+变化的是___________(填序号)。
3、从一瓶氯化钾溶液中取出20克溶液,蒸干后得到2.8克的氯化钾固体。则这瓶溶液中溶质的质量分数为多少?(要求写出计算过程)
4、某注射用药液的配制方法如下:
①把1.0g药品溶于水配制成4.0mL溶液a;
②取0.1mL溶液a,加水稀释至1.0mL,得溶液b;
③取0.1mL溶液b,加水稀释至1.0mL,得溶液c;
④取0.2mL溶液c,加水稀释至1.0mL,得溶液d。
由于在整个配制过程中药液很稀,其密度可近似看做lg/cm3。试求:
(1)最终得到的药液(溶液d)中溶质的质量分数;
(2)1.0g该药品可配制溶液d的体积是多少?
5、实验室用34g5%的过氧化氢的水溶液和2g二氧化锰混合制取氧气。完全反应后剩余物质总质量为35.2g。请计算:
(1)参加反应的过氧化氢的质量为___g。
(2)生成氧气的质量是______?(请列式计算)
6、在抗击新型冠状病毒肺炎疫情中,“84消毒液”(含次氯酸钠(NaC1O)和氯化钠)是一种常用的消毒剂。请回答下列问题:
(1)“84消毒液”属于______(填“纯净物”或“混合物”),次氯酸钠中Na、Cl、O三种元素的质量比为______。
(2)在200.0g NaClO质量分数为20.0%的“84消毒液”中, NaClO的质量为______g,该消毒液中+1价C1的质量分数为______%(计算结果精确到0.1%)。
7、为测定一瓶久置过氧化氢溶液的溶质质量分数,实验操作如图1所示,电子天平示数如图2所示。请计算:
(1)完全反应后生成氧气的质量为______。
(2)该过氧化氢溶液中溶质的质量分数。
8、实验室里,某同学称取碳酸钙和氯化钙的混合物固体20g,放入烧杯里,滴加稀盐酸100g,恰好完全反应最后称得烧杯里的剩余溶液质量为115.6g(无晶体)。提示:氯化钙溶于水且不和稀盐酸反应。请回答:
(1)产生二氧化碳的质量为多少?
(2)烧杯里剩余溶液的溶质质量分数为多少?(计算结果保留到小数点后一位)
9、请回答下列问题。
(1)积极应对气候变化,展现大国担当,中国向世界宣布了 2030 年前实现“碳达峰”、2060 年前实现“碳中和”的国家目标。“碳达峰”是指国家整体二氧化碳气体排放量达到峰值。有研究表明,当前全球每年人为向大气排放二氧化碳 420 亿吨,在这些二氧化碳中含碳元素的质量为多少亿吨?(写出计算过程,计算结果精确至 0.1 亿吨)
(2)20℃时,向 3 个盛有 100 克水的烧杯中,分别加入一定质量的氯化钠,并充分溶解。根据下表实验数据,回答:
实验编号 | A | B | C |
加入氯化钠的质量(克) | 20 | 36 | 50 |
溶液质量(克) | 120 | 136 | 136 |
①实验所得 3 杯溶液中,属于不饱和溶液的是_______(填实验编号)。
②求溶液 C 的溶质质量分数_______。(写出计算过程,计算结果精确至 0.1%)。
四、实验探究(每小题5分,共计20分)
1、生活中钢铁腐蚀的基本原理是形成铁-碳原电池,这一原理在人类日常生活中有广泛的应用,比如,铁系脱氧剂和自热暖贴。以生活中糕点中的脱氧剂质量配方(铁粉:活性炭:氯化钠=1:0.15:0.2)为参照,保持铁粉质量固定为5g,在密闭的实验环境中,使用氧气传感器测定铁-碳原电池反应中氧气含量的变化,探究铁-碳原电池反应速率的影响因素。
实验1:探究不同种类的炭粉对反应速率的影响
实验编号 | 铁粉/g | 炭粉/g | 氯化钠/g |
1-1 | 5 | 0.75(活性炭粉) | 1 |
1-2 | 5 | 0.75(石墨粉) | 1 |
实验2:探究不同用量的活性炭粉对反应速率的影响
实验编号 | 铁粉/g | 活性炭粉/g | 氯化钠/g |
2-1 | 5 | 0 | 1 |
2-2 | 5 | 0.75 | 1 |
2-3 | 5 | 1.5 | a |
实验3:探究不同用量的氯化钠对反应速率的影响
实验编号 | 铁粉/g | 活性炭粉/g | 氯化钠/g |
3-1 | 5 | 0.75 | 0 |
3-2 | 5 | 0.75 | 1 |
3-3 | 5 | 0.75 | 2 |
(解释与结论)
(1)钢铁腐蚀是铁、水和________共同作用。
(2)实验1中使用活性炭粉比石墨粉吸氧效果更好,推测其原因是______。
(3)实验2-3中 a =_____ g。
(4)实验3的结论是_______。
(反思与评价)
(5)以下说法正确的是_______。(填序号)
A铁在氯化钠溶液中比在水中腐蚀速率更快
B在铁—碳原电池中,加入活性炭粉是加快反应速率的关键因素之一
C在铁—碳原电池中,活性炭粉和氯化钠的质量越多越好
D这个实验目的之一可以配制出效果更好的脱氧剂
(6)放置一段时间的脱氧剂,检验其是否完全失效的方法是________。
2、物质的溶解—溶液
溶液是一种重要的混合物,在生产生活中有广泛的应用。
(1)如图为KNO3、NaNO2(亚硝酸钠)、NaCl三种物质的溶解度曲线,请根据曲线回答下列问题:
①通过比较溶解度曲线,发现KNO3和NaNO2在溶解度方面的两个共同点是______、______。
②溶质质量分数为25%的氯化钠溶液中溶质、溶剂的质量比是(最简比)______。
③如果KNO3中混有少量的NaCl,提纯KNO3可以采取______方法。
④NaNO2有毒,有咸味,外观和NaC1相似,常会出现误食中毒的事件。区分这两种物质可以采取的方法是______。
(2)新型冠状肺炎防疫期间,人们使用各种消毒剂进行消毒,消毒剂种类很多,其中常用的是84消毒液和医用酒精,它们都是溶液。
①84消毒液是以次氯酸钠(NaC1O)为主要成分的消毒液,有效氯含量为5.5%-6.5%,适用于一般物体表面、医院污染物品的消毒。NaC1O中氯元素的化合价为______。将500g6%的84消毒液稀释成0.5%用于环境消毒,需要加水______g。次氯酸钠(NaC1O)能在空气中的二氧化碳反应,生成次氯酸(HC1O)和一种热稳定性较强的盐,化学方程式是______,次氯酸具有极强的氧化性,起到消毒作用。
②医用酒精是75%的酒精溶液,由淀粉类植物发酵蒸馏制成。下列对医用酒精的认识和使用正确的是(填序号)______。
A75%的酒精溶液中,水是溶质,酒精是溶剂
B防疫期间,医用酒精是紧缺货,家中大量囤积医用酒精备用
C盛放医用酒精的容器必须有可靠的密封,每次取用后,立即将容器上盖封闭
D要避光存放在阴凉通风处,不要放在窗台、空调口、烟灰缸等热源环境周围
E喷洒过程中和喷洒后的1小时内,喷洒场所严禁吸烟、生火
F在室内使用酒精时,需要保证良好的通风
G适当饮用医用酒精,进行体内消毒
3、根据下列实验回答问题:
(1)某化学兴趣小组欲配制49g20%的稀硫酸来进行实验,他们需要用到98%的浓硫酸的质量是 ___ g。
(2)如图A所示,把配制好的溶液装入试剂瓶中,贴上标签,则标签上的空白处应填写的是 ___ 。
(3)图B是稀释浓硫酸的操作,玻璃棒的作用是 ___ 。
(4)图C是验证银(Ag)、铂(Pt)、钯(Pd)三种金属的活动顺序,一段时间后取出,发现只有银戒指表面有明显变化,通过该实验判断,银、铂、钯的金属活动性由强到弱顺序为 ___ ,其中发生反应的基本类型为 ___ 。
4、某小组在学习“二氧化碳实验室制取的研究”课题时,探究了二氧化碳的收集方法。
(查阅资料)
①通常状况下,1体积水约溶解1体积二氧化碳,所得溶液的pH约为5.6,pH越小,二氧化碳在水中溶解越多。
②稀盐酸与石灰石的反应中会挥发出HCl气体,HCl气体溶于水形成盐酸,使溶液的pH变小。
(提出问题)二氧化碳能不能用排水法收集?
(设计实验)
实验一:在通常状况下,测定二氧化碳溶于水所得溶液的pH,判断二氧化碳在水中溶解的体积,如图:
(1)甲装置中反应的化学方程式__________________________。
(2)CO2溶于蒸馏水发生化学反应的方程式是____________________________。
(3)实验时,需先将甲装置中的空气排尽。其操作是打开止水夹K1,关闭止水夹K2并取下甲、乙中间的橡胶管,打开活塞,滴加稀盐酸至空气排尽。检验空气排尽的方法是__________________________________。
(4)关闭K1,连接甲、乙中间的橡胶管,打开K2、K3,待丙装置中收集半瓶气体时,关闭K2、K3,充分振荡丙装置,分别测得丙、丁瓶装置中溶液的pH为5.6和6.6.分析可知,溶解的二氧化碳体积丙装置中_____(填“大于”或“等于”或“小于”)丁装置中。实验中,乙装置的作用是_____________________________________。
(5)CO2气体的溶解度随压强的减小而___________(填“减小”或“增大”或“不变”,下同),随温度降低而____________。
实验二:用二氧化碳数字传感器测得收集的气体中二氧化碳体积分数。
(6)如图是收集的气体中二氧化碳体积分数随时间变化的关系图,从图中能得到哪些信息:①_________________________________________________;
②_________________________________________________。
(结论反思)由实验一、二分析,改进实验装置,二氧化碳_______(填“能”或“否”)用排水法收集。能降低二氧化碳在水中溶解性的措施_____________(写一条即可)。
2022年最新人教版九年级化学下册第九单元溶液期中复习试卷【A4可打印】: 这是一份2022年最新人教版九年级化学下册第九单元溶液期中复习试卷【A4可打印】,共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
2022年最新人教版九年级化学下册第九单元溶液期中复习试卷(A4可打印): 这是一份2022年最新人教版九年级化学下册第九单元溶液期中复习试卷(A4可打印),共16页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
2022年最新人教版九年级化学下册第九单元溶液期中复习试卷(A4版): 这是一份2022年最新人教版九年级化学下册第九单元溶液期中复习试卷(A4版),共15页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。












