



广东专版中考化学总复习第六部分专题复习专题三工艺流程题课件
展开专题三 工艺流程展
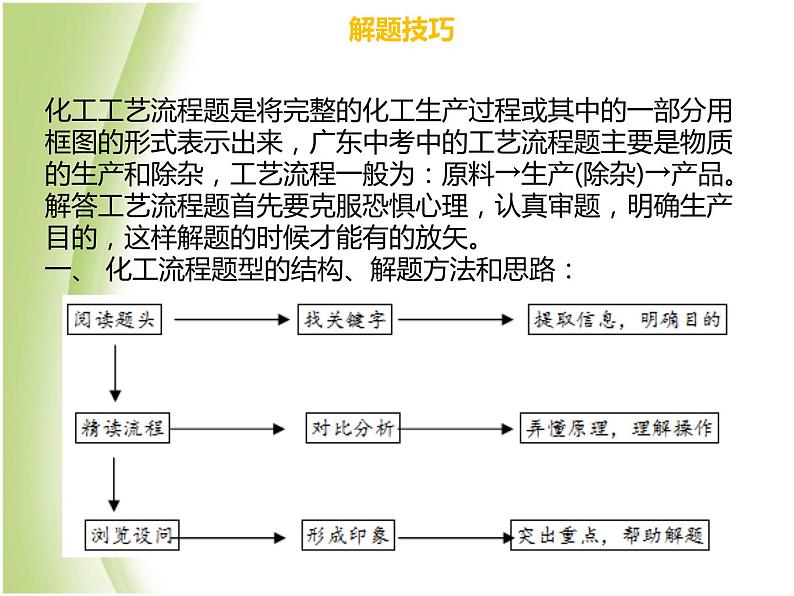
化工工艺流程题是将完整的化工生产过程或其中的一部分用框图的形式表示出来,广东中考中的工艺流程题主要是物质的生产和除杂,工艺流程一般为:原料→生产(除杂)→产品。解答工艺流程题首先要克服恐惧心理,认真审题,明确生产目的,这样解题的时候才能有的放矢。一、 化工流程题型的结构、解题方法和思路:
二、 化工流程主要题型1.从混合物中分离、提纯某物质:实质是考查混合物的除杂、分离、提纯的有关实验基础知识、基本操作和技能。当遇到这一类题时,要求考生一定要认真在流程中找出得到的主要物质是什么,混有的杂质有哪些;认真分析当加入某一试剂后,能与什么物质发生反应,生成了什么产物,要用什么样的方法才能将杂质除去。只有这样才能明白每一步所加试剂或操作的目的。2.用一种物质制备另一种物质:首先从题干中获取要制备的是什么物质,寻找在制备过程中所需的原料,写出主要的化学方程式或制备原理,观察有没有副产物,如果有,则剩余的步骤就是分离和提纯操作了。3.污染物的处理:首先从题干中获取要处理的是什么物质,了解其性质,再根据流程中添加的物质进行分析及推断。
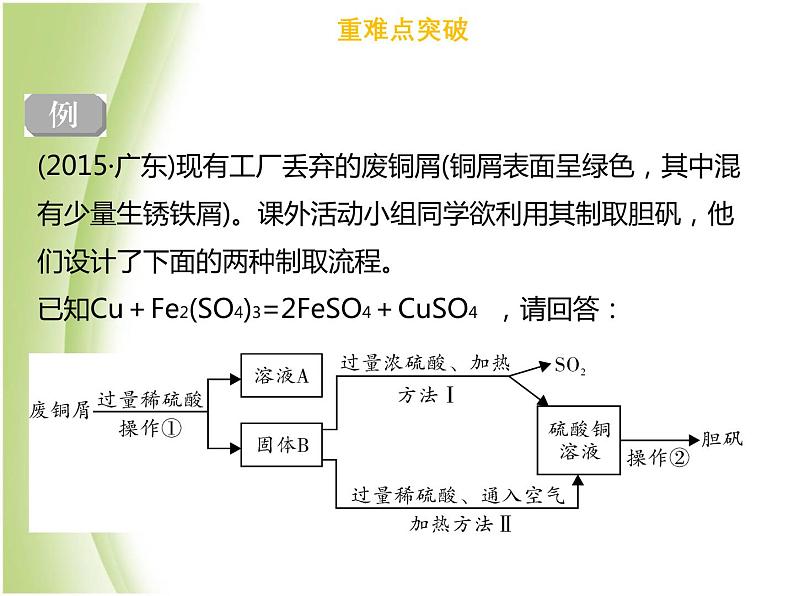
(2015·广东)现有工厂丢弃的废铜屑(铜屑表面呈绿色,其中混有少量生锈铁屑)。课外活动小组同学欲利用其制取胆矾,他们设计了下面的两种制取流程。已知Cu+Fe2(SO4)3=2FeSO4+CuSO4 ,请回答:
(1)铜屑表面呈绿色的物质化学式是Cu2(OH)2CO3,俗称_______,操作①所用到的玻璃仪器有:烧杯、玻璃棒和__________。 (2)溶液A的溶质有__________(只写一种);铁锈与稀硫酸反应的化学方程式为:_______________________________________。 (3)两种方法比较,符合绿色化学要求的是方法____;方法Ⅱ的化学方程式为:2Cu +2H2SO4+______= 2CuSO4 +______,操作 实验步骤为:______,降温结晶。
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
FeSO4或CuSO4或H2SO4
【思路点拔】 (1)碱式碳酸铜的俗称铜绿,过滤中要用到的玻璃仪器:烧杯、漏斗和玻璃棒;(2)铜绿和稀硫酸反应生成硫酸铜和水还有二氧化碳,氧化铁和稀硫酸反应生成硫酸铁和水,硫酸过量;(3)方法Ⅰ中产生二氧化硫,二氧化硫是有毒气体会污染空气;方法Ⅱ通入空气是铜、稀硫酸和氧气反应生成硫酸铜和水,方法Ⅱ环保;冷却饱和溶液得到硫酸铜晶体先浓缩得到饱和溶液再冷却饱和溶液即可。
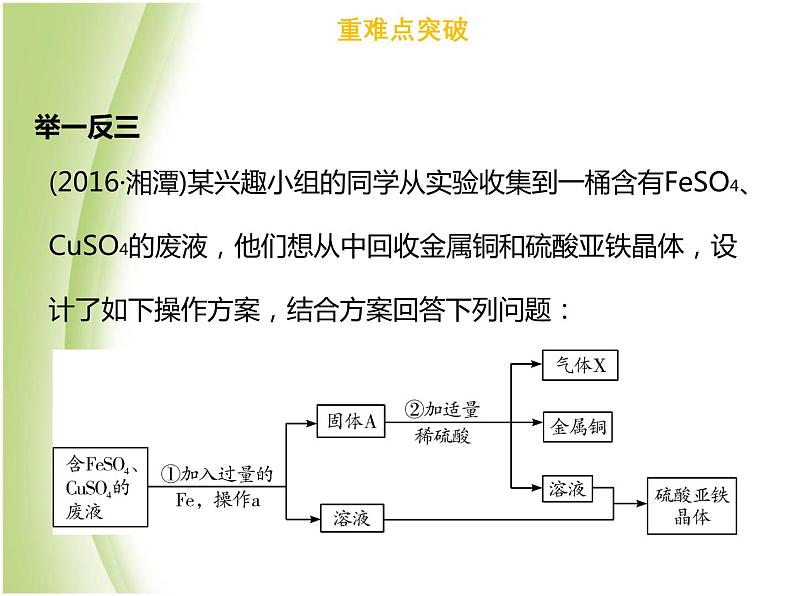
(2016·湘潭)某兴趣小组的同学从实验收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下操作方案,结合方案回答下列问题:
(1)固体A中含有__________和__________,无色气体X为__________(均填化学式)。(2)步骤①中反应的化学方程式为_________________________,该反应属于四种基本类型中的__________反应。(3)操作a的名称为__________,在该操作中用到了玻璃棒其作用为_________。(4)理论上所得硫酸亚铁晶体的质量__________(选填“>”“<”或“=”)原废液中硫酸亚铁的质量。
Fe+CuSO4=FeSO4+Cu
命题点1:1.(2017·玉林)海水“晒盐”得到的粗盐,含有氯化镁、氯化钙、硫酸钠等可溶性杂质,必须对其进行分离和提纯,才能用于工业生产和人们的日常生活。某实验小组设计如下流程除去粗盐中的可溶性杂质,得到氯化钠晶体。请回答下列问题。
(1)步骤Ⅱ加入的物质有:① 过量的碳酸钠溶液、② 过量的氢氧化钠溶液、③ 过量的氯化钡溶液,正确的加入顺序有三种,请你把它写出来(用物质前的序号表示),第一种:__________;第二种:__________;第三种:__________。(2)步骤Ⅳ的实验操作是__________。(3)工业上电解饱和氯化钠溶液可制得烧碱,同时还有氯气和氢气生成。该反应的化学方程式为________________________________。
命题点2:2.空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。下图是以空气和其他必要的原料合成氮肥(NH4NO3)的工业流程。请按要求回答下列问题:
硝酸铵化学式:NH4NO3含氮量:≥30%注意事项:密封储存防潮防晒隔绝热源……
(1)步骤①中发生的是______变化(选填“物理”或“化学”)。(2)写出步骤③中发生反应的化学方程式_________________________________。(3)上述化学反应中属于化合反应的有__________个。(4)右图是化肥硝酸铵包装袋上的部分说明:硝酸铵应具有的性质是__________(选填字母)。A.易溶于水 B.有挥发性 C.受热易分解施用该类肥料时,要避免与碱性物质混合使用,写出硝酸铵与熟石灰反应的化学方程式____________________________________________________。
2NH4NO3+Ca(OH)2=Ca(NO3)2+2H2O+2NH3↑
命题点3:3.(2017·北京) 超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如下:
(1))石灰石主要成分的化学式为______________。(2))乳化池中,生石灰与水发生反应,其化学方程式为___________________________________________。(3))过筛的目的是拦截__________(选填“大于”或“小于”)筛孔直径的颗粒。(4)碳化塔中反应的化学方程式为___________________________________。
CaO+H2O=Ca(OH)2
Ca(OH)2+CO2=CaCO3↓+H2O
命题点4:4.(2017·雅安)钛和钛合金被认为是 21 世纪的重要金属材料, 他们具有很多优良的性能, 如熔点高, 密度小, 可塑性好等。以钛铁矿 (主要成分为 FeTiO3 , 同时含有少量的 Fe2O3 、FeO等) 为原料制 TiO2 , 再由 TiO2 制金属 Ti 的工艺流程如下:
【查阅资料】钛、镁在高温下与空气中的氧气、二氧化碳等反应。(1)写出工艺流程中生成硫酸铁的化学方程式________________________________________该反应的基本类型是_______反应。(2) 操作 2 的名称是______。(3) 工艺流程中, 水解属于______变化。(4)工业上常在高温和氩气氛围中, 用金属镁和 TiCl4 反应的方法制备 Ti, 氩气的作用是__________________________________________。(5)TiO2 可与焦炭、氯气在高温下反应, 该反应中氯气和碳的质量按 71 ∶12 的比例参加反应, 反应的化学方程式为 。
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O(2分)
镁在高温下与空气中的氧气
TiO2+2Cl2+2C=TiCl4+2CO(2分)
5.黄铜矿(主要成分CuFeS2)经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4。某同学通过废铁屑与溶液甲反应,制取补血剂原料碳酸亚铁并回收铜。主要步骤如下图所示:
(1)Fe2(SO4)3与铁反应的化学方程式: x Fe2(SO4)3+ y Fe=z FeSO4,其中x、y、z为化学计量数,z的值为__________。(2)步骤Ⅰ中,生成铜的化学方程式:_________________________________。(3)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是____________________________________________________。(4)步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是____________(填化学式)。(5)步骤Ⅲ回收铜的方法为_____________________________________________________。
Fe+CuSO4=Cu+FeSO4
铁锈与硫酸反应生成硫酸铁,硫酸铁与铁反应生成硫酸亚铁
加入过量的稀硫酸,过滤、洗涤、干燥
命题点5:6.(2016·德州)CO2是造成温室效应的主要气体,而工业上却可用CO2来制备甲醛等物质,“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来并加以利用——如可利用NaOH溶液来“捕捉”CO2,其过程如图所示(部分条件及物质未标出)。
请根据有关信息回答问题:(1)用NaOH溶液“捕捉”CO2的化学方程式是________________________________________________;(2)“反应分离”环节中,分离物质所采用的基本操作是______________;(3)此化学工艺流程中没有涉及到的基本反应类型是______________。
2NaOH+CO2=Na2CO3+H2O
命题点6:7.(2016·泰安)我市著名的纸面石膏板企业,用热电厂燃烧煤产生的炉渣来生产石膏板。原理是:发电过程中产生的烟气中含有大量的SO2,热电厂用“碱—石灰—石膏(CaSO4·2H2O)”的方法使烟气脱硫从而生成石膏。
(1)工业烟气没经处理直接排放到空气中易形成__________,会污染、破坏环境。(2)写出吸收塔内发生反应的化学方程式_______________________________________________________;工业上用分离液态空气法制氧气,是利用空气中各成分的__________不同进行分离的。
SO2+2NaOH=Na2SO3+H2O
(3)化学反应类型有不同的分法,其中反应前后,有元素化合价变化的化学反应是氧化还原反应。有元素化合价升高的反应物是还原剂,有元素化合价降低的反应物是氧化剂。化学反应前后元素化合价没有变化的化学反应是非氧化还原反应。则下列说法正确的是_____。A.吸收塔、制碱塔中发生反应属于氧化还原反应 B.制碱釜中的反应物Na2SO3作氧化剂C.氧化塔中发生的反应属于氧化还原反应 D.氧化塔中的反应物CaSO3作还原剂(4)生产流程中生成的_______________可循环利用,节约成本。
NaOH(或烧碱溶液)
8.(2017·成都)轧制钢材的主要流程如下图:
已知生铁的含碳量为 2%-4.3%钢的含碳量为 0.03%-2%。
(1)反应:①Fe2O3+3CO2 2Fe+3CO,②Fe2O3+C 2Fe+3CO↑。属于置换反应的是____________,用于高炉炼铁的原理是__________。(填序号)(2)炼铁的固体原料需经过粉碎,其目的是_____________________________________。(3)热空气和高炉气体的主要成分有一种相同,这种气体的化学式是______。 炉渣中含有硅酸钙(CaSiO3),其中硅元素的化合价是__________。(4)炼钢炉中,通入纯氧的目的是__________________________________________________。将钢锭轧成钢板,体现了金属的__________性。(5)钢铁制品可能会生锈,写出用稀硫酸除锈反应的化学方程式________________________________________。
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
增大反应接触面积,加快反应速率
使生铁中的碳转化为二氧化碳,降低生铁中碳含量
9.(2017·广东)某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程见下图:
资料1: 垃级焚烧产生的烟气中含有SO2等有害气体。资料2:FeSO4容易被空气中的O2氧化。
回答下列问题:(1)石灰浆吸收SO2(性质与CO2相似)的化学反应方程式为_________________________________。(2)溶解步骤中同时发生的三个化学反应方程式为:Fe+Fe2(SO4)3=3FeSO4、___________________________________、__________________________。(3)将所得FeSO4溶液在氮气环境中蒸发浓缩、__________、过滤,得到FeSO4晶体,其中氮气的作用是________________________________________。(4)政府倡导垃圾分类,其好处是(写一点):____________。
Ca(OH)2+SO2=CaSO3↓+H2O
Fe+H2SO4=FeSO4+H2↑
保护气(防止FeSO4被空气中的O2氧化)
10.(2017·广州)氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl的制备流程如下:
(1)“滤液1”中除了Na+、SO 外,还存在较多的离子是__________、__________(写离子符号)(2)“反应”中发生的化学变化是2CuCl2+Na2SO3=2CuCl↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为_____________________。(3)“操作a”的名称是__________。本流程中可以循环利用的物质(水除外)是__________。(写化学式)(4)可用“水洗”的原因是________________________________________________,“醇洗”的目的是_______________________。(5)160 g CuSO4与足量NaCl经上述制备流程,可生成的CuCl最多是______g。
SO3+H2O=H2SO4
CuCl难溶于水用水洗去可溶性杂质,保留CuCl
快速去除CuCl表面的水分,防止其氧化
11.(2017·苏州)某工厂产生的烧渣(主要含FeO、Fe2O3,还有一定量的SiO2)可用于制备七水合硫酸亚铁晶体(FeSO4 ·7H2O),其工艺流程如下:
查阅资料:SiO2不溶于水,也不与稀硫酸反应。(1)“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式分别为FeO+H2SO4=FeSO4+ H2O 、________________________________________。(2)为提高“浸取”步骤的反应速率,可采取的具体措施有____________________________________________________________(写2条,不考虑“搅拌”和 “使用催化剂”)。(3)“还原”步骤的目的是将Fe3+转化为Fe2+,试剂X可用SO2或Fe。①若试剂X是SO2,转化原理为SO2+Fe2 (SO4)3+2Y=2FeSO4+2H2SO4,则Y的化学式是____________。②若试剂X是Fe,转化原理为Fe+Fe2 (SO4)3=3FeSO4。测得“还原”后溶液的pH明显增大,其原因是______________________________________。
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
将烧渣粉碎(3点中任意2点)
铁消耗过量的硫酸,溶液酸性减弱
12.(2016·威海)氢能源是理想能源,氢能源开发一直是前沿科学研究的课题之一。科学家研发出一种以铝镓合金(镓:Ga)和水为原料制取氢气的新工艺,流程如下图1所示:
(1)从物质分类的角度看,铝镓合金属于__________(选填“混合物”或“纯净物”),用该合金与铝片相互刻划,发现铝片上有划痕,说明__________________________________________________________________________。(2)氢气是一种能源,它在空气中燃烧的化学方程式____________________________。氢气被称为“绿色能源”的主要原因是____________________________________________________。
合金的硬度大(或合金的硬度大于纯金属/成分金属或铝镓合金的硬度比铝大等)
燃烧生成物是水,不污染环境(或产物无污染)
(3)反应①中镓的作用是______________________________,该反应的化学方程式是________________________________,属于四种基本反应类型中的__________。与电解水制取氢气相比,用铝镓合金和水为原料制取氢气的优点是 (答出一点即)__________________________________________________________。(4)镓的原子结构示意图如图2所示,请写出镓与稀盐酸反应的化学方程式_________________________________发生有效相互作用的微粒的转化过程是________________________________________________________________________________________________________________________。
镓原子失去电子变成镓离子,氢离子得到电子变成氢原子,氢原子相互结合生成氢气分子(或2Ga+6H+=2Ga3++3H2)
催化作用(催化或催化剂)
常温下反应,节约能源(或使用了高效催化剂等)
2Ga+6HCl=2GaCl3+3H2↑
广东专版中考化学复习第六部分专题突破专题三推断题课件: 这是一份广东专版中考化学复习第六部分专题突破专题三推断题课件,共60页。PPT课件主要包含了※考情分析,※题型剖析,※考点精练,CaOH2,置换反应,※考点演练,Fe2O3,CuSO4,CuO,复分解反应等内容,欢迎下载使用。
广东专版中考化学复习第六部分专题突破专题二化学工艺流程题课件: 这是一份广东专版中考化学复习第六部分专题突破专题二化学工艺流程题课件,共60页。PPT课件主要包含了※考情分析,※题型剖析,※考点精练,Na2CO3,冷却或降温,NH3,NaCl,CO2,作氮肥,※考点演练等内容,欢迎下载使用。
广东专版中考化学总复习第六部分专题复习专题五探究性实验题课件: 这是一份广东专版中考化学总复习第六部分专题复习专题五探究性实验题课件,共47页。PPT课件主要包含了金牌中考总复习,解题技巧,重难点突破,专题演练等内容,欢迎下载使用。












