
2022届高三化学高考备考一轮复习化学化学反应热计算专项训练
展开一、单选题(15题)
1.已知:CH2=CH2(g)+H2(g)CH3CH3(g)的反应过程中的能量与反应进程关系如图所示。下列说法错误的是
A.该反应的△H<0,不需要加热即可发生该反应
B.上述过程中,CH2=CH2内部碳原子间的双键变为单键
C.途径b使用了催化剂,使催化加氢反应的活化能由E2降为E1
D.CH2=CH2(g)+H2(g)CH3CH3(g),该反应的△H=(E1-E3)kJ·ml-1
2.指定由稳定单质生成lml某种物质的焓变叫做该物质的标准生成焓。例如:C(石墨)+O2(g)=CO2(g)ΔH=-394kJ·ml-1,则1mlCO2(g)的标准生成焓ΔH=-394kJ·ml-1。下列标准生成焓ΔH最大的是
A.lmlSO2(g)B.lmlNO(g)C.2mlH2O(g)D.2mlH2O(l)
3.已知NaHCO3溶液与盐酸反应生成CO2吸热,Na2CO3溶液与盐酸反应生成CO2放热。关于下列ΔH的判断正确的是
CO(aq)+H+(aq)⇌HCO(aq) ΔH1
HCO(aq)+H+(aq)⇌H2CO3(aq) ΔH2
H2CO3(aq)⇌H2O(l)+CO2(g) ΔH3
OH-(aq)+H+(aq)⇌H2O(l) ΔH4
A.ΔH1<0;ΔH2>0B.ΔH2+ΔH3>0
C.ΔH1+ΔH2+ΔH3>0D.ΔH2<ΔH4
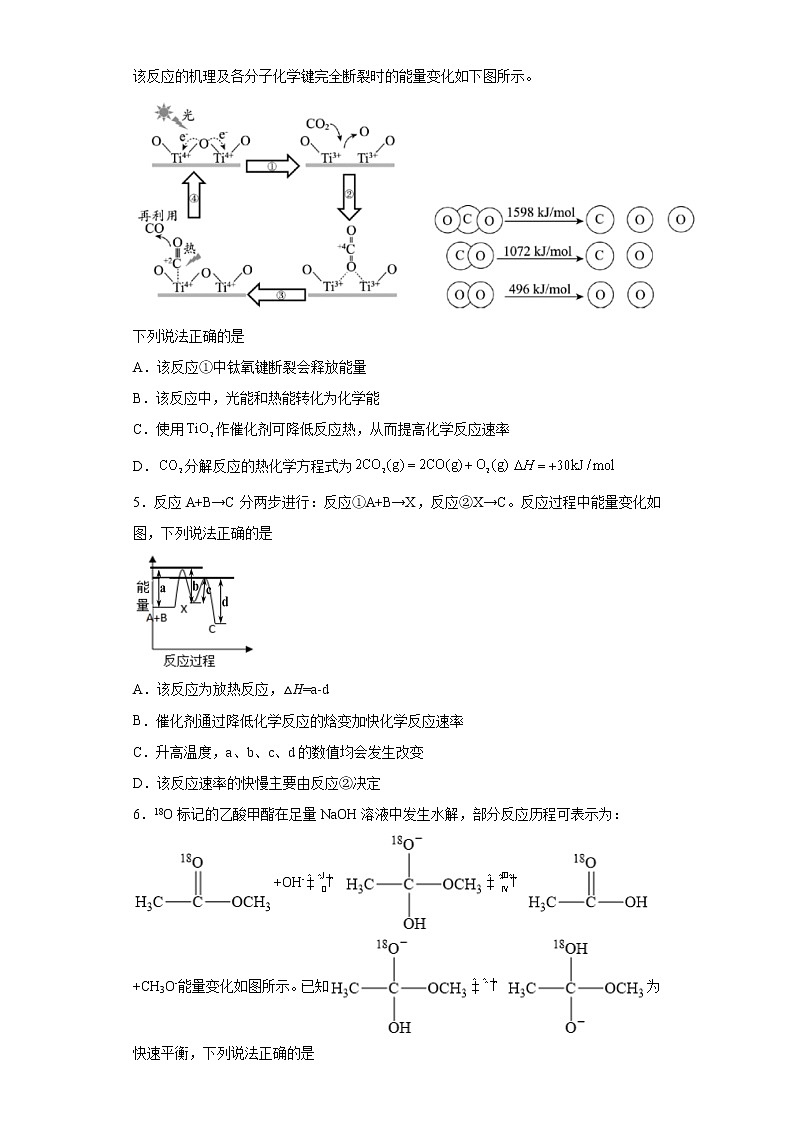
4.以为催化剂的光热化学循环分解反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
下列说法正确的是
A.该反应①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用作催化剂可降低反应热,从而提高化学反应速率
D.分解反应的热化学方程式为
5.反应A+B→C分两步进行:反应①A+B→X,反应②X→C。反应过程中能量变化如图,下列说法正确的是
A.该反应为放热反应,△H=a-d
B.催化剂通过降低化学反应的焓变加快化学反应速率
C.升高温度,a、b、c、d的数值均会发生改变
D.该反应速率的快慢主要由反应②决定
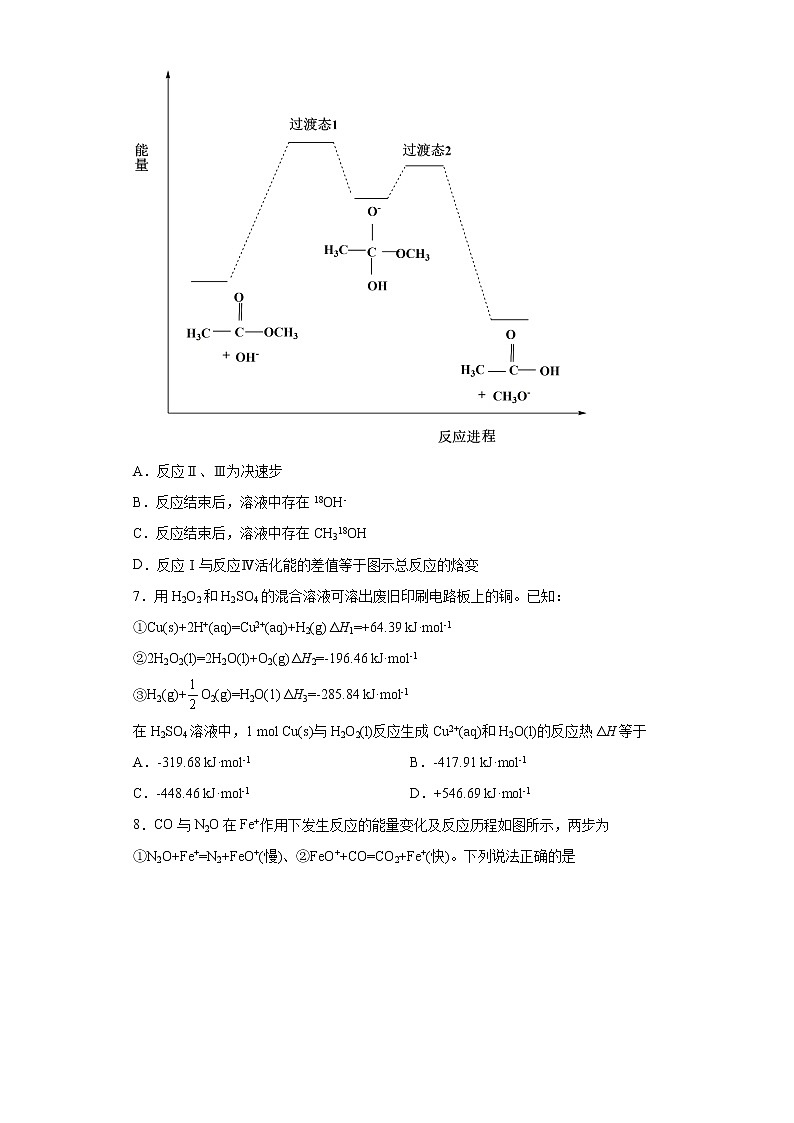
6.18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为:+OH-+CH3O-能量变化如图所示。已知为快速平衡,下列说法正确的是
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在CH318OH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
7.用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH1=+64.39 kJ·ml-1
②2H2O2(l)=2H2O(l)+O2(g) ΔH2=-196.46 kJ·ml-1
③H2(g)+O2(g)=H2O(1) ΔH3=-285.84 kJ·ml-1
在H2SO4溶液中,1 ml Cu(s)与H2O2(l)反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于
A.-319.68 kJ·ml-1B.-417.91 kJ·ml-1
C.-448.46 kJ·ml-1D.+546.69 kJ·ml-1
8.CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步为①N2O+Fe+=N2+FeO+(慢)、②FeO++CO=CO2+Fe+(快)。下列说法正确的是
A.分子构型:CO2为直线型,N2O为V形(已知N2O中每个原子都满足8电子稳定结构)
B.反应①的活化能比反应②大
C.反应中每转移1ml电子,生成N2体积为11.2L
D.两步反应均为放热反应,总反应的化学反应速率由反应②决定
9.工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。化学原理:CH2=CH2(g)+H2O(g)→CH3CH2OH(g) ∆H。已知几种共价键的键能如表所示:
下列说法错误的是
A.上述合成乙醇的反应是加成反应
B.相同时间段内,反应中用三种物质表示的反应速率相等
C.碳碳双键的键能小于碳碳单键键能的2倍
D.上述反应放热96 kJ
10.如图是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图(Ea表示活化能),下列说法错误的是
A.增大Cl2的浓度,可提高反应速率,但不影响ΔH的大小
B.第一步反应的速率小于第二步反应
C.总反应为放热反应
D.升高温度,Ea1、Ea2均增大,反应速率加快
11.Ni可活化C2H6放出CH4,其反应历程如下图所示:
下列关于活化历程的说法错误的是
A.此反应的决速步骤:中间体2→中间体3
B.只涉及极性键的断裂和生成
C.在此反应过程中Ni的成键数目发生变化
D.Ni(s)+C2H6(g)=NiCH2(s)+CH4(g) ∆H=−6.57 kJ·ml-1
12.活泼自由基与氧气反应一直是研究人员关注的焦点。理论研究表明,HNO自由基与O2反应历程的能量变化如图所示。下列说法错误的是
A.产物P2比P1稳定
B.该反应为放热反应
C.相同条件下,由中间产物Z转化为不同产物的速率:v(P1)
13.知某物质的标准生成焓(△f)的定义为用标准状态下的各种元素的最稳定单质,生成标准状态下1ml该物质所吸收或放出的能量,其中△f(单质)=0kJ/mr。N2O、CO、CO2的标准生成焓分别为82.1kJ/ml、110.5kJ/ml、-393.5kJ/ml。研究表明N2O与CO在Fe+的催化下发生反应NO(g)+CO(g)=N2(g)+CO2(g),△H的能量变化及反应历程如图所示,下列说法错误的是
A.△H=-36.1kJ/ml
B.由过程I可得N2O的能量要高于N2的能量
C.催化剂会改变反应途径和降低反应活化能,且反应速率由过程I决定
D.在过程II中同时存在碳氧键的断裂和形成
14.分子中只存在S-F键。已知:1mLS(s)转化为气态硫原子吸收能量280kJ,断裂1mLS-F键需吸收330kJ能量。,则断裂1mLF-F键需要的能量为
A.B.C.D.
15.已知甲酸的分解反应: 。在H+催化作用下反应历程如下:
根据过渡态理论,其反应过程中的能量变化如图所示,E1、E2、E3均为大于0。
下列说法错误的是
A.该反应为放热反应,
B.正反应的最高活化能为E1+E2
C.图像中第一个峰(过渡态)对应的物质结构为过渡态I
D.使用催化剂后,正逆反应速率同等程度改变,平衡不移动
二、原理综合题(4大题)
16.氢气是重要的化工原料,研究氢气的高效利用具有深远的意义。回答下列问题。
Ⅰ.合成氨工业中,H2与N2在铁触媒的作用下反应历程为:
①化学吸附:N2(g)→2N*(*表示吸附态,下同)、H2(g)2H*;
②表面吸附:N*+H*NH*、NH*+H*NH2*、NH2*+H*NH3*。
③脱附:NH3*NH3(g)。其中脱附决定合成氨的整体反应速率。
(1)根据题意,铁触媒在合成氨中的作用为___________。
(2)实际生产中,原料气中H2和N2的物质的量之比为2.8∶1,N2适度过量的理由除了原料易得、可提高H2的转化率外,还有___________。
(3)已知:Ka1(H2SO3)>Kb(NH3·H2O)>Ka2(H2SO3)。工业上用氨水处理硫酸厂尾气中的SO2,恰好生成(NH4)2SO3时,溶液显___________性(填“酸”“中”或“碱”,下同);继续吸收SO2恰好生成NH4HSO3时,溶液显___________性。
Ⅱ.在一定条件下,H2可以用于治理氮氧化物污染。
(4)有关键能如下表,则2H2(g)+2NO(g)N2(g)+2H2O(g)该反应正反应与逆反应活化能之差为___________
(5)向两个容积为2 L的刚性容器中均充入2 ml H2和2 ml NO,分别在220℃和300℃发生反应:2H2(g)+2NO(g)N2(g)+2H2O(g)。测得两容器中H2与H2O的物质的量随时间的变化关系如图所示,曲线Ⅰ平衡后气体的总压强为p1kPa,曲线Ⅱ平衡后气体的总压强为p2kPa。
①220℃条件下的变化曲线为___________(填“Ⅰ”或“Ⅱ”);ad段N2的平均反应速率为___________ml/(L·min)。
②a、c、d三点的逆反应速率由大到小的顺序为___________(用a、c、d表示);曲线Ⅱ代表的温度下,该反应的Kp=___________(Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
17.写出或完成下列热化学方程式。
(1)下列变化过程,属于放热反应的是____。
①浓H2SO4稀释;②酸碱中和反应;③H2在Cl2中燃烧;④Ba(OH)2•8H2O与NH4Cl;⑤铝热反应;⑥碳高温条件下还原CO2。
(2)0.5mlCH4完全燃烧生成CO2和液态水时,放出445kJ的热量。写出CH4燃烧的热化学方程式__。
(3)通常人们把拆开1ml某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
根据键能数据估算下列反应:CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H为___。
(4)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
①Mg(s)+H2(g)=MgH2(s)ΔH1
②Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)ΔH2
求Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH=____。
(5)已知反应:N2(g)+3H2(g)2NH3(g)△H=-92.2kJ/ml,现取1mlN2(g)和3mlH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___92.2kJ(填“大于”“等于”或“小于”),原因是___。
18.二甲醚(CH3OCH3)作为一种重要的化工原料和环保产品,在化工和医药行业中被广泛用作甲基化剂、气雾剂、制冷剂和各种有机合成原料。回答下列问题:
(1)合成气(CO、H2)一步合成二甲醚的反应为:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)ΔH
已知:
①根据上述数据计算ΔH=_____kJ·ml-1;该反应的活化能E正_____E逆(填“>”“=”或“<”)。
②反应物投料比采用n(CO):n(H2)<1:2,则转化率α(CO)_____α(H2)(填“>”“=”或“<”)。
(2)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示。260℃或270℃时,CH3OCH3产率与CO转化率相差较大,合理的解释是_____。图中最高产率对应的温度为290℃,低于290℃时,二甲醚的产率_____ (填“是”或“不是”)对应温度下的平衡产率,判断理由是_____。
(3)二甲醚可以用甲醇脱水直接制备:2CH3OH(g)=CH3OCH3(g)+H2O(g)。某温度下,该反应的Kp=10,在密闭容器中通入一定量的CH3OH,反应到某时刻测得各组分的分压如下:
此时正、逆反应速率的大小:v正_______v逆(填“>”“=”或“<”)。
(4)二甲醚直接燃料电池的工作原理如图所示:
①该电池的负极反应式为_______。
②已知:能量利用率=×100%。现利用该燃料电池电解水制备氢气,若消耗9.200g二甲醚,产生标准状况下的H217.92L,则能量利用率为_______。
19.苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应原理如下:
(g)⇌(g)+H2(g) ∆H
(1)已知:
计算上述反应的∆H=_____。
(2)生产过程中,在600℃时向乙苯中掺入高温水蒸气,保持体系总压为105.6kPa催化反应。若投料比n(乙苯)/n(H2O)=1:8,达平衡时乙苯的转化率为60%,则p(H2O)=____kPa,平衡常数Kp=____(Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数)。若其他条件不变,将上述起始反应物置于某恒容密闭容器中,则乙苯的平衡转化率___(填“>”“<”或“=”)60%。
(3)利用膜反应新技术,可以实现边反应边分离出生成的氢气。不同温度下,1.00ml乙苯在容积为1.00L的密闭容器中反应,氢气移出率α与乙苯平衡转化率关系如图所示:(氢气移出率)
①同温度时α1、α2、α3依次____(填“增大”或“减小”),理由是____。
②A点平衡常数,则α为___。
化学键
C-H
C=C
H-O
C-C
C-O
键能/kJ·ml-1
413
615
463
348
351
化学键
H—H
NO
N2
H—O
键能/(kJ·ml−1)
436
632
946
464
化学键
C—H
C—F
H—F
F—F
键能kJ/ml
414
489
565
155
化学键
H—H
H—O
C—H
C—O
C≡O
E(kJ•ml-1)
436
463
413
343
1076
物质
CH3OCH3
CH3OH
H2O
压强/MPa
0.75
0.25
0.25
化学键
C—H
C—C
C=C
H—H
键能
412
348
612
436
参考答案
1.A
【详解】
A.该反应为放热反应,但不能说放热反应不需要加热,A错误;
B.乙烯变成乙烷是碳碳双键变成单键,B正确;
C.使用催化剂能降低反应的活化能,C正确;
D.催化剂能降低活化能,不影响反应热,故反应热为△H=(E2-E4)kJ·ml-1=(E1-E3)kJ·ml-1 ,D正确;
故选A。
2.B
【详解】
1ml SO2(g)的标准生成焓ΔH=-296.0kJ·ml-1,1mlNO(g)的标准生成焓ΔH=+90.0kJ·ml-1,1ml H2O(g)的标准生成焓ΔH=-241.8kJ·ml-1,1ml H2O(l)的标准生成焓ΔH=-285.8kJ·ml-1。故标准生成焓ΔH最大的是lmlNO(g) 。
故选B。
3.B
【分析】
由题意可知,碳酸氢钠溶液与盐酸反应生成二氧化碳的反应为吸热反应,ΔH′>0,碳酸钠溶液与盐酸反应生成二氧化碳的反应为放热反应,ΔH′′<0,将已知反应依次编号为①②③④,由盖斯定律可知,②+③可得HCO(aq)+H+(aq)⇌H2O(l)+CO2(g)ΔH′=ΔH2+ΔH3>0,①+②+③可得CO(aq)+2H+(aq)⇌H2O(l)+CO2(g)ΔH′′=ΔH1+ΔH2+ΔH3<0,②—④可得碳酸氢根离子的水解反应HCO(aq)+H2O(l)⇌H2CO3(aq)+OH-(aq),盐类水解反应为吸热反应,则ΔH′′′=ΔH2—ΔH4>0。
【详解】
A.由分析可知,ΔH2+ΔH3>0,ΔH1+ΔH2+ΔH3<0,则ΔH1<0;碳酸的分解反应为吸热反应,ΔH3>0,由ΔH2+ΔH3>0可知,ΔH2可能大于0,也可能小于0,故A错误;
B.由分析可知,ΔH2+ΔH3>0,故B正确;
C.由分析可知,ΔH1+ΔH2+ΔH3<0,故C错误;
D.由分析可知,ΔH2—ΔH4>0,则ΔH2>ΔH4,故D错误;
故选B。
4.B
【详解】
A.断键化学键需要吸收能量,则过程①中钛氧键断裂会吸收能量,故A错误;
B.该图中以TiO2为催化剂、光和热条件下分解CO2反应生成CO和氧气,根据能量守恒定律知,该反应中,光能和热能转化为化学能,故B正确;
C.催化剂降低反应所需活化能,不影响反应热,反应热与反应物和生成物总能量的差有关,故C错误;
D.二氧化碳分解生成CO和氧气,且该反应焓变=反应物总能量-生成物总能量,焓变与其方程式计量数成正比,则热化学方程式为2CO2(g)═2CO(g)+O2(g)△H=(1598×2-1072×2-496)kJ/ml=+556 kJ/ml,故D错误;
故选B。
5.C
【详解】
A.根据图示可知:反应物A和B的能量总和比生成物C的高,发生反应放出热量,故该反应为放热反应,△H=(a+c)-(d+b),A错误;
B.催化剂通过改变反应途径,降低反应的活化能来加快化学反应速率,但该反应的焓变不变,B错误;
C.升高温度,物质的内能发生改变,故a、b、c、d的数值均会发生改变,C正确;
D.化学反应速率的快慢由反应速率慢的决定。反应的活化能越大,反应需消耗的能量就越高,反应就越难发生。根据上述图示可知反应①的活化能较大,故该反应速率的快慢主要由反应①决定,D错误;
故合理选项是C。
6.B
【详解】
A.一般来说,反应的活化能越高,反应速率越慢,由图可知,反应I和反应IV的活化能较高,因此反应的决速步为反应I、IV,故A错误;
B.反应I为加成反应,而与为快速平衡,反应II的成键和断键方式为或,后者能生成18OH-,因此反应结束后,溶液中存在18OH-,故B正确;
C.反应III的成键和断键方式为或,因此反应结束后溶液中不会存在CH318H,故C错误;
D.该总反应对应反应物的总能量高于生成物总能量,总反应为放热反应,因此和CH3O-的总能量与和OH-的总能量之差等于图示总反应的焓变,故D错误;
综上所述,正确的是B项,故答案为B。
7.A
【详解】
已知:①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH2=+64.39 kJ·ml-1
②2H2O2(l)=2H2O(l)+O2(g) ΔH2=-196.46 kJ·ml-1
③H2(g)+O2(g)=H2O(1) ΔH=-285.84 kJ·ml-1
根据盖斯定律①+×②+③,整理可得:Cu(s)+H2O2(1)+2H+(aq)=Cu2+(aq)+2H2O(1)△H=-319.68 kJ/ml;
选A。
8.B
【详解】
A.CO2与N2O均为三原子分子,22个电子,互为等电子体,所以均为直线型分子,故A错;
B.反应①N2O+Fe+=N2+FeO+(慢),反应②FeO++CO=CO2+Fe+(快),由图示可知,则反应①活化能较反应②大,故B正确;
C.选项中未告诉是否处于标况下,若标况下,则根据可知,每转移1ml电子,生成N2体积为11.2L,故C错;
D.总反应的化学反应速率由反应较慢一步所决定,即由反应①决定,故D错;
答案选B。
9.D
【详解】
A.乙烯分子中含有不饱和的碳碳双键,在一定条件下断裂碳碳双键中较活泼的碳碳键,两个不饱和C原子分别结合H、-OH,形成水,故乙烯与水变为乙醇的反应是加成反应,A正确;
B.反应混合物中,各物质的化学计量数相同,所以相同时间段内,反应中用三种物质表示的反应速率相等,B正确;
C.由题中数据可知,碳碳双键的键能小于碳碳单键键能的2倍,C正确;
D.上述反应式中,△H=(615 kJ·ml-1)+(413 kJ·ml-1)+(463 kJ·ml-1)-(348 kJ·ml-1)-( 413 kJ·ml-1)-(463 kJ·ml-1)-(351 kJ·ml-1)=-34 kJ·ml-1,D错误;
故合理选项是D。
10.D
【详解】
A.Cl2是该反应的反应物,增大反应物的浓度,反应速率增大,但增大氯气的浓度不影响ΔH的大小,故A正确;
B.第一步反应所需活化能Ea1大于第二步反应所需活化能Ea2,第一步反应单位体积内活化分子百分数低于第二步反应,故第二步反应速率更大,故B正确;
C.反应物总能量大于生成物总能量,为放热反应,故C正确;
D.Ea1、Ea2分别为第一步反应、第二步反应所需活化能,升高温度,反应所需活化能不变,即Ea1、Ea2不变,故D错误;
故选D。
11.B
【详解】
A.中间体2→中间体3能量差值最大,该步反应的活化能最大,是化学反应的决定速率的步骤,A正确;
B.反应过程涉及到C-C键断裂和C-H键形成,涉及到非极性键的断裂和极性键的形成,B错误;
C.根据图示可知:在此反应过程中Ni的成键数目在不断发生变化,C正确;
D.Ni(s)+C2H6(g)=NiCH2(s)+CH4(g) ∆H=E生成物-E反应物=-6.57 kJ/ml-0 kJ/ml=-6.57 kJ/ml,D正确;
故合理选项是B。
12.C
【详解】
A.产物P2比P1的能量低,所以P2更稳定,A项正确;
B.由图得反应物的能量之和比生成物的能量之和高,因此该反应为放热反应,B项正确;
C.由中间产物Z转化到产物P1所需要的活化能低于中间产物Z到P2所需要的活化能, 所以速率 v(P1)>v(P2),C项错误;
D.由图得,中间产物Z到过渡态Ⅳ所需要的活化能最大,则该历程中最大正反应活化能E正=(-18.92kJ/ml)-(-205.11kJ/ml)=186.19kJ/ml,D项正确;
故答案为C。
13.B
【详解】
A.物质的标准生成焓相当于物质的相对焓值大小,所以△H= H(生成物)-H(反应物) =[0+(-393.5)]- [82. 1+(-110.5)] kJ/ml-1=-365.1 kJ/ml-1 ,选项A正确;
B.由化学反应与能量关系图的过程I可知,该反应为放热反应,只能得出Fe+和N2O的总能量高于FeO+和N2的总能量,选项B错误;
C.由图可知,加入催化剂后会改变反应途径,同时也使反应活化能降低,由于第I步活化能大,所以为决定反应速率步骤,选项C正确;
D.在过程II中,CO中化学键断开,形成CO2时又要形成化学键,选项D正确。
答案选B。
14.B
【分析】
依据化学方程式结合物质结构分析,反应热△H=反应物断裂化学键吸收的能量-生成物形成化学键放出能量。
【详解】
反应热△H=反应物总键能-生成物总键能,设断裂1mlF-F键需吸收的能量为x,热化学方程式为S(s)+3F2(g)═SF6(g)△H=-1220kJ/ml,则反应热△H=280KJ/ml+3×xKJ/ml-6x330kJ/ml=-1220kJ/ml,x=160kJ/ml,即断裂1mlF-F键需吸收的能量为160kJ,故选B。
15.B
【分析】
本题考查了化学反应过程中的能量变化情况和催化剂对化学平衡的影响,可依据图像信息解答,特别注意吸热反应、放热反应焓变的符号问题。
【详解】
A.从图像可看出,反应物的总能量大于生成物的总能量,该反应为放热反应,,A正确;
B.从图像可看出,E2为正反应的最高活化能,B错误;
C.从图像可看出,图像中第一个峰(过渡态)对应的物质结构为过渡态I,C正确;
D.使用催化剂后,正逆反应速率同等程度改变,平衡不移动,D正确;
故选B。
16.
(1)催化剂
(2)氮气适度过量,容器内氮气浓度增加,化学反应速率加快
(3) 碱 酸
(4)-666 kJ/ml
(5) I 0.0125 c>d>a
【解析】
(1)
根据题意,铁触媒在合成氨中的作用为催化剂,起催化作用;
(2)
n(H2):n(N2)=2.8:1,比反应方程式中N2(g)+3H2(g)2NH3(g) n(H2):n(N2)=3:1小,说明N2稍微过量,氮气适度过量,除了由于N2这种原料易得、可提高H2的转化率外,还有可以使容器内氮气浓度增加,因此化学反应速率加快;
(3)
铵根离子水解呈酸性,其水解常数Kh1=;亚硫酸根水解使溶液呈碱性,水解常数Kh2=,由于Kb>Ka2,所以Kh1<Kh2,故恰好生成(NH4)2SO3时,溶液显呈碱性;继续吸收SO2恰好生成NH4HSO3时,的电离常数是Ka2,其水解常数是Kh3=,由于NaHSO3溶液呈酸性,说明的电离程度>的水解程度,而铵根离子水解使溶液呈酸性,故NH4HSO3溶液是酸性;
(4)
此反应的△H=反应物断键所需能量-生成物成键放出能量=2×436 kJ/ml+2×632 kJ/ml -(946 kJ/ml +4×464 kJ/ml)=-666 kJ/ml,说明正反应与逆反应活化能之差为-666 kJ/ml;
(5)
①根据先拐先平,可判断出II的反应速率更快,因此反应II的温度更高,所以反应220℃条件下的变化曲线为I,也可以通过比较两种温度的转化率也可得出该结论。ad段的H2反应速率为v(H2)==0.025 ml/(L·min),根据方程式可知用N2表示的化学反应速率是用H2表示反应速率的一半,则v(N2)=v(H2)=0.0125 ml/(L·min);
②c、d均达到平衡,温度越高,反应速率越大,则逆反应速率:c>d,而曲线I中,a点未达到平衡,其正反应速率>逆反应速率,则a点逆反应速率<d点逆反应速率,故a、c、d三点的逆反应速率由大到小的顺序为:c>d>a;
对于可逆反应:2H2(g)+2NO(g)N2(g)+2H2O(g),反应开始时n(H2)=2 ml,n(NO)=2 ml,反应达到平衡时n(H2)=1 ml,n(NO)=1 ml,则根据物质反应转化关系可知平衡时n(N2)=0.5 ml,n(H2O)=1 ml,则平衡时气体总物质的量n(总)=3.5 ml,则P(H2)=P(NO)=P(H2O)=;P(N2)=,则该反应的化学平衡常数Kp===。
17.
(1)②③⑤
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/ml
(3)-1940kJ/ml
(4)ΔH=2ΔH1+ΔH2
(5) 小于 由于该反应是可逆反应,反应物无法全部转化为生成物
【分析】
(1)
当反应物总能量高于生成物总能量时,反应为放热反应,常见的放热反应有:所有的燃烧及缓慢氧化、酸碱中和反应、活泼金属与水或酸的反应、大多数化合反应以及铝热反应等,故下列变化过程,属于放热反应的是②③⑤,①浓H2SO4稀释虽然放热,但是物理变化,④⑥均为吸热反应,故答案为:②③⑤;
(2)
根据热化学方程式的书写原则和反应热与反应物的物质的量成正比,故0.5mlCH4完全燃烧生成CO2和液态水时,放出445kJ的热量,则CH4燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/ml,故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/ml;
(3)
根据反应热的计算,△H等于反应物的总的键能之和减去生成物的总的键能之和,故CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H=4E(C-H)+4E(F-F)-4E(C-F)-4E(H-F)=4×414kJ/ml+4×155kJ/ml-4×489kJ/ml-4×565kJ/ml=-1940kJ/ml,故答案为:-1940kJ/ml;
(4)
根据盖斯定律可知,目标反应Mg2Ni(s)+2H2(g)=Mg2NiH4(s)可由2①+②,故目标反应的焓变ΔH=2ΔH1+ΔH2,故答案为:2ΔH1+ΔH2;
(5)
由于N2与H2反应为可逆反应,故1mlN2(g)和3mlH2(g)放在一密闭容器中,在催化剂存在时进行反应,N2与H2均不能完全转化,即参加反应的N2小于1ml,故测得反应放出的热量小于92.2kJ,故答案为:小于;由于该反应是可逆反应,反应物无法全部转化为生成物;
18.-194 < > CO转化为其它产物 不是 正反应为放热反应,二甲醚的平衡产率应随温度降低而增大 > CH3OCH3-12e-+3H2O=2CO2+12H+ 66.67%(或)
【详解】
(1)①合成气(CO、H2)一步合成二甲醚的反应为:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH=反应物总键能-生成物总键能=(2343+4436-2343-2463-6413) kJ•ml-1=-194 kJ•ml-1,该反应是放热反应,活化能E正
(2)CO与H2反应过程中有副产物生成,CO转化为其它产物,消耗了CO但没有生成CH3OCH3,导致CH3OCH3产率与CO转化率相差较大;图中最高产率对应的温度为290℃,该正反应为放热反应,二甲醚的平衡产率应随温度减小而增大,低于290℃时,其转化率小于290℃时的转化率,说明该温度下的平衡产率不是平衡状态的产率,故答案为:CO转化为其它产物;正反应为放热反应,二甲醚的平衡产率应随温度降低而增大;
(3)由表格数据计算Qp==3
(4)①原电池中负极失去电子,发生氧化反应。则该电池负极是二甲醚发生氧化反应,则电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+,故答案为:CH3OCH3-12e-+3H2O=2CO2+12H+;
②9.200g二甲醚的物质的量为=0.2ml,准状况下17.92L H2的物质的量为=0.8ml,0.2ml二甲醚转移的电子为0.2ml12=2.4ml,0.8ml H2转移电子为0.8ml2=1.6ml,能量利用率为=66.67%(或),故答案为:66.67%(或)。
19.124 < 增大 相同温度条件下,氢气的移除率越大平衡正向进行的程度越大,乙苯的转化率越大 94.4%
【详解】
(1)根据反应热等于反应物的键能和减生成物的键能和计算,结合反应可知反应前后苯环结构未发生改变,反应物中断裂5条C-H和1条C-C,产物中生成三条C-H键和一条C=C,同时生成1条H-H键,则反应热∆H=5×412+348-3×412-612-436=124,故答案为:124;
(2)投料比n(乙苯)/n(H2O)=1:8,设起始时乙苯为1ml,水为8ml,乙苯的转化率为60%,则其转化量为0.6ml,生成的苯乙烯为0.6ml生成的H2为0.6ml,平衡后水的物质的量为8ml,总气体的物质的量为:0.4+0.6+0.6+8=9.6ml,则p(H2O)=,同理可得p(H2)=,p(乙苯)=,p(苯乙烯)=,则Kp== ;恒压改为恒容,相当于在恒压基础上压缩容器体积,压缩体积平衡向逆向移动,乙苯的转化率降低,小于60%,故答案为:;;<;
(3)1.00ml乙苯在容积为1.00L的密闭容器中反应,乙苯的起始浓度为1ml/L,A点时乙苯的转化率为90%,则生成的苯乙烯的浓度为0.9ml/L,生成的氢气的起始浓度为0.9ml/L,平衡时乙苯的浓度为0.1ml/L,设氢气的移出率为x,则剩余的氢气浓度为0.9(1-x)ml/L,平衡常数Kc=,解得x=94.4%,故答案为:94.4%。
2023-2024届高三化学高考备考一轮复习化学平衡计算专项训练: 这是一份2023-2024届高三化学高考备考一轮复习化学平衡计算专项训练,共24页。试卷主要包含了单选题,原理综合题等内容,欢迎下载使用。
2024届新高考化学第一轮专项训练复习——化学反应热的计算(含解析): 这是一份2024届新高考化学第一轮专项训练复习——化学反应热的计算(含解析),共18页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。
2024届新高考化学第一轮专项训练复习——化学反应热的计算(含答案): 这是一份2024届新高考化学第一轮专项训练复习——化学反应热的计算(含答案),共18页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。













