



2022高考化学人教版一轮复习课件:第十单元 第2节 物质的分离、提纯和检验
展开知识梳理1.物质分离、提纯的区别(1)物质的分离。将混合物中的各组分分离开来,获得几种纯净物的过程。(2)物质的提纯。将混合物中的杂质除去而得到纯净物的过程,又叫混合物的净化或除杂。
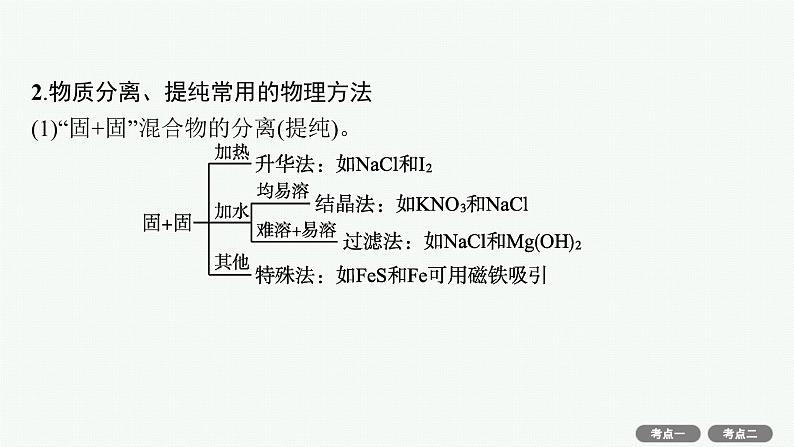
2.物质分离、提纯常用的物理方法(1)“固+固”混合物的分离(提纯)。
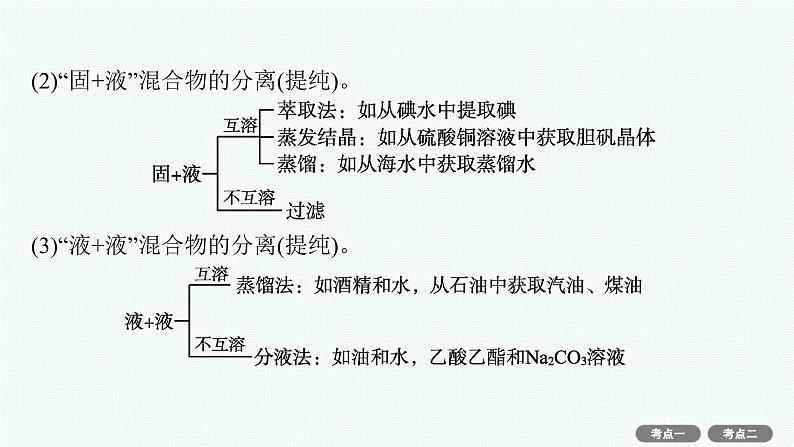
(2)“固+液”混合物的分离(提纯)。
(3)“液+液”混合物的分离(提纯)。
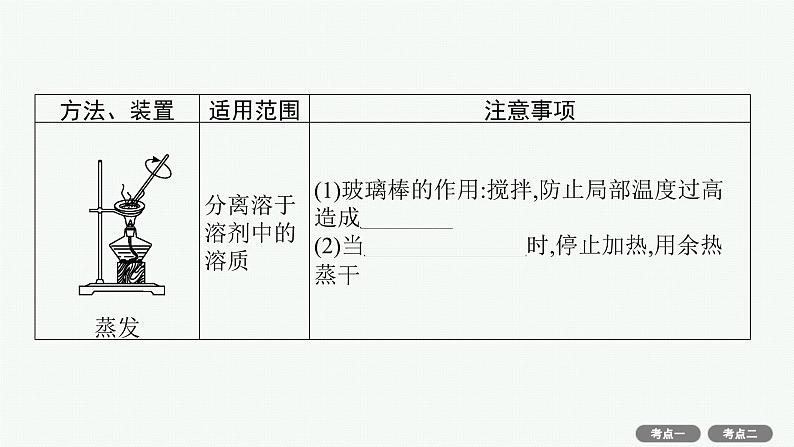
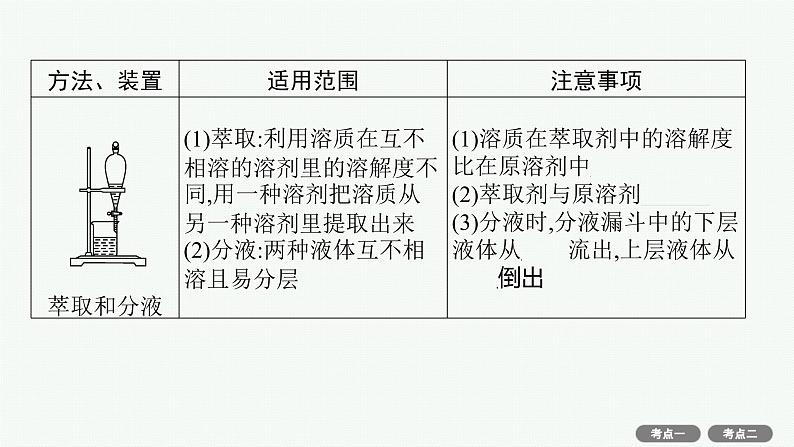
(4)物质分离、提纯常用物理方法的装置及注意事项。
3.物质分离、提纯的化学方法
微点拨提纯的“四个原则”及“四个必须”(1)“四个原则”:一是不增加新的杂质;二是不减少被提纯物质;三是被提纯物质与杂质易分离;四是被提纯物质易复原。(2)“四个必须”:一是除杂试剂必须过量;二是过量试剂必须除尽;三是除杂途径必须最佳;四是除去多种杂质时必须考虑加入试剂的先后顺序。
自我诊断1.判断正误,正确的打“√”,错误的打“×”。(1)可用分液漏斗分离出乙酸与乙醇反应的产物。( ) (2)利用如图操作可分离Na2CO3溶液与CH3COOC2H5。( )
(3)除去KCl中的MnO2:蒸发结晶。( )(4)除去碘中的NaCl:加热、升华。( )(5)除去酸性MgCl2溶液中少量的FeCl3:加入足量的Mg(OH)2并过滤。( )(6)除去NaCl溶液中少量的Na2S:加入AgCl后再过滤。( )(7)除去氯化钠固体中的少量纯碱:加入足量氯化钙溶液,过滤、蒸发、结晶。( )(8)除去石英中的少量碳酸钙:用稀盐酸溶解后过滤。( )
答案 (1)× (2)× (3)× (4)√ (5)√ (6)√(7)× (8)√
2.(1)除去粗盐中的Ca2+、Mg2+、S 杂质离子,应依次加入(写试剂化学式) 。 (2)过滤时所用到的玻璃仪器为 。 (3)蒸发时,能否将母液蒸干后,再停止加热? 。
答案 (1)BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH或NaOH、BaCl2、Na2CO3(2)烧杯、普通漏斗、玻璃棒(3)不能,如果将母液蒸干后再停止加热,蒸发皿的余热会使析出的晶体受热不均而飞溅,造成食盐损失和实验事故
考向1 物质分离、提纯的物理方法【典例1】 (2020山东化学,8)实验室分离Fe3+和Al3+的流程如下:
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( )A.萃取振荡时,分液漏斗下口应倾斜向下B.分液时,应先将下层液体由分液漏斗下口放出C.分液后水相为无色,说明已达到分离目的D.蒸馏时选用直形冷凝管
答案 A 解析 A项,萃取振荡时,分液漏斗上口向下倾斜,故A项错误;分液时,下层液体从下口放出,上层液体从上口倒出,B项正确;根据题意,Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,分液后,水相为无色,说明Al3+与[FeCl4]-已完全分离,C项正确。
对点演练1(2020福建福州质检)氯气氧化HBr提取溴的新工艺反应之一为:6H2SO4+5BaBr2+Ba(BrO3)2==6BaSO4↓+6Br2+6H2O,利用此反应和CCl4得到液溴的实验中不需要用到的实验装置是( )
答案 D 解析 萃取后得到Br2的CCl4溶液,分离出Br2时应选择蒸馏操作,故A正确;反应后的液体混合物除BaSO4沉淀时,应选择过滤操作,故B正确;萃取过滤后的混合液中的Br2,应选择加入CCl4,然后再进行分液操作,故C正确;坩埚主要用于灼烧固体及溶液的蒸发、浓缩或结晶,本实验不涉及此操作,故D错误。
考向2 物质分离和提纯的化学方法【典例2】 (2020山东化学,11改编)下列操作不能达到实验目的的是( )
答案 B 解析 苯酚具有酸性,能够与NaOH溶液反应转化为易溶于水的苯酚钠,苯难溶于水,通过分液可以除去苯中少量的苯酚,A项正确;盐酸是挥发性酸,盐酸与NaHCO3产生的二氧化碳气体中会混有HCl,干扰实验,B项错误;除去碱式滴定管中的气泡,应使尖嘴向上倾斜约45°再挤压玻璃球,C项正确;醛基的检验应使用新制氢氧化铜,且溶液呈碱性,D项正确。
对点演练2(2020海南高考调研测试)下列有关物质(括号内为杂质)的提纯方法正确的是( )A.丙烷(丙烯)——通入酸性高锰酸钾溶液B.苯(苯酚)——加入氢氧化钠,分液C.丙酸乙酯(丙酸)——加入稀硫酸D.甘油(水)——分液
答案 B 解析 丙烯与酸性高锰酸钾溶液发生氧化还原反应生成二氧化碳,会引入新的杂质,A错误;苯不与氢氧化钠溶液反应,且难溶于水,苯酚与氢氧化钠溶液反应生成溶于水的苯酚钠,加入氢氧化钠溶液后分层,用分液的方法可以分离、提纯苯,B正确;丙酸乙酯在稀硫酸作用下,会发生水解反应生成丙酸和乙醇,C错误;甘油和水互溶,不能用分液的方法分离、提纯,D错误。
深度指津 分离、提纯题的答题步骤第一步:确定被提纯物质与除杂对象对比两者物理性质、化学性质的差异,利用差异性(溶解度差异、密度差异、熔沸点差异、与某些物质反应的差异性等),选择合适的分离原理或除杂试剂;除杂试剂除去杂质的同时,不消耗被提纯物质,不引入新的杂质。
第二步:选择合适的分离或除杂装置根据分离原理选择合适的分离装置(过滤、分液、蒸馏等);根据除杂试剂的状态及反应条件,选择合适的装置,液体试剂一般选洗气瓶,固体试剂一般用干燥管或U形管。第三步:综合分析,合理解答综合分析物质分离是否完全,被提纯物质中的杂质是否被除去。
知识梳理1.气体的检验(1)可燃性气体的检验。
(2)酸性气体的检验。
(3)碱性气体的检验(NH3)。
(4)还原性气体的检验。
(5)氧化性气体的检验。
2.常见阳离子检验(1)常规检验法。①用NaOH溶液能检验出Cu2+、Fe3+、Fe2+、Al3+、N 。
②焰色反应:用焰色反应可检验出溶液中的K+和Na+。
[注意]①检验Fe2+和Fe3+时,一般应用特殊检验法。②注意不能利用酸性KMnO4溶液检验FeCl2溶液中的Fe2+,因为KMnO4(H+)会氧化Fe2+也会氧化Cl-。
3.常见阴离子检验(1)利用酸碱指示剂检验。
(2)利用盐酸和其他试剂检验。
(3)利用AgNO3(HNO3酸化)溶液检验。
(4)利用某些特征反应检验。I-→滴入淀粉溶液和新制氯水,溶液变蓝色。[注意]①HC 与C 均会与盐酸反应产生CO2,所以要注意区分。②I-的特征反应检验方法中,氧化剂可以是氯水,也可以是Fe3+或H2O2等物质。
微点拨 物质检验的基本原则和方法物质检验的“三原则”:一看(颜色、状态)、二嗅(气味)、三实验(加试剂)。根据实验时生成物所表现的现象不同,检验离子的方法可归纳为四类:
(3)显现特殊颜色,如Fe3+、苯酚的检验;(4)焰色反应,如Na+、K+的检验。
4.有机化合物的检验
自我诊断1.判断正误,正确的打“√”,错误的打“×”。
(5)某溶液的焰色反应呈黄色,则溶液中一定有钠元素,不能确定是否有钾元素。( )(6)与银氨溶液反应能够产生银镜的物质一定是醛类物质。( )
答案 (1)√ (2)× (3)× (4)× (5)√ (6)×
2.怎样检验溶液中既有Cl-,又有S ?
答案 向试液中先加足量的Ba(NO3)2溶液,生成白色沉淀,过滤后,再向滤液中加入AgNO3溶液,仍有白色沉淀,且白色沉淀不溶于稀硝酸,说明溶液中既有Cl-,又有S 。
考向1 物质的检验【典例1】 (2020安徽“皖南八校”联考)下列实验现象、结论或解释与实验操作相匹配的是( )
答案 C 解析 向溶液中加入了氧化剂后滴加KSCN溶液,溶液变红,说明其中存在铁离子,但无法确定该铁离子是由亚铁离子氧化而来还是原本存在于溶液中的,A错误;二氧化硫的漂白性是由于其可以与部分有色物质化合成为无色物质,不能漂白紫色石蕊溶液,故紫色石蕊溶液变红后不褪色,B错误;向2 mL KI溶液中滴加几滴溴水,振荡,再滴加2滴淀粉溶液,溶液变蓝色,说明Br2的氧化性比I2的强,C正确;该操作有白色沉淀产生,沉淀可能为硫酸钡也可能为氯化银,故无法确定待测液是否一定含有硫酸根离子,D错误。
方法技巧 (1)离子检验中的常见干扰因素以及排除措施。
(2)气体检验中干扰因素的排除。气体检验中干扰因素的排除方法一般是先检验出一种可能会产生干扰的气体,并除去该气体,而且要确认该气体已经除尽,再检验其余气体。如在SO2存在的条件下检验CO2,可设计如下检验思路:品红溶液检验SO2→酸性高锰酸钾溶液除去SO2→品红溶液检验SO2是否除尽→澄清石灰水检验CO2。与此类似的还有检验实验室制取的乙烯中含有SO2等。
对点演练1(2020浙江化学,14)下列说法不正确的是( )A.强酸、强碱、重金属盐等可使蛋白质变性B.新制氢氧化铜(必要时可加热)能鉴别甲酸、乙醇、乙醛C.乙酸乙酯中混有的乙酸,可加入足量的饱和Na2CO3溶液,经分液除去D.向苯和苯酚的混合液中加入浓溴水,充分反应后过滤,可除去苯中少量的苯酚
答案 D 解析 苯酚与浓溴水反应生成三溴苯酚沉淀,但是此沉淀会溶解于苯中,故不可以通过过滤法除去三溴苯酚,D项错误。
考向2 物质的鉴别【典例2】 (2020山东日照一模)某兴趣小组对实验室中的一种白色固体进行鉴别,实验探究如下:①将适量白色固体溶于水,得到无色溶液A,溶液呈碱性;②用铂丝蘸取少量溶液A在火焰上灼烧,产生黄色火焰;③取少量溶液A,加入酸性高锰酸钾溶液,溶液褪色,继续加入氯化钡溶液生成不溶于硝酸的白色沉淀;
④另取少量溶液A,加入硫粉并加热,硫粉溶解生成无色溶液B,且无其他明显现象;继续向溶液B中加入盐酸,产生淡黄色沉淀和有刺激性气味的气体;若向溶液B中加入AgBr沉淀,沉淀溶解。
下列叙述错误的是( )A.由实验可推测该白色固体为Na2SO3B.实验③发生反应的离子方程式可能为
答案 B 解析 由实验现象分析,将适量白色固体溶于水,得到无色溶液A,用铂丝蘸取少量溶液A在火焰上灼烧,产生黄色火焰,则溶液A中含有Na+,另取少量溶液A加入酸性高锰酸钾溶液,溶液褪色,继续加入氯化钡溶液生成不溶于硝酸的白色沉淀,则溶液中含有 ,溶液A为Na2SO3或NaHSO3,因为溶液A呈碱性,所以溶液A只为Na2SO3,向Na2SO3溶液中加入硫粉并加热反应生成Na2S2O3,Na2S2O3在酸性条件下发生歧化反应生成S和SO2,向Na2S2O3溶液中加入AgBr形成配合物[Ag(S2O3)2]3-后沉淀溶解。因此白色固体为Na2SO3。
方法技巧 离子推断解题思路离子推断可以把实验操作、离子反应、离子共存、离子检验、电荷守恒等知识综合起来考查,是综合性较强的题目。其一般解题思路为
根据反应操作及反应现象→判断一定含有的离子→根据能否共存判断一定不含的离子→根据电荷守恒判断还含有的离子→可能含有的离子
必须注意两点:(1)所加试剂引入的离子对后续实验的影响;(2)用电荷守恒判断溶液中还可能含有的离子时要将定性与定量的方法相结合。
对点演练2(2020浙江化学,11)下列有关实验说法不正确的是( )A.萃取Br2时,向盛有溴水的分液漏斗中加入CCl4,振荡、静置分层后,打开旋塞,先将水层放出B.做焰色反应前,铂丝用稀盐酸清洗并灼烧至火焰呈无色C.乙醇、苯等有机溶剂易被引燃,使用时须远离明火,用毕立即塞紧瓶塞D.可用AgNO3溶液和稀硝酸区分NaCl、NaNO2和NaNO3
答案 A 解析 CCl4萃取溴水中的溴,CCl4层在下层,应将CCl4层从下口放出,水层从分液漏斗上口倒出,A项错误。
深度指津 (1)无色溶液中离子检验的答题思路。
(2)固体物质检验的答题思路。
1.物质检验的两大注意(1)选取试剂要最佳。(2)描述现象要规范。2.物质分离和提纯的两大方向(1)分离、提纯方法的选择。(2)分离、提纯实验装置的选择。
人教版高考化学一轮复习第10章化学实验第2讲物质的分离提纯和检验课件: 这是一份人教版高考化学一轮复习第10章化学实验第2讲物质的分离提纯和检验课件
人教版高考化学一轮总复习第11章第2节物质的分离、提纯和检验课时教学课件: 这是一份人教版高考化学一轮总复习第11章第2节物质的分离、提纯和检验课时教学课件,共52页。PPT课件主要包含了环节1课前自主复习,环节2新情境专项练等内容,欢迎下载使用。
人教版高考化学一轮总复习课时质量评价38物质的分离、提纯和检验课件: 这是一份人教版高考化学一轮总复习课时质量评价38物质的分离、提纯和检验课件,共32页。












