



第07章 线粒体和叶绿体课件PPT
展开线粒体和叶绿体的半自主性及其起源
线粒体的基本形态及动态特征
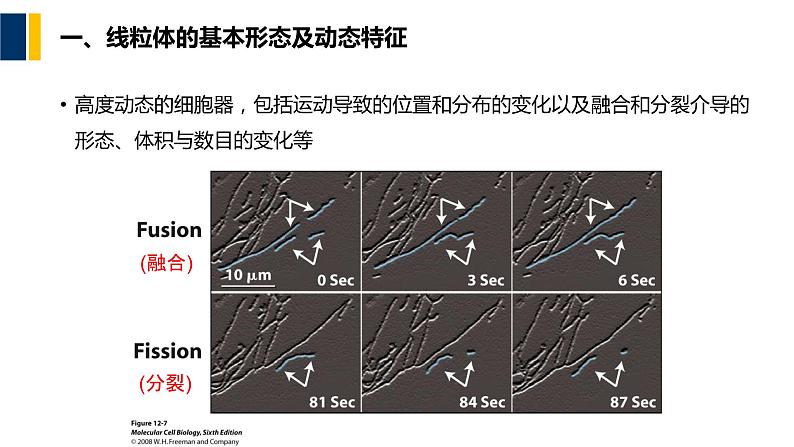
一、线粒体的基本形态及动态特征
高度动态的细胞器,包括运动导致的位置和分布的变化以及融合和分裂介导的形态、体积与数目的变化等
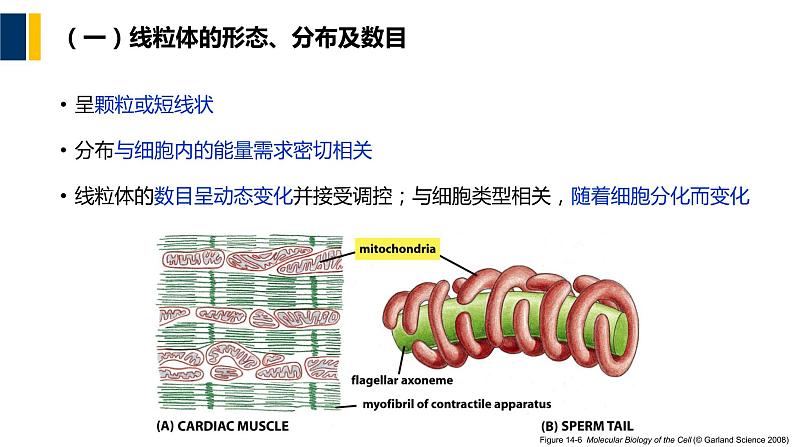
(一)线粒体的形态、分布及数目
呈颗粒或短线状分布与细胞内的能量需求密切相关线粒体的数目呈动态变化并接受调控;与细胞类型相关,随着细胞分化而变化
Figure 14-6 Mlecular Bilgy f the Cell (© Garland Science 2008)
(二)线粒体的融合与分裂
线粒体融合与分裂是线粒体形态调控的基本方式,也是线粒体数目调控的基础
图7-1 线粒体融合与分裂的偶联洋葱表皮细胞内线粒体在约1 min 时间内相继发生融合和分裂的模式图。Arimura 等使用可变色荧光蛋白(Kaide)标记线粒体。红色和绿色的颗粒为不同的线粒体,当它们融合后颜色叠加成为黄色
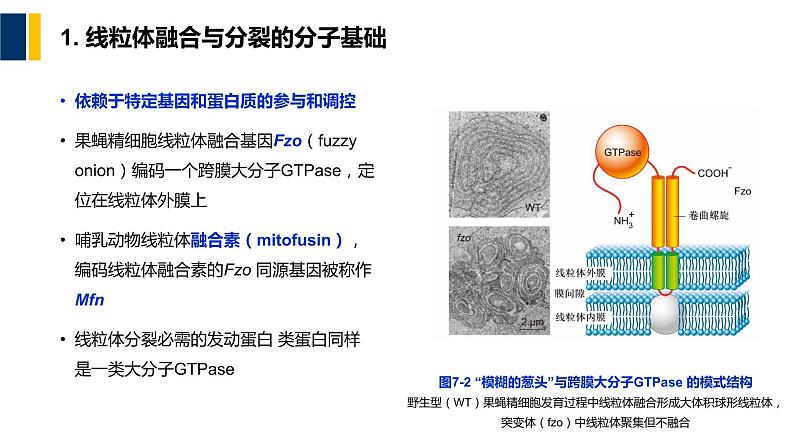
1. 线粒体融合与分裂的分子基础
依赖于特定基因和蛋白质的参与和调控果蝇精细胞线粒体融合基因Fz(fuzzy nin)编码一个跨膜大分子GTPase,定位在线粒体外膜上哺乳动物线粒体融合素(mitfusin),编码线粒体融合素的Fz 同源基因被称作Mfn线粒体分裂必需的发动蛋白 类蛋白同样是一类大分子GTPase
图7-2 “模糊的葱头”与跨膜大分子GTPase 的模式结构野生型(WT)果蝇精细胞发育过程中线粒体融合形成大体积球形线粒体,突变体(fz)中线粒体聚集但不融合
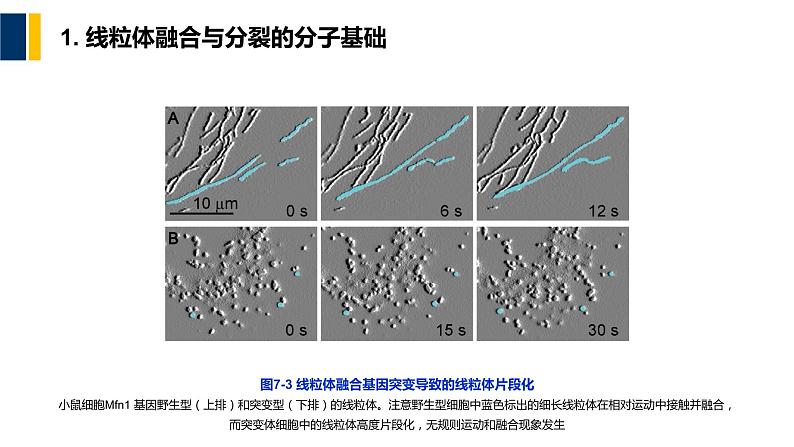
图7-3 线粒体融合基因突变导致的线粒体片段化小鼠细胞Mfn1 基因野生型(上排)和突变型(下排)的线粒体。注意野生型细胞中蓝色标出的细长线粒体在相对运动中接触并融合,而突变体细胞中的线粒体高度片段化,无规则运动和融合现象发生
图7-4 线粒体分裂必需基因(Dnm1、Drp1)的产物定位A. 线虫细胞中Drp1 的活细胞定位(线粒体标记为红色,Drp1标记为绿色)。注意线粒体分裂的位点上出现Drp1。B. 发动蛋白纤维组装及分解驱动线粒体分裂的模式图
2. 线粒体融合与分裂的结构动力基础
线粒体的融合与分裂装置(fusin and divisin apparatus)是参与线粒体融合或分裂的所有蛋白质在细胞内组装而成的功能单位线粒体分裂环(mitchndrial divisin ring):环绕线粒体的蛋白质缢缩结构
图7-5 红藻线粒体和叶绿体的分裂过程及分裂环模式图红藻细胞含一个线粒体和一个叶绿体。在细胞增殖过程中,叶绿体(红色自发荧光)率先启动分裂,随后线粒体启动分裂,最后细胞核分裂。模式图中红色的环状结构示线粒体和叶绿体的分裂环。CP:叶绿体;M:线粒体;N:细胞核
线粒体分裂环(mitchndrial divisin ring)分裂的三个阶段:早期;中期;后期
Nishida K et al. PNAS 2003;100:2146-2151
3. 线粒体融合与分裂的生物学意义
线粒体基质中含有高水平的氧化自由基,容易导致DNA 损伤。线粒体可能通过不断的融合和分裂来平衡这种损伤,以保证部分受损的线粒体可以正常工作线粒体的融合与分裂显然也是线粒体大小、数目及分布调控的基础植物体细胞中的线粒体数目远大于细胞中的线粒体DNA 拷贝数。植物细胞中的线粒体遗传信息在线粒体之间呈现出显著的不均等分布,需要依赖频繁的线粒体融合与分裂实现遗传信息的共享
图7-6 荧光显微镜下观察到的拟南芥叶肉细胞经DAPI 染色后,可以观察到线粒体和叶绿体DNA 的荧光信号。注意多数线粒体(橙色箭头指示)中无DNA 信号。同时染色观察的改构苜蓿银纹夜蛾核型多角体病毒(Autgrapha califrnica multiple nucleplyhedrvirus,AcMNPV)为一种杆状DNA 病毒,每个颗粒含143 kb 的病毒DNA 分子。cp:叶绿体;mt:线粒体(绿色荧光蛋白标记)
融合与分裂:会帮助细胞调整代谢状态?
细胞处于营养缺失状态时,线粒体延伸自身长度,使其产能效率提高以维持ATP产生并保证细胞活力细胞营养过剩时,线粒体分裂变得活跃,导致ATP产量下降,以避免能量浪费
图7-7 人淋巴细胞线粒体(A)、拟南芥幼叶线粒体(B)的超微结构及线粒体超微结构的模式图(C)
httpcrndn.cm/BiTech/Respiratin.html
外膜(uter membrane)通透性很高;孔蛋白;标志酶是单胺氧化酶内膜(inner membrane)不透性;嵴;ATP 合酶;标志酶是细胞色素氧化酶;氧化磷酸化的关键场所膜间隙(intermembrane space)标志酶是腺苷酸激酶线粒体基质(matrix)催化线粒体重要生化反应;标志酶是苹果酸脱氢酶;含DNA、RNA、核糖体及转录、翻译必需重要分子
ATP 合酶(ATP synthase)
图7-8 ATP 合酶的负染电子显微构型(A)及分子结构模式图(B)线粒体内膜在超声波作用下形成亚线粒体小泡,经电子负染后可以观察到其表面排布的线粒体基粒——ATP 合酶(箭头指示)
用超声波破碎线粒体,形成颗粒朝外的小膜泡,称亚线粒体小泡,具有正常的电子传递和磷酸化功能用细胞色素c的抗体能够抑制完整线粒体的氧化磷酸化,但不能抑制亚线粒体颗粒的氧化磷酸化,为什么?
Inside-ut vesicles
线粒体通过氧化磷酸化作用进行能量转换,其内膜上的ATP合酶、电子传递及内膜本身的理化特性为氧化磷酸化提供了必需的保障
内膜的不透性;电子传递链;质子驱动力;ATP合酶
由球形的头部和基部组成,头部朝向线粒体基质头部称为偶联因子1(cupling factr 1,F1),组分为α3 β3γεδ基部称作偶联因子0 (cupling factr 0,F0)。F0 是一个疏水性蛋白复合体,嵌合于线粒体内膜,由a、b、c 3 种亚基按照ab2c10~12 的比例组成跨内膜的质子通道
“转子”(rtr):γ与ε 亚基组成“定子”(statr):a 亚基、b 亚基及F1 的δ 亚基共同组成
L:松弛构象(lse)T:紧密构象(tight)O:开放构象(pen)
图7-9 ATP 合酶的“结合变构”模型L:松弛构象(lse);T:紧密构象(tight);O:开放构象(pen)
ATP合酶的结合变构机制(binding change mechanism)
ATP合成的结合变构机制
The Nbel Prize in Chemistry 1997
"fr their elucidatin f the enzymatic mechanism underlying the synthesis f adensine triphsphate (ATP)"
fr the first discvery f an in-transprting enzyme, Na+, K+ -ATPase".
Japan researcher (Kei University. M.Yshida), Nature 386: 300, 1997.
F 和 γ 旋转的实验证据
Frm Yh Wada et al Bichem. Biphys.Acta 1459:503,2000
膜间隙与基质间质子浓度梯度的形成与保持是线粒体合成ATP 的基本前提线粒体内膜上的电子传递为膜间隙与基质之间的质子梯度提供了保证
Figure 14-14 Mlecular Bilgy f the Cell (© Garland Science 2008)
(二)质子驱动力(prtn mtive frce)
H+ 跨膜电位差质子浓度梯度(pH 差)
电子传递的过程中,内膜上的电子传递复合物将基质中的质子转运至膜间隙,形成ATP 合酶工作所需的质子梯度能量转换实质上是将质子驱动力转换为ATP 分子中的高能磷酸键线粒体中ATP 的形成过程也被称为氧化磷酸化(xidative phsphrylatin)
图7-10 线粒体产能(ATP)的原理示意图
线粒体产能(ATP)原理
Figure 14-16 Mlecular Bilgy f the Cell (© Garland Science 2008)
Rtatin f bacterial flagella by prtn-mtive frce
褐色脂肪组织中线粒体的内膜上有UCP1(uncupling prtein 1),可使质子驱动力转变为热能
【图为一名印度留学生服用二硝基酚减分致死的新闻】
英国女学生死亡前的一些报道描述“2012年9月休斯顿的室友在其卧室发现她死亡,死前她曾感到燥热、呼吸急促”
曾经风靡一时的减肥药——致命的二硝基酚
接受和释放电子的分子或原子被称为电子载体(electrn carrier),由电子载体组成的电子传递序列被称为电子传递链(electrn transprt chain)或呼吸链(respiratry chain)5 种电子载体:黄素蛋白、细 胞色素、泛醌、铁硫蛋白和铜原子呼吸链电子载体按氧化还原电位从低向高排序
电子传递链(electrn transprt chain)呼吸链(respiratry chain)
图7-11 线粒体内膜电子传递复合物的排列及电子和质子传递示意图呼吸链由4 种含有电子载体的复合物和2 种独立存在于膜上的电子载体(UQ 和Cyt c)组成。进入呼吸链的电子来自NADH 或FADH2。电子从复合物Ⅰ或复合物Ⅱ传递给UQ,然后进一步传递给复合物Ⅲ,经由Cyt c 传递给复合物Ⅳ,最后传递给O2,生成H2O。图中指出了H+ 跨膜转移的位点以及各位点上每传递一对电子可能伴随的跨膜H+ 数量
复合物Ⅰ:NADH-CQ 还原酶(NADH 脱氢酶)
复合物Ⅱ:琥珀酸-CQ 还原酶(琥珀酸脱氢酶)
复合物Ⅲ:CQ-Cyt c 还原酶(细胞色素还原酶)
复合物Ⅳ:细胞色素氧化酶(Cyt c 氧化酶)
电子传递与ATP的合成
氧化磷酸化(xidative phsphrylatin)
The Nbel Prize in Chemistry 1978
"fr his cntributin t the understanding f bilgical energy transfer thrugh the frmulatin f the chemismtic thery"
Chemismtic mdel
线粒体病(mitchndrial disease)
Symptms f Mitchndrial Disease
All mitchndria inherited frm yur mther
During fertilizatin mtDNA is derived nly frm the cyte Maternal inheritance: mtDNA mutatins transmitted nly frm mther Mutatins transmitted t all ffspring (male r female)
叶绿体的基本形态及动态特征
一、叶绿体的基本形态及动态特征
Figure 14-36 Mlecular Bilgy f the Cell (© Garland Science 2008)
(一)叶绿体的形态、分布及数目
叶绿体呈凸透镜或铁饼状叶绿体在细胞膜下的分布依光照情况而变化躲避响应(avidance respnse)积聚响应(accumulatin respnse)叶绿体定位(chlrplast psitining)
图7-12 光学显微镜及荧光显微镜下观察到的叶绿体
图7-13 光照强度对叶绿体分布及位置影响的示意图野生型(WT)拟南芥叶片呈深绿色。对叶片的一部分(整体遮光,中部留出一条窄缝)强光照射1 h 后,被照射的窄缝处变成浅绿色。这是由于细胞中的叶绿体发生了位置和分布的变化,以减少强光的伤害。在一种叶绿体定位异常的突变体(chup1)中,光照对叶绿体的位置和分布失去影响。
叶绿体之间的动态连接基质小管( strma-filled tubule,strmule)
图7-14 叶绿体及原质体膜向外延伸形成的柔性管状结构——基质小管该结构具双层膜,分别为叶绿体内膜和外膜的直接延伸。由于叶绿体(或质体)基质随小管延伸,故名基质小管(箭头所指)。A. GFP 标记叶绿体膜后荧光显微镜下观察到的基质小管。B. 三维重构显示的拟南芥卵细胞原质体及复杂的基质小管网络。CP:叶绿体;PP:原质体
叶绿体分化于幼叶的形成和生长阶段在特定情况下,叶绿体的分化是可逆的
图7-15 叶绿体分化及分化异常的表现野生型拟南芥(WT)叶肉细胞中原质体分化为叶绿体, 而花叶突变体(var2)叶片白斑部分的叶肉细胞内质体形成白色体(绿色区域内质体形成正常的叶绿体)。植物的花叶突变体在园艺中常被视为珍稀观叶品种,其变异的分子生物学机制多数不详(“未知”示一种未知变异机制的常春藤花叶突变体)。
(二)叶绿体的分化与去分化
图7-16 电子显微镜下观察到的红藻的叶绿体分裂环
叶绿体的分裂环(chlrplast divisin ring),由外环和内环组成分裂环的缢缩是叶绿体分裂的细胞动力学基础叶绿体分裂装置(chlrplast divisin apparatus,chlrplast divisin machinery)
图7-17 高等植物叶绿体分裂过程中Z 环的免疫荧光(A)及分裂相关蛋白的定位(B)实验结果表明:在叶绿体分裂的早期,内膜下的Z 环最先完成定位和组装。叶绿体内膜跨膜蛋白ARC6 的N 端伸向叶绿体基质,与FtsZ 的相互作用,协助Z 环组装。同时,ARC6 的C 端伸向膜间隙,与外膜跨膜蛋白PDV2 的C 端相结合,将叶绿体膜内的Z 环位置信息传递到膜间隙。在PDV2 的相同位置,还存在另一个C 端较短跨膜蛋白PDV1。这两个蛋白质的N 端均伸向细胞质,共同招募ARC5。PDV1 和PDV2 的编码基因双突变后ARC5 无法正常定位,而它们的单突变亦导致叶绿体分裂异常
图7-18 电子显微镜下观察到叶绿体不同植物或同一植物不同绿色组织中叶绿体的超微结构略有差别。如拟南芥幼叶中的叶绿体(A)边缘较为扁平,基粒类囊体层数较少;而水稻幼芒中的叶绿体(B)边缘相对浑圆,基粒类囊体层数较多等。此外,基粒类囊体的层数还与植物的受光情况相关。S:淀粉粒
叶绿体膜双层单位膜;膜间隙;外膜通透性大,含孔蛋白;内膜则通透性较低,转运蛋白类囊体类囊体腔;基粒;基粒类囊体;基质片层或基质类囊体;类囊体膜化学组成与其他细胞膜有明显差异叶绿体基质主要成分是可溶性蛋白质和其他代谢活跃物质;Rubisc丰度最高
依赖光的反应(light dependent reactin)或称“光反应”(light reactin)在类囊体膜上进行;包括原初反应和电子传递及光合磷酸化两个步骤碳同化反应(carbn assimilatin reactin)或称固碳反应(carbn fixatin reactin)在叶绿体基质中进行;光反应产物(ATP 和NADPH )驱动CO2 还原成糖的分子反应过程
光合色素3 类:叶绿素、类胡萝素和藻胆素光化学反应反应中心色素分子吸收光能而引发的氧化还原反应原初反应将光能转换为电能
图7-19 光合作用原初反应的能量吸收、传递与转换图解Chl 为反应中心色素分子;D 为原初电子供体;A 为原初电子受体
(二)电子传递和光合磷酸化
类囊体膜上的光合磷酸化
1.电子传递(phtsynthetic electrn transfer chain)
光合电子传递链由一系列的电子载体构成包括细胞色素、 黄素蛋白、醌和铁氧还蛋白等;分别组装在膜蛋白复合物,如PSⅠ、PSⅡ及Cyt b6f 中
图7-20 叶绿体中的光系统及电子传递途径
结构:PSⅡ由反应中心复合物和PSⅡ捕光复合物(LHCⅡ)功能:利用光能在类囊体膜腔面一侧裂解水并在基质侧还原质体醌,使类囊体膜的两侧形成质子梯度
图7-21 PS Ⅱ结构示意图
(1)PSⅡ的结构与功能
结构:含有一个Cyt b6、一个Fe-S 和一个Cyt f 功能:将电子从PSⅡ传递到PSⅠ,引起H+ 的跨膜转移
(2)Cytb6f复合物的结构与功能
结构:由反应中心复合物和 PSⅠ捕光复合物(LHCⅠ)组成功能: 利用吸收的光能或传递来的激发能在类囊体膜的基质侧将NADP+ 还原为NADPH
图7-22 PSⅠ的结构示意图
(3)PS I 的结构与功能
2. 光合磷酸化——CF0-CF1 ATP 合酶
2. 光合磷酸化——类型(非循环、循环)
2. 光合磷酸化——作用机制
2. 光合磷酸化——ATP 合成机制
图7-23 叶绿体类囊体膜中进行的电子传递和H+ 跨膜转移P680 分子吸收光子后,激发出的电子传至膜外侧的电子受体PQ;PQ 接受电子,并从基质中摄取2 个质子,还原为PQH2;PQH2 移到膜的内侧,将2 个质子释放到类囊体腔中,而把电子交给Cyt b6f,随后又经位于膜内侧的质体蓝素(PC),把电子传递给P700;P700 分子吸收光子后,放出电子,经铁硫蛋白传给位于膜外侧的铁氧还蛋白(Fd),最后将电子交给NADP+,使之还原成NADPH。在进行电子传递的同时,H+被泵过类囊体膜,在类囊体膜的两侧建立质子梯度
高等植物的碳同化3 条途径:卡尔文循环C4 途径景天酸代谢
羧化阶段 还原阶段 RuBP 再生阶段
图7-24 卡尔文循环的3 个阶段示意图
httpplantphys.inf/plant_physilgy/c4cam.shtml
线粒体和叶绿体的半自主性
一、线粒体和叶绿体的半自主性
(一)线粒体和叶绿体DNA
苔类植物叶绿体基因组的组织.所有高等植物的叶绿体基因组结构都是相似的,尽管大小因物种而异,这取决于编码叶绿体16S和23S核糖体RNA的基因周围有多少DNA以两个拷贝的形式存在。
人类线粒体基因组.人类线粒体基因组≈16600个核苷酸对包含2个rRNA基因、22个tRNA基因和13个蛋白质编码序列。有两个转录启动子,一个用于线粒体DNA(mtDNA)的每条链。许多其他动物线粒体基因组的dna已经完全测序。大多数动物线粒体DNA基因与人类完全相同,从鱼类到哺乳类动物的基因顺序相同。
(二)线粒体和叶绿体中的蛋白质
哺乳动物的线粒体基因组编码2 种rRNA(12 S 和16 S)、22 种tRNA 以及13 种多肽;其中的13 种多肽分别为线粒体复合物Ⅰ(7 个亚基)、复合物Ⅲ(1 个亚基)、复合物Ⅳ(3 个亚基)和F0(2 个亚基)的组成部分叶绿体基因组编码括4 种rRNA(23 S、16 S、4.5 S及5 S)、30 种(烟草) 或31 种(地钱)tRNA 以及100 多种多肽。叶绿体基因编码的多肽涉及光合作用的各个环节,如RuBP 羧化酶的(大亚基)、PSⅠ(2 个亚基)、PSⅡ(8 个亚基)、ATP 合酶(6 个亚基)以及Cyt b6f 复合物(3 个亚基)。此外,叶绿体基因编码的多肽还以70 S 核糖体的组成蛋白等形式参与叶绿体的生命活动。
线粒体与叶绿体蛋白质的转运
(三)线粒体、叶绿体基因组与细胞核的关系
核质互作(nuclear-cytplasmic interactin):细胞核与线粒体、叶绿体之间在遗传信息和基因表达调控等层次上建立的分子协作机制核质冲突(nuclear-cytplasmic incmpatibility,nuclear cytplasmic cnflict)RNA 编辑(RNA editing)
图7-25 拟南芥RNA 编辑障碍导致的核质冲突
二、线粒体和叶绿体的起源
内共生起源学说线粒体和叶绿体分别起源于原始真核细胞内共生的行有氧呼吸的细菌和行光能自养的蓝细菌主要论据基因组与细菌基因组具有明显的相似性 具备独立、完整的蛋白质合成系统 分裂方式与细菌相似 膜的特性 其他佐证
生物必修1《分子与细胞》第五节 光合作用将光能转化为化学能教课ppt课件: 这是一份生物必修1《分子与细胞》第五节 光合作用将光能转化为化学能教课ppt课件,共60页。PPT课件主要包含了必备知识·聚焦概念,NO1,关键能力·突破重难,NO2,课堂检测·巩固素能,NO3等内容,欢迎下载使用。
高中生物人教版 (2019)必修1《分子与细胞》第3章 细胞的基本结构综合与测试教案配套ppt课件: 这是一份高中生物人教版 (2019)必修1《分子与细胞》第3章 细胞的基本结构综合与测试教案配套ppt课件,共14页。PPT课件主要包含了实验基础·自主学习,NO1,叶绿体,实验关键·探究学习,NO2,实验应用·对点练习,NO3等内容,欢迎下载使用。
高中生物人教版 (2019)必修1《分子与细胞》第1节 细胞膜的结构和功能图片课件ppt: 这是一份高中生物人教版 (2019)必修1《分子与细胞》第1节 细胞膜的结构和功能图片课件ppt,共11页。PPT课件主要包含了实验的要求,高倍显微镜的使用,细胞活性等内容,欢迎下载使用。












