
2022届高考化学一轮复习学案:第17讲 原子结构 化学键
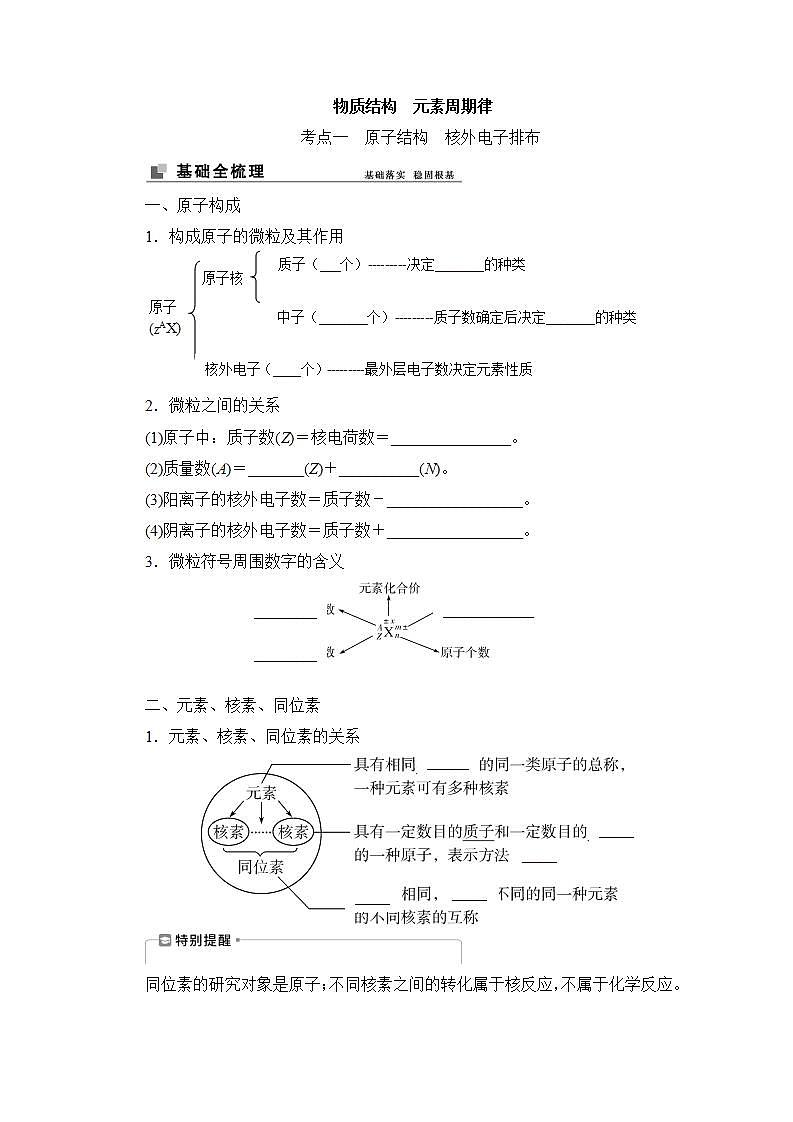
展开一、原子构成
质子(___个)---------决定_______的种类
1.构成原子的微粒及其作用
原子核
中子(_______个)---------质子数确定后决定_______的种类
原子 (ZAX)
核外电子(____个)---------最外层电子数决定元素性质
2.微粒之间的关系
(1)原子中:质子数(Z)=核电荷数=_______________。
(2)质量数(A)=_______(Z)+__________(N)。
(3)阳离子的核外电子数=质子数-_________________。
(4)阴离子的核外电子数=质子数+_________________。
3.微粒符号周围数字的含义
_________
_________
_____________
二、元素、核素、同位素
_________
1.元素、核素、同位素的关系
______
______
______
______
同位素的研究对象是原子;不同核素之间的转化属于核反应,不属于化学反应。
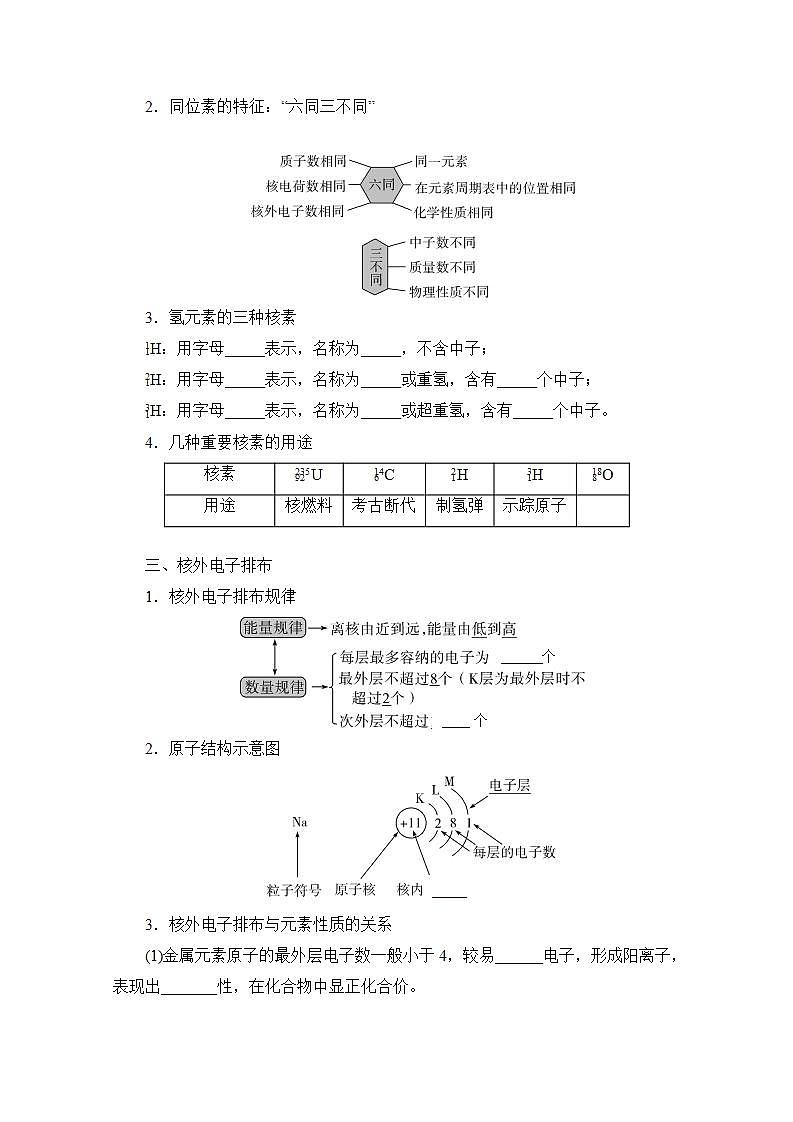
2.同位素的特征:“六同三不同”
3.氢元素的三种核素
eq \\al(1,1)H:用字母_____表示,名称为_____,不含中子;
eq \\al(2,1)H:用字母_____表示,名称为_____或重氢,含有_____个中子;
eq \\al(3,1)H:用字母_____表示,名称为_____或超重氢,含有_____个中子。
4.几种重要核素的用途
三、核外电子排布
1.核外电子排布规律
____个__
______个
2.原子结构示意图
______
3.核外电子排布与元素性质的关系
(1)金属元素原子的最外层电子数一般小于4,较易______电子,形成阳离子,表现出_______性,在化合物中显正化合价。
(2)非金属元素原子的最外层电子数一般大于或等于4,较易_____电子,活泼非金属原子易形成阴离子,表现出_____性,在化合物中主要显负化合价。
(3)稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为0价。
[自主检测]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)(2018·高考全国卷Ⅰ,10B)22.4L(标准状况)氩气含有的质子数为18NA。( )
(2)(2018·高考全国卷Ⅲ,8A)24g镁与27g铝中,含有相同的质子数。( )
(3)(2018·高考海南卷)18g的D2O中含有的质子数为10。( )
(4)(2018·高考全国卷Ⅲ,8C)1ml重水与1ml水中,中子数之比为2∶1。( )
(5)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子。( )
(6)核聚变如eq \\al(2,1)H+eq \\al(3,1)H―→eq \\al(4,2)He+eq \\al(1,0)n,因为有新微粒生成,所以该变化是化学变化。( )
(7)eq \\al(35,17)Cl与eq \\al(37,17)Cl得电子能力几乎相同。( )
(8)一种核素只有一种质量数。( )
(9)硫离子的结构示意图:( )
(10)最外层电子数为8的粒子一定是稀有气体元素原子。( )
(11)核外电子排布相同的微粒化学性质也一定相同。( )
2.下图为几种粒子的结构示意图,完成以下填空。
(1)属于阴离子结构的粒子是________(填编号,下同)。
(2)形成物质种数最多的元素的原子是________。
(3)对应单质常温下能与水发生反应的微粒是________。
(4)某元素R形成的氧化物为R2O3,则R的离子结构示意图可能是________。
3.现有下列9种微粒:eq \\al(1,1)H、eq \\al(2,1)H、eq \\al(13,6)C、eq \\al(14,6)C、eq \\al(14,7)N、eq \\al(56,26)Fe2+、eq \\al(56,26)Fe3+、eq \\al(16,8)O2、eq \\al(16,8)O3。按要求完成以下各题:
(1)eq \\al(1,1)H、eq \\al(2,1)H、eq \\al(3,1)H分别是氢元素的一种________,它们互称为________。
(2)互为同素异形体的微粒是________。
(3)eq \\al(56,26)Fe2+的中子数为________,核外电子数为________。
(4)上述9种微粒中有________种核素,________种元素。
四素”概念的区别和联系:
1~20号元素原子核外电子排布的特点与规律:
(1)原子核中无中子的原子:eq \\al(1,1)H。
(2)最外层只有一个电子的原子:H、Li、Na、K;
最外层有两个电子的原子:He、Be、Mg、Ca。
(3)最外层电子数等于次外层电子数的原子:Be、Ar;
最外层电子数是次外层电子数2倍的原子:C;
最外层电子数是次外层电子数3倍的原子:O。
(4)电子层数与最外层电子数相等的原子:H、Be、Al;
最外层电子数是电子层数2倍的原子:He、C、S;
最外层电子数是电子层数3倍的原子:O。
(5)次外层电子数是最外层电子数2倍的原子:Li、Si。
(6)内层电子总数是最外层电子数2倍的原子:Li、P。
(7)与He原子电子层结构相同的离子有:H-、Li+、Be2+。
(8)次外层电子数是其他各层电子总数2倍的原子:Li、Mg;
(9)次外层电子数与其他各层电子总数相等的元素:Be、S。
7.等电子微粒
(1)10电子微粒。
10电子微粒间的转化。
若A、B、C、D均为10电子微粒,且它们之间存在如图转化:
图中的常见转化一定是NHeq \\al(+,4)+OH-eq \(――→,\s\up7(△))NH3↑+H2O,即A为NHeq \\al(+,4)、B为OH-、C为NH3、D为H2O。
(2)18电子微粒。
8.质子数和核外电子数分别相等的两种微粒关系
(1)可以是两种原子,如同位素原子。
(2)可以是两种分子,如CH4、NH3等。
(3)可以是两种带电荷数相同的阳离子,如NHeq \\al(+,4)、H3O+。
(4)可以是两种带电荷数相同的阴离子,如OH-、F-。
1.下列叙述正确的是( )
A.40K和40Ca原子中的质子数和中子数都相等
B.某元素的原子最外层只有一个电子,则它一定是金属元素
C.任何原子或离子的组成中都含有质子
D.同位素的不同核素的物理、化学性质完全相同
2.重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子
B.1H与D互称同位素
C.H2O与D2O互称同素异形体
D.1Heq \\al(18,2)O与Deq \\al(16,2)O的相对分子质量相同
3.32S与33S互为同位素,下列说法不正确的是( )
A.32S与33S具有相同中子数
B.32S与33S具有相同质子数
C.32S与33S的化学性质相同
D.32S与33S在元素周期表中的位置相同
4.短周期元素甲和乙,甲原子的最外层电子数为a,次外层电子数为b;乙原子的M层电子数为(a-b-1),L层电子数为(a+b)。则甲、乙两元素形成的化合物具有的性质是( )
①与水反应 ②与硫酸反应 ③与氢氧化钠溶液反应 ④与氯气反应
A.①② B.②③
C.②④ D.③④
5.某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子构成HmX分子,在agHmX中所含原子的物质的量为________,所含中子的物质的量为________,所含质子数为________,所含电子数为________。(用NA表示阿伏加德罗常数的值)
6.已知某粒子的结构示意图为。试回答下列问题:
(1)当x-y=10时,该粒子为________(填“原子”“阳离子”或“阴离子”)。
(2)当y=8时,该粒子可能为__________、__________、__________、__________、__________。(填名称)
(3)写出y=3与y=7的元素最高价氧化物对应的水化物之间发生反应的离子方程式:_________________________________________________。
7.①已知:原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。
推断可知:a为_____元素:b为_____元素;c为_____元素;d为_____元素。
②已知:有a、b、c、d四种元素,均为原子序数依次增大的前20号元素。a存在a+和a-两种离子,b和c为同一主族元素,c的次外层有8个电子,c2-和d2+的电子层结构相同。
推断可知:a为_____元素:b为_____元素;c为_____元素;d为_____元素。
考点二 化学键 物质构成
一、化学键
1.化学键的定义及分类
2.化学反应的本质:反应物中_____________与生成物中_______________。
二、离子键与共价键的比较
三、化学键与物质类别
1、只含有共价键的物质
①同种非金属元素原子构成的单质,如I2、N2、P4、金刚石、晶体硅等。
②不同非金属元素原子构成的共价化合物,如HCl、NH3、SiO2、CS2等。
2、只含有离子键的物质
活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CsCl、K2O、NaH等;但AlCl3含共价键。
3、既含有离子键又含有共价键的物质
如Na2O2、NH4Cl、NaOH、Na2SO4等。
4、无化学键的物质
稀有气体分子(单原子分子),如氩气、氦气等。
四、物质的溶解或熔化与化学键变化的关系
1.离子化合物的溶解或熔化过程
离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子,离子键被破坏。
2.共价化合物的溶解过程
(1)有些共价化合物溶于水后,能与水反应,其分子内的共价键被破坏,如CO2和SO2等。
(2)有些共价化合物溶于水后,发生电离,其分子内的共价键被破坏,如HCl、H2SO4等。
(3)有些共价化合物溶于水后,其分子内的化学键不被破坏,如蔗糖(C12H22O11)、酒精(C2H5OH)等。
3.单质的溶解过程
某些活泼的非金属单质溶于水后,能与水反应,其分子内的共价键被破坏,如Cl2、F2等。
五、化学键对物质性质的影响
1.对物理性质的影响
金刚石、晶体硅、石英、金刚砂等物质硬度大、熔点高,就是因为其中的共价键很强,破坏时需消耗很多的能量。NaCl等部分离子化合物,也有很强的离子键,故熔点也较高。
2.对化学性质的影响
N2分子中有很强的共价键,故在通常状况下,N2很稳定;H2S、HI等分子中的共价键较弱,故它们受热时易分解。
六、分子间作用力
(1)定义:把分子聚集在一起的作用力,又称___________。
(2)特点
①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点等物理性质。而化学键主要影响物质的化学性质。
②分子间作用力存在于由共价键形成的多数共价化合物分子和绝大多数气态、液态、固态非金属单质分子之间。但像二氧化硅、金刚石等由共价键形成的物质,微粒之间不存在分子间作用力。
(3)变化规律
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点也越高。例如熔、沸点:I2 > Br2 > Cl2 > F2。
七、氢键
(1)定义:分子间存在的一种比范德华力稍强的相互作用,但比化学键弱。
(2)形成条件:除H外,形成氢键的原子通常是_____________。
(3)存在:H2O、NH3、HF等分子之间。(分子间氢键会使物质的熔点和沸点升高。这是因为固体熔化或液体汽化时必须破坏分子间的氢键,消耗较多能量。)
八、电子式
1.电子式的概念
在元素符号周围,用“·”或“×”来表示原子的最外层电子(价电子)的式子。
2.电子式的书写
九、用电子式表示化合物的形成过程
1.离子化合物
如NaCl:________________________________________。
2.共价化合物
如HCl:_________________________________________。
[自主检测]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)(2018·高考全国卷Ⅱ,11A)常温常压下,124gP4中所含P—P键数目为4NA。( )
(2)(2018·高考全国卷Ⅲ,8D)1ml乙烷和1ml乙烯中,化学键数相同。( )
(3)(2018·高考江苏卷)HCl的电子式:。( )
(4)化学键是相邻离子或原子间的一种强作用力,既包括静电吸引力,又包括静电排斥力。( )
(5)所有物质中都存在化学键。( )
(6)由活泼金属元素与活泼非金属元素形成的化学键都是离子键。( )
(7)原子最外层只有一个电子的元素原子跟卤素原子结合时,所形成的化学键一定是离子键。( )
(8)非金属元素的两个原子之间一定形成共价键,但多个原子间也可能形成离子键。( )
(9)离子化合物中可能含有共价键,共价化合物中一定不含离子键。( )
2.请写出下列微粒的电子式。
(1)原子:Na____________,Cl____________。
(2)简单离子:Na+____________,F-____________。
(3)复杂离子:NHeq \\al(+,4)____________,OH-____________。
(4)离子化合物:MgCl2____________,Na2O____________,Na2O2____________。
(5)非金属单质及共价化合物:N2________________,H2O__________________,H2O2__________________,NH3______________,CCl4______________。
一、选择题
1.下列有关化学用语表示正确的是( )
A.H2O2的电子式为
B.质子数为67、中子数为99的放射性同位素钬(H)原子为eq \\al(166,67)H
C.氯离子的结构示意图为
D.乙醇分子的球棍模型为
2.eq \\al(235,92)U是重要的核工业原料,在自然界的丰度很低。eq \\al(235,92)U的浓缩一直为国际社会关注。下列有关eq \\al(235,92)U的说法正确的是( )
A.eq \\al(235,92)U原子核中含有92个中子
B.eq \\al(235,92)U原子核外有143个电子
C.eq \\al(235,92)U与eq \\al(238,92)U互为同位素
D.eq \\al(235,92)U与eq \\al(238,92)U互为同素异形体
3.下列关于化学键的说法中正确的是( )
A.构成单质分子的粒子一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定是极性键
4.核内中子数为N的R2+,质量数为A,则ngR的氧化物所含电子的物质的量为( )
A.eq \f(n,A+16)(A-N+8) ml B.eq \f(n,A+16)(A-N+10) ml
C.(A-N+2) ml D.eq \f(n,A)(A-N+6) ml
5.下列说法不正确的是( )
①质子数相同的粒子一定是同种元素
②同位素的性质几乎相同
③电子数相同的粒子不一定是同一种元素
④某种元素的相对原子质量取整数,就是其质量数
A.①②③B.①②④
C.②③④D.①③④
6.下列过程中共价键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③乙醇溶于水
④HCl气体溶于水 ⑤冰融化 ⑥NH4Cl受热 ⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水
A.①④⑥⑦B.③④⑥⑧
C.①②④⑤D.④⑥
7.下列物质中含有相同的化学键类型的是( )
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、SO2
C.Na2O2、H2O2、H2O、O3
D.HBr、CO2、H2O、CS2
8.已知A为常见温室气体,B为淡黄色氧化物,C为常见液体,D为黄绿色气体单质,各物质相互反应的关系如图所示,M的水溶液能杀菌消毒。下列有关叙述不正确的是( )
A.A、D中均含有共价键
B.反应②有非极性共价键的破坏与生成
C.N溶于水时断裂离子键
D.M的电子式为
9.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4。W-的最外层为8电子结构。金属单质Z在空气中加热生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A.X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B.原子半径大小:X<Y,Z>W
C.化合物Z2Y和ZWY3中都只存在离子键
D.Y、W的某些单质或两元素之间形成的某些化合物可做水的消毒剂
10.前四周期主族元素a、b、c、d、e原子序数依次增大。已知:a、c同主族,a的原子最外层电子数是次外层的3倍,b的氧化物既能溶于强酸,又能溶于强碱,d的原子半径是第三周期中最小的(稀有气体元素除外),e是形成骨骼和牙齿的主要元素,且e单质能和水反应。下列分析错误的是( )
A.a的离子结构示意图为
B.d与e形成化合物的电子式为
C.d的最高价氧化物对应水化物的酸性强于c的最高价氧化物对应水化物的酸性
D.b的氧化物为离子化合物,只含离子键,其晶体为离子晶体
二、非选择题
11.现有下列10种物质:①O2;②H2;③NH4NO3;④Na2O2;⑤Ba(OH)2;⑥CH4;⑦CO2;⑧NaF;⑨NH3;⑩I2。
其中既含离子键又含非极性键的是________(填序号,下同);既含离子键又含极性键的是________;只含共价键的是____________;只含离子键的是________。
12.原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可形成XH3、H2Z和HW共价化合物;Y与氧元素可形成Y2O和Y2O2两种离子化合物。
(1)Y2O2中含有的化学键是______________________。
(2)用电子式表示Y2O的形成过程:___________________________________。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,酸性最强的是________(填化学式)。
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是________(填化学式)。
13.元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体。据此回答下列问题:
(1)写出Z与N形成的化合物的电子式:_______________________________。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:_____________________________________(分解反应)。
(3)下图表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应的转化关系,请写出该转化过程的化学方程式:_______________________。
(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1∶1∶1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为________,B的化学式为________。
1.(2019·高考全国卷Ⅲ,9,6分)X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是( )
A.熔点:X的氧化物比Y的氧化物高
B.热稳定性:X的氢化物大于Z的氢化物
C.X与Z可形成离子化合物ZX
D.Y的单质与Z的单质均能溶于浓硝酸
2.(2019·高考北京卷)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )
A.In是第五周期第ⅢA族元素
B.eq \\al(115,49)In的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
3.(2019·高考江苏卷)反应NH4Cl+NaNO2===NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )
A.中子数为18的氯原子:eq \\al(18,17)Cl
B.N2的结构式:N===N
C.Na+的结构示意图:
D.H2O的电子式:Heq \\al(·,·)O····eq \\al(·,·)H
4.(2018·高考全国卷Ⅱ,10,6分)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是( )
A.X与其他三种元素均可形成两种或两种以上的二元化合物
B.Y与其他三种元素分别形成的化合物中只含有离子键
C.四种元素的简单离子具有相同的电子层结构
D.W的氧化物对应的水化物均为强酸核素
eq \\al(235,92)U
eq \\al(14,6)C
eq \\al(2,1)H
eq \\al(3,1)H
eq \\al(18,8)O
用途
核燃料
考古断代
制氢弹
示踪原子
离子键
共价键
非极性键
极性键
概念
_________________的相互作用
_______通过____________而形成的相互作用
成键粒子
____________
______
成键实质
阴、阳离子的静电作用
通过共用电子对使各原子
最外层达到稳定结构
成键元素
______元素与_____
_______元素经电子得失,形成离子键
_____元素原子之间
________元素原子之间
形成的物质
离子化合物
非金属单质;某些共价化合物或离子化合物
共价化合物或某些离子化合物
粒子的种类
电子式的表示方法
注意事项
举例
原子
元素符号周围标明价电子
价电子数少于4时以单电子分布,多于4时多出部分以电子对分布
Na:
O:
阳离子
单核
离子符号
右上方标明电荷
Na+:
多核
元素符号紧邻铺开,周围标明电子分布
用“[]”括起来,其右上方标明电荷
NH4+:
阴离子
单核
元素符号周围合理分布价电子及所得电子
将得到的电子也都标在元素符号周围,用“[]”括起来,其右上方标明电荷
Cl:
多核
元素符号紧邻铺开,合理分布价电子及所得电子
相同原子不得加和,用“[]”括起来,其右上方标明电荷
O22-:
单质及化合物
离子
化合
物
由阳离子电子式和阴离子电子式组成
同性不相邻,离子合理分布
MgCl2:
单质
及共
价化
合物
各原子紧邻铺开,标明价电子及成键电子情况
书写时将共用电子对写在两原子之间,每个原子的未成键电子也应标出,相同原子不得加和,无“[ ]”,不标明电荷
N2:
CO2:
鲁科版高考化学一轮复习第5章第24讲原子结构教学课时学案: 这是一份鲁科版高考化学一轮复习第5章第24讲原子结构教学课时学案,共21页。
鲁科版高考化学一轮复习第5章第24讲原子结构教学课时学案: 这是一份鲁科版高考化学一轮复习第5章第24讲原子结构教学课时学案,共21页。
新高考化学一轮复习精品学案 第6章 第32讲 化学键(含解析): 这是一份新高考化学一轮复习精品学案 第6章 第32讲 化学键(含解析),共14页。













