
2021年湖南中考化学真题分类汇编-计算题.doc
展开1.(2021•益阳)为测定实验室某瓶盐酸的溶质质量分数是否与标签相符,小雷利用其与大理石反应(其中杂质不参与反应)做了探究实验,数据记录如表。
(1)实验中共生成CO2的质量为 g;
(2)通过计算,判断测定结果与试剂瓶标签上溶质的质量分数是否相符(需要计算过程,计算结果精确到0.1%)。若不符合,请你分析可能原因。
2.(2021•娄底)某校学生在进行“二氧化碳的实验室制取与性质”实验活动中,产生了很多还含有盐酸的废液。同学们实验测定该废液中盐酸的溶质质量分数。(其他物质不参加反应)
(1)用氢氧化钠固体配制60g溶质质量分数为10%的氢氧化钠溶液,需要水的质量是 g。
(2)取50g废液样品于烧杯中,向其中逐滴加入10%的氢氧化钠溶液,恰好完全反应时共消耗氢氧化钠溶液20g。试计算该废液中盐酸的溶质质量分数。(写出计算过程)
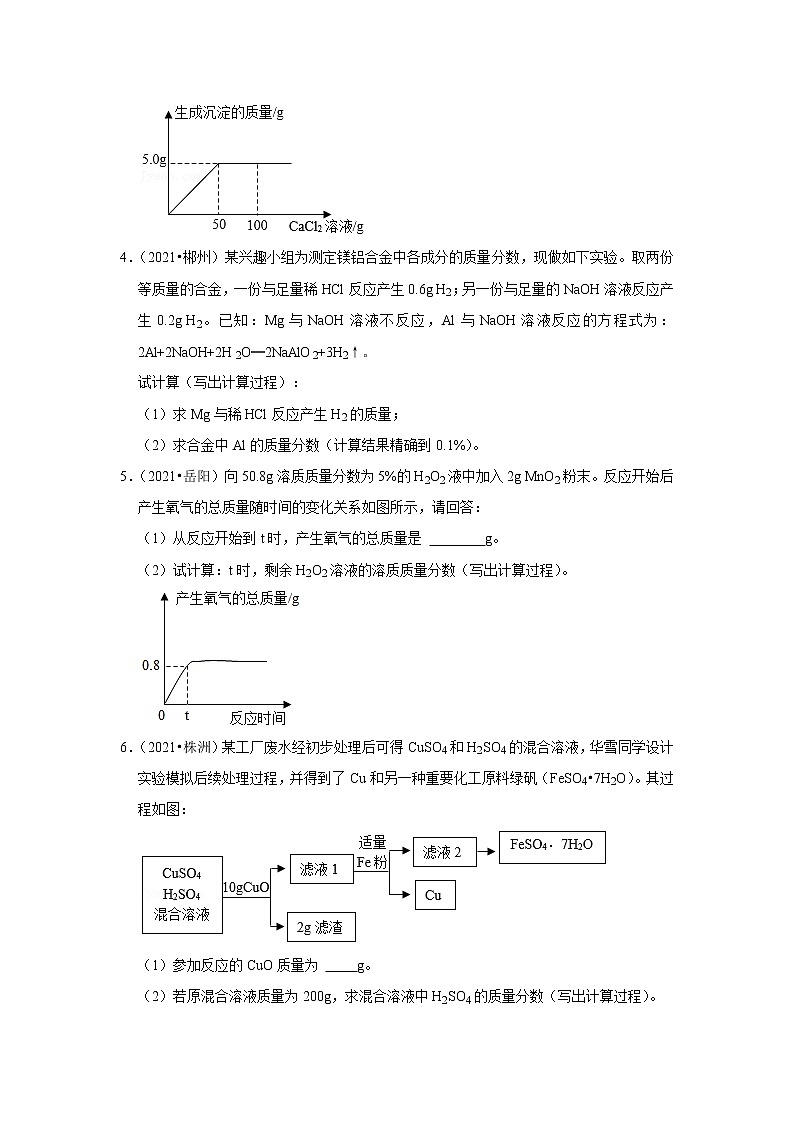
3.(2021•湘西州)氢氧化钠保存不当容易变质,为测定一瓶久置的氢氧化钠的纯度,现取20.0g样品于烧杯中加水至完全溶解,然后逐滴加入CaCl2溶液,反应过程中加入氯化钙溶液的质量与生成沉淀的质量关系如图所示(不考虑其他因素的影响)。
反应方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl
请根据图示和计算回答:
(1)恰好完全反应时加入CaCl2溶液的质量为: g。
(2)该样品中氢氧化钠的质量分数是多少?
4.(2021•郴州)某兴趣小组为测定镁铝合金中各成分的质量分数,现做如下实验。取两份等质量的合金,一份与足量稀HCl反应产生0.6g H2;另一份与足量的NaOH溶液反应产生0.2g H2。已知:Mg与NaOH溶液不反应,Al与NaOH溶液反应的方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑。
试计算(写出计算过程):
(1)求Mg与稀HCl反应产生H2的质量;
(2)求合金中Al的质量分数(计算结果精确到0.1%)。
5.(2021•岳阳)向50.8g溶质质量分数为5%的H2O2液中加入2g MnO2粉末。反应开始后产生氧气的总质量随时间的变化关系如图所示,请回答:
(1)从反应开始到t时,产生氧气的总质量是 g。
(2)试计算:t时,剩余H2O2溶液的溶质质量分数(写出计算过程)。
6.(2021•株洲)某工厂废水经初步处理后可得CuSO4和H2SO4的混合溶液,华雪同学设计实验模拟后续处理过程,并得到了Cu和另一种重要化工原料绿矾(FeSO4•7H2O)。其过程如图:
(1)参加反应的CuO质量为 g。
(2)若原混合溶液质量为200g,求混合溶液中H2SO4的质量分数(写出计算过程)。
(3)若反应消耗11.2g Fe,求理论上可得到绿矾的质量(写出计算过程)。
7.(2021•衡阳)如图所示,托盘天平两盘各放一只质量相等的烧杯,烧杯内均盛有100g等质量分数的稀硫酸,天平平衡。现向左盘烧杯中加入6.5g锌粒,恰好完全反应,向右盘烧杯中加入一定质量的氧化铜粉末,充分反应后,天平仍然保持平衡。求:
(1)右盘烧杯中加入氧化铜的质量;
(2)稀硫酸中溶质的质量分数。
8.(2021•永州)取溶质质量分数为5%的过氧化氢溶液60.0g于锥形瓶中,加入一定量的二氧化锰,反应完全(假定过氧化氢全部分解,产生的氧气全部逸出,水的蒸发忽略不计)。请分析并计算:
(1)上述过氧化氢溶液完全反应后,产生氧气的质量是多少?(写出详细的计算过程,保留小数点后一位)
(2)若测得上述反应后锥形瓶内物质的质量为59.8g,根据二氧化锰在该反应中所起的作用,可知加入二氧化锰的质量应为 g。
9.(2021•怀化)某化学兴趣小组的同学为测定假黄金(铜锌合金)中锌的质量,取20克假黄金置于烧杯中,取120克稀盐酸,分6次加入,充分反应,实验数据如下:
请回答:
(1)表中m= 。
(2)假黄金(铜锌合金)中锌的质量是 g。
(3)所用稀盐酸中溶质的质量分数是多少?(写出计算过程)
10.(2021•邵阳)将木炭与氧化铜的粉末均匀混合,放入试管中高温加热至质量不再变化,冷却后粉末质量为16.8克。把该粉末全部倒入烧杯中,加入足量的稀硫酸搅拌,得到蓝色溶液和红色不溶物,经过滤、洗涤、干燥,所得红色不溶物的质量为12.8克。固体物质与所加稀硫酸之间的关系如图所示,则:
(1)反应生成铜的质量是 克;
(2)所加稀硫酸的溶质质量分数是 ;
(3)加热前氧化铜的质量是多少克?(写出计算过程)
2021年湖南中考化学真题分类汇编-计算题.dc
参考答案与试题解析
一.计算题(共10小题)
1.(2021•益阳)为测定实验室某瓶盐酸的溶质质量分数是否与标签相符,小雷利用其与大理石反应(其中杂质不参与反应)做了探究实验,数据记录如表。
(1)实验中共生成CO2的质量为 2.2 g;
(2)通过计算,判断测定结果与试剂瓶标签上溶质的质量分数是否相符(需要计算过程,计算结果精确到0.1%)。若不符合,请你分析可能原因。
【专题】溶质质量分数与化学方程式相结合的计算.
【分析】(1)减少的质量即为产生的二氧化碳的质量,所以可以根据质量守恒定律求算出产生的二氧化碳的质量;
(2)根据二氧化碳的质量可以求算出稀盐酸中氯化氢的质量,然后结合化学方程式及溶质的质量分数的计算公式可以完成解答。
【解答】解:(1)根据质量守恒定律可知,二氧化碳的质量=53.0g+6.0g﹣56.8g=2.2 g;故填:2.2;
(2)设盐酸中含有的溶质为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
x 2.2g
=
解得:x=3.65g
盐酸的溶质质量分数为:×100%=7.3%,与试剂瓶标签上溶质的质量分数相符;
答:与试剂瓶标签上溶质的质量分数相符。
【点评】要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景等,结合所学的相关知识和技能,细致地分析题意并细心地探究、推理后,按照题目要求进行认真地选择或解答即可。
2.(2021•娄底)某校学生在进行“二氧化碳的实验室制取与性质”实验活动中,产生了很多还含有盐酸的废液。同学们实验测定该废液中盐酸的溶质质量分数。(其他物质不参加反应)
(1)用氢氧化钠固体配制60g溶质质量分数为10%的氢氧化钠溶液,需要水的质量是 54 g。
(2)取50g废液样品于烧杯中,向其中逐滴加入10%的氢氧化钠溶液,恰好完全反应时共消耗氢氧化钠溶液20g。试计算该废液中盐酸的溶质质量分数。(写出计算过程)
【专题】溶质质量分数与化学方程式相结合的计算.
【分析】(1)根据溶剂质量=溶液质量﹣溶质质量进行分析;
(2)根据氢氧化钠盐酸反应生成氯化钠和水,依据氢氧化钠的质量进行计算。
【解答】解:(1)需要水的质量是60g﹣60g×10%=54g;
(2)设该废液中盐酸的溶质质量分数为x
NaOH+HCl=NaCl+H2O
40 36.5
20g×10% x×50g
=
x=3.65%
故答案为:(1)54;
(2)该废液中盐酸的溶质质量分数为3.65%。
【点评】本题主要考查了溶液的配制和化学方程式的计算,难度不大,需要认真理解题意,然后进行解答。
3.(2021•湘西州)氢氧化钠保存不当容易变质,为测定一瓶久置的氢氧化钠的纯度,现取20.0g样品于烧杯中加水至完全溶解,然后逐滴加入CaCl2溶液,反应过程中加入氯化钙溶液的质量与生成沉淀的质量关系如图所示(不考虑其他因素的影响)。
反应方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl
请根据图示和计算回答:
(1)恰好完全反应时加入CaCl2溶液的质量为: 50 g。
(2)该样品中氢氧化钠的质量分数是多少?
【专题】溶质质量分数与化学方程式相结合的计算.
【分析】(1)根据图象所给的信息分析;
(2)根据图中沉淀的质量求出样品中碳酸钠的质量,然后求样品中氢氧化钠的质量分数。
【解答】解:(1)从图象可以看出,恰好完全反应时加入CaCl2溶液的质量为50g;故填:50;
(2)解:设碳酸钠的质量是x。
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 5.0g
=
解得x=5.3g
该样品中氢氧化钠的质量分数是:×100%=73.5%。
答:该样品中氢氧化钠的质量分数是73.5%。
【点评】本题主要考查了根据化学方程式的计算,是化学的基本计算,应加强图象分析能力,提高计算的能力。
4.(2021•郴州)某兴趣小组为测定镁铝合金中各成分的质量分数,现做如下实验。取两份等质量的合金,一份与足量稀HCl反应产生0.6g H2;另一份与足量的NaOH溶液反应产生0.2g H2。已知:Mg与NaOH溶液不反应,Al与NaOH溶液反应的方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑。
试计算(写出计算过程):
(1)求Mg与稀HCl反应产生H2的质量;
(2)求合金中Al的质量分数(计算结果精确到0.1%)。
【专题】有关化学方程式的计算.
【分析】铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,和稀盐酸反应生成氯化铝和氢气,稀盐酸和镁反应生成氯化镁和氢气,根据反应的化学方程式及其提供数据可以进行相关方面的计算。
【解答】解:(1)由2Al+2NaOH+2H2O═2NaAlO2+3H2↑、2Al+6HCl═2AlCl3+3H2↑可知,相等质量的铝和氢氧化钠溶液、稀盐酸反应时生成的氢气质量相等,镁与稀盐酸反应生成氢气质量:0.6g﹣0.2g=0.4g,
答:Mg与稀HCl反应产生H2的质量是0.4g。
(2)设铝质量为x,镁质量为y,
2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
54 6
x 0.2g
=,
x=1.8g,
Mg+2HCl═MgCl2+H2↑,
24 2
y 0.4g
=,
y=4.8g,
合金中Al的质量分数是:×100%=27.3%,
答:合金中Al的质量分数是27.3%。
【点评】本题主要考查学生根据化学方程式进行计算和推断的能力,计算时要注意规范性和准确性。
5.(2021•岳阳)向50.8g溶质质量分数为5%的H2O2液中加入2g MnO2粉末。反应开始后产生氧气的总质量随时间的变化关系如图所示,请回答:
(1)从反应开始到t时,产生氧气的总质量是 0.8 g。
(2)试计算:t时,剩余H2O2溶液的溶质质量分数(写出计算过程)。
【专题】溶质质量分数与化学方程式相结合的计算.
【分析】(1)从图中所给的信息分析;
(2)根据题目中所给的数据进行计算。
【解答】解:(1)从图中可以看出,从反应开始到t时,产生氧气的总质量是0.8g;故填:0.8
设生成0.8g氧气消耗H2O2质量为x,
2H2O22H2O+O2↑
68 32
x 0.8g
=
解得:x=1.7g
剩余过氧化氢的质量为50.8g×5%﹣1.7g=0.84g
t时,剩余H2O2溶液的溶质质量分数为×100%=1.68%
答:t时,剩余H2O2溶液的溶质质量分数为1.68%。
【点评】本题主要考查学生运用化学方程式和质量分数公式进行计算的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力。
6.(2021•株洲)某工厂废水经初步处理后可得CuSO4和H2SO4的混合溶液,华雪同学设计实验模拟后续处理过程,并得到了Cu和另一种重要化工原料绿矾(FeSO4•7H2O)。其过程如图:
(1)参加反应的CuO质量为 8 g。
(2)若原混合溶液质量为200g,求混合溶液中H2SO4的质量分数(写出计算过程)。
(3)若反应消耗11.2g Fe,求理论上可得到绿矾的质量(写出计算过程)。
【专题】溶质质量分数与化学方程式相结合的计算.
【分析】(1)依据流程图信息分析;
(2)依据氧化铜与硫酸反应方程式,结合题中数据分析;
(3)依据铁与硫酸铜反应方程式,结合题中数据分析。
【解答】解:(1)分析流程图信息可知,参加反应的CuO质量为10g﹣2g=8g,故填:8;
(2)设混合溶液中H2SO4的质量分数为x
CuO+H2SO4=CuSO4+H2O
80 98
8g 200g×x
=
x=4.9%
(3)分析Fe+CuSO4=FeSO4+Cu,FeSO4+7H2O=FeSO4•7H2O可得如下关系:
设:理论上可得到绿矾的质量为y
Fe~FeSO4•7H2O
56 278
11.2g y
=
y=55.6g
答:(2)混合溶液中H2SO4的质量分数为4.9%;(3)理论上可得到绿矾的质量为55.6g。
【点评】此题主要考查化学方程式计算,主要是利用流程图及反应方程式来分析和解决化学计算中的有关问题,结合各方面的条件得出正确结论。
7.(2021•衡阳)如图所示,托盘天平两盘各放一只质量相等的烧杯,烧杯内均盛有100g等质量分数的稀硫酸,天平平衡。现向左盘烧杯中加入6.5g锌粒,恰好完全反应,向右盘烧杯中加入一定质量的氧化铜粉末,充分反应后,天平仍然保持平衡。求:
(1)右盘烧杯中加入氧化铜的质量;
(2)稀硫酸中溶质的质量分数。
【专题】溶质质量分数与化学方程式相结合的计算.
【分析】由于锌与稀硫酸反应生成了氢气和硫酸锌,氧化铜与稀硫酸反应生成了硫酸铜和水,右盘烧杯中加入氧化铜的质量等于左边增重的质量,根据锌的质量可求出生成氢气的质量、稀硫酸中溶质的质量,据此可进行有关的计算。
【解答】解:(1)设6.5g锌粒反应生成氢气的质量为x,稀硫酸中溶质的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 98 2
6.5g y x
解得:x=0.2g y=9.8g
所以右盘烧杯中加入氧化铜的质量为:6.5g﹣0.2g=6.3g;
(2)稀硫酸中溶质的质量分数为:=9.8%。
答:(1)右盘烧杯中加入氧化铜的质量是6.3g;
(2)稀硫酸中溶质的质量分数是9.8%。
【点评】根据天平平衡原则解答此题,需进行化学方程式的计算,此题即培养学生的天平使用原则,又能锻炼学生的解题能力,可谓一举多得.
8.(2021•永州)取溶质质量分数为5%的过氧化氢溶液60.0g于锥形瓶中,加入一定量的二氧化锰,反应完全(假定过氧化氢全部分解,产生的氧气全部逸出,水的蒸发忽略不计)。请分析并计算:
(1)上述过氧化氢溶液完全反应后,产生氧气的质量是多少?(写出详细的计算过程,保留小数点后一位)
(2)若测得上述反应后锥形瓶内物质的质量为59.8g,根据二氧化锰在该反应中所起的作用,可知加入二氧化锰的质量应为 1.2 g。
【专题】有关化学方程式的计算.
【分析】(1)根据过氧化氢的质量和反应的方程式可计算出产生氧气的质量;
(2)根据质量守恒定律计算出二氧化锰的质量。
【解答】解:(1)设产生氧气的质量是x
2H2O22H2O+O2↑
68 32
60.0g×5% x
解得:x=1.4g
答:产生氧气的质量是1.4g;
(2)由于反应前后二氧化锰的质量不变,则二氧化锰的质量为:59.8g﹣(60.0g﹣1.4g)=1.2g。
故答案为:(1)1.4g;
(2)1.2。
【点评】本题主要考查了根据化学方程式的计算,难度不大,注意理解催化剂的作用和特点是计算的基础。
9.(2021•怀化)某化学兴趣小组的同学为测定假黄金(铜锌合金)中锌的质量,取20克假黄金置于烧杯中,取120克稀盐酸,分6次加入,充分反应,实验数据如下:
请回答:
(1)表中m= 16.1 。
(2)假黄金(铜锌合金)中锌的质量是 6.5 g。
(3)所用稀盐酸中溶质的质量分数是多少?(写出计算过程)
【专题】溶质质量分数与化学方程式相结合的计算.
【分析】(1)根据表中的数据分析m的值;
(2)根据表中的数据和铜不与稀盐酸反应分析;
(3)根据20g的稀盐酸反应的锌的质量可计算20g的稀盐酸中溶质的质量,即可计算出稀盐酸中溶质的质量分数。
【解答】解:(1)由表中的数据可知。每20g的稀盐酸完全反应的锌的质量为1.3g,第四次加入的稀盐酸还能与锌反应,说明了第三次加入的稀盐酸完全发生可反应,则m=17.4﹣1.3=16.1。
(2)由表中的数据可知,第六次加入的稀盐酸未反应,说明了锌已完全反应,剩余的固体是铜,则假黄金(铜锌合金)中锌的质量是:20g﹣13.5g=6.5g。
(3)设20g的稀盐酸中溶质的质量为x
Zn+2HCl=ZnCl2+H2↑
65 73
1.3g x
解得:x=1.46g
所用稀盐酸中溶质的质量分数是:=7.3%。
故答案为:(1)16.1;
(2)6.5g;
(3)7.3%。
【点评】本题主要考查了根据化学方程式的计算,对比分析表中的数据,分析出每20g的稀盐酸完全反应锌的质量还是计算的关键.
10.(2021•邵阳)将木炭与氧化铜的粉末均匀混合,放入试管中高温加热至质量不再变化,冷却后粉末质量为16.8克。把该粉末全部倒入烧杯中,加入足量的稀硫酸搅拌,得到蓝色溶液和红色不溶物,经过滤、洗涤、干燥,所得红色不溶物的质量为12.8克。固体物质与所加稀硫酸之间的关系如图所示,则:
(1)反应生成铜的质量是 12.8 克;
(2)所加稀硫酸的溶质质量分数是 9.8% ;
(3)加热前氧化铜的质量是多少克?(写出计算过程)
【专题】溶质质量分数与化学方程式相结合的计算.
【分析】氧化铜能与硫酸反应,铜不能与硫酸反应,依据图象的数据利用方程式可以求出固体中氧化铜的质量以及16.8g固体中氧化铜的质量,即可解答问题。
【解答】解:(1)氧化铜能与硫酸反应,铜不能与硫酸反应,所以反应生成铜的质量是12.8克,
(2)木炭与氧化铜的粉末反应完毕剩余氧化铜的质量:16.8g﹣12.8g=4g,
设与4g氧化铜反应消耗硫酸的质量为x则:
CuO+H2SO4═CuSO4+H2O
80 98
4g x
根据:解得:x=4.9g,所以稀硫酸的溶质质量分数是:=9.8%;
(3)解:设与木炭反应的氧化铜质量为y,则
C+2CuO2Cu+CO2↑
160 128
y 12.8g
根据:解得:y=16g
则加热前氧化铜的质量为:16g+16.8g﹣12.8g=20g
答:加热前氧化铜的质量为20克。
故答案为:(1)12.8;
(2)9.8%;
(3)20。
【点评】此题是对化学方程式计算的考查题,解题的关键是能够对相关的反应情况进行的分析。
声明:试题解析著作权属菁优网所有,未经书面同意,不得复制发布
日期:2021/8/3 10:41:42;用户:jun赵;邮箱:z_j1985@126.cm;学号:20374781
反应前物质的质量/g
充分反应后物质的质量/g
盐酸样品
大理石
剩余固体(含大理石)+液体
53.0
6.0
56.8
实验次序
1
2
3
4
5
6
加入稀盐酸的质量/g
20
20
20
20
20
20
剩余固体的质量/g
18.7
17.4
m
14.8
13.5
13.5
反应前物质的质量/g
充分反应后物质的质量/g
盐酸样品
大理石
剩余固体(含大理石)+液体
53.0
6.0
56.8
实验次序
1
2
3
4
5
6
加入稀盐酸的质量/g
20
20
20
20
20
20
剩余固体的质量/g
18.7
17.4
m
14.8
13.5
13.5
2021年湖南中考化学真题分类汇编-推断题: 这是一份2021年湖南中考化学真题分类汇编-推断题,共19页。试卷主要包含了制“84”消毒液的流程如图等内容,欢迎下载使用。
2021年浙江中考化学真题分类汇编之计算题: 这是一份2021年浙江中考化学真题分类汇编之计算题,共35页。试卷主要包含了钙是生物体骨骼的重要组成元素,小嘉发现,是一种常见的肥料等内容,欢迎下载使用。
2021年山东中考化学真题分类汇编之计算题: 这是一份2021年山东中考化学真题分类汇编之计算题,共29页。












