

第61讲 元素(学生版) 备战2022 浙教版科学 中考高频考点 加强练
展开
这是一份第61讲 元素(学生版) 备战2022 浙教版科学 中考高频考点 加强练,共27页。试卷主要包含了单选题,填空题,实验探究题,解答题等内容,欢迎下载使用。
备战2022 浙教版科学 中考高频考点 加强练
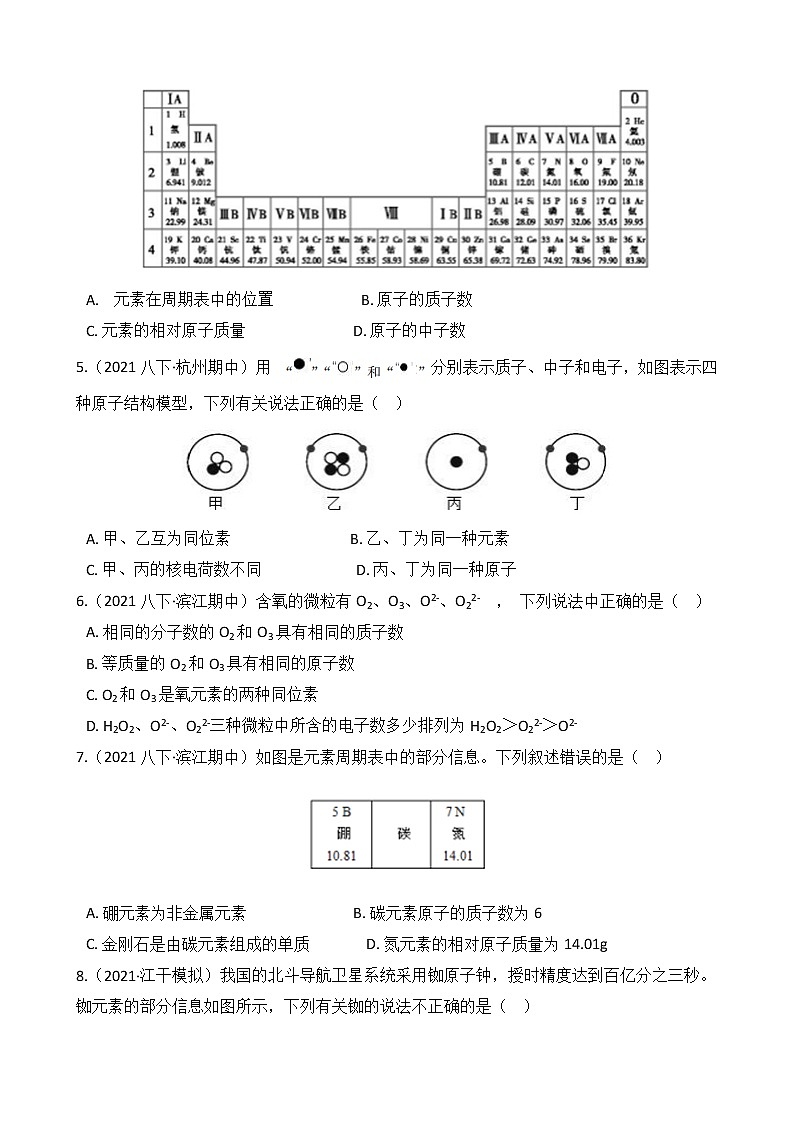
第61讲 元素
一、单选题
1.(2021八下·上城期末)钪在元素周期表中的信息如图,其单质在工业上常用来制耐高温合金等。则( )
A. 钪原子的原子核中有21个中子 B. 钪元素的元素符号为Sc
C. 钪元素的相对原子质量为44.96g D. 钪单质稍微加热就会熔化
2.(2021八下·苍南期末)2020年12月17日,嫦娥五号返回器携带月壤样品回到地球。月壤中蕴含He-3,它被认为是解决未来能源问题的重要物质之一。He-3原子核内有2个质子和1个中子。地球上的氦元素主要以He-4(信息如图所示)形式存在。下列说法不正确的是( )
A. He-3、He-4属于同种元素 B. He-3、He-4互为同位素
C. He-3和He-4的相对原子质量相同 D. He-3原子和He-4原子的电子数相同
3.(2021八下·乐清期末)2021年4月13日,日本政府决定将福岛核污水排入大海。核污水中含大量对人体有害的放射性物质,如锶的同位素。如图是元素周期表中锶的有关信息,下列说法错误的是( )
A. 锶原子的质量为87.62克 B. 锶原子的核外电子数为38
C. 锶原子的核内质子数为38 D. 锶原子的相对原子质量为87.62
4.(2021八下·杭州期中)2019年是元素周期表诞生第150周年。下表是元素周期表的一部分,从表中不能获取的信息是( )
A. 元素在周期表中的位置 B. 原子的质子数
C. 元素的相对原子质量 D. 原子的中子数
5.(2021八下·杭州期中)用 分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是( )
A. 甲、乙互为同位素 B. 乙、丁为同一种元素
C. 甲、丙的核电荷数不同 D. 丙、丁为同一种原子
6.(2021八下·滨江期中)含氧的微粒有O2、O3、O2-、O22- , 下列说法中正确的是( )
A. 相同的分子数的O2和O3具有相同的质子数
B. 等质量的O2和O3具有相同的原子数
C. O2和O3是氧元素的两种同位素
D. H2O2、O2-、O22-三种微粒中所含的电子数多少排列为H2O2>O22->O2-
7.(2021八下·滨江期中)如图是元素周期表中的部分信息。下列叙述错误的是( )
A. 硼元素为非金属元素 B. 碳元素原子的质子数为6
C. 金刚石是由碳元素组成的单质 D. 氮元素的相对原子质量为14.01g
8.(2021·江干模拟)我国的北斗导航卫星系统采用铷原子钟,授时精度达到百亿分之三秒。铷元素的部分信息如图所示,下列有关铷的说法不正确的是( )
A. 属于金属元素 B. 铷原子核外有37个电子
C. 相对原子质量为85.47g D. 元素符号为Rb
9.(2021八下·杭州期中)铱﹣192是一种放射性物质,对人体有严重辐射伤害。如图所示是元素周期表中铱元素的有关信息,下列说法错误的是( )
A. 铱元素原子的原子核内有77个质子 B. 铱元素是金属元素
C. 铱元素原子的核外有77个电子 D. 铱元素的相对原子质量为192.2g
10.(2021八下·西湖期中)下列元素分类正确的是( )
A. 金属元素:钙、镁、钡、铜、铁、汞
B. 非金属元素:碳、氢、氧、氮、磷、金
C. 稀有元素:氦、氖、氩、氪、氯、氡
D. 人体必需的微量元素:铁、碘、氟、硒、钙、铅
11.(2021八下·拱墅期中)下列关于符号“K”所表示的意义,正确的是( )
①钾元素②钾的原子核③一个钾元素④一个钾原子⑤金属钾
A. ①②⑤ B. ②③④⑤ C. ①④⑤ D. ①③④⑤
12.(2021八下·拱墅期中)如图是金元素在元素周期表中的信息示意图,从图中获取的信息正确的是( )
A. 金元素属于非金属元素 B. 一个金原子的中子数为197.0
C. 一个金原子的核外电子数为118 D. 一个金原子核带有79个单位的正电荷
13.(2021八下·杭州月考)溴元素的原子结构示意图及其在周期表中的信息如图所示,下列说法正确的是( )
A. n=7 B. 该元素为金属元素
C. 相对原子质量和中子数均为35g D. 原子序数、核电荷数、质子数均为79.90
14.(2021八下·仙居月考)人类用于制造触屏材料的铟,相关信息如图,下列说法中正确的是( )
A. 铟是一种非金属元素
B. 原子的核电荷数为49
C. 与其他元素根本区别是中子数不同
D. 相对原子质量是114.8g
15.(2020八上·浙江期末)下列符号既可表示一个原子,又可表示一种元素,还能表示一种物质的是( )
A. N B. Mg C. O2 D. H
16.国际通用的元素符号是用1个或2个拉丁文字母表示的,其中第一个字母大写,第二个字母小写。镍元素的拉丁文名称为Niccolum,则镍的元素符号为( )
A. Ni B. NI C. n D. Na
17.下列元素名称与元素符号书写都正确的是( )
A. 锌Zn B. 硅SI C. 氯cl D. 贡Hg
18.生活中常会见到“加碘盐”、“含氟牙膏”、“加铁酱油”,其中的“碘”、“氟”、“铁”指的是( )
A. 原子 B. 离子 C. 元素 D. 分子
19.(2020九上·长兴开学考)2019年诺贝尔化学奖授予给了三位科学家,以表彰他们在发明锂电池过程中做出的贡献。锂的元素符号是( )
A. La B. Li C. Al D. Be
20.(2020八下·上虞期末)用数轴表示某些化学知识直观、简明、易记,下列数轴表示错误的是( )
A. 地壳中元素含量由高到低 B. 不同种原子的原子序数依次递增
C. 空气中气体体积分数由大到小 D. 含氮物质中氮元素的化合价从低到高
二、填空题
21.(2021八下·上城期末)A是相对原子量最小的元素,B元素组成的一种单质可供人体呼吸,C元素是地壳中含量最多的金属元素,请写出相应的化学式:A元素和B元素组成的一种化合物________,C元素组成的单质________。
22.(2021·绍兴) 2021年3月,四川三星堆遗址进行了新一轮考古发掘。至今三星堆已出土了黄金面具、青铜纵目面具等一批珍贵文物,如图。
(1)出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜________(选填“强”或“弱”)。
(2)古代制作青铜器的铜来源于铜矿,如黄铜矿。黄铜矿的主要成分为二硫化亚铁铜 (CuFeS2),其中铁元素和铜元素均为+2价,硫元素的化合价为 ________。
(3)应用碳-14测出三星堆遗址距今3000年左右,碳-12和碳-14是碳元素的两种同位素原子,它们的主要区别是原子核中________ 数不同。
23.(2021八下·杭州期末)如图为钟表式元素周期表,该钟表的整点时间小时数与该元素的质子数相等。“时针”和“分针”指向对应的两种元素,1:00对应的两种元素各自形成的单质________、________,8:00对应的两种元素形成的化合物为________。
24.(2021八下·拱墅期末)元素周期表是学习和研究科学的重要工具。下表是元素周期表的一部分,据表回答问题:
(1)原子序数为11和17的两种元素组成的物质是生活中一种必不可少的物质,该物质是由________(选填“分子”“原子”或“离子”)构成。
(2)核磁共振(NMR)技术已广泛应用于医学领域,已知只有质子数为奇数的原子才有NMR现象,表中标号为①~⑤的五种元素的原子,能产生NMR现象的是________(填写元素符号)。
25.(2021八下·杭州期中)如图为某牙膏的部分标签,活性成分单氟磷酸钠的化学式为Na2PO3F(相对分子质量为144),请回答下列问题。
(1)人体中氟元素属于________(填“微量”或“常量”)元素。
(2)Na2PO3F中金属元素与氧元素的质量比为________。
(3)若牙膏中其他成分不含氟,则每支这种牙膏中,含Na2PO3F的质量为________g。(结果保留小数点后一位)
26.(2021八下·滨江期中)信息:化学中我们可以用原子结构示意图来表示原子核电荷数和核外电子排布。如:氧原子的原子结构示意图为 ,其中 表示核电荷数, 表示核外电子排布。
图中的①是元素周期表中的某种元素的信息,②中A、B、C、D是四种粒子的原子结构示意图。请你回答:
(1)图①所代表的元素名称是________,该元素的原子19F的中子数为________;
(2)A,B,C,D属于同种元素的粒子是________(填序号);
(3)图C所表示的粒子的化学符号是________。
(4)图D所表示的元素所组成的单质化学式是________。
(5)氚是氢的一种同位素,氚原子含有1个质子和2个中子。图③中能正确表示氚离子(3H+)结构的是________(填序号)。
27.(2021八下·仙居月考)右表微粒中,属于同种元素的是________。互为同位素原子的是________。
组别
质子
中子
电子
A
14
14
14
B
17
18
17
C
17
20
17
D
17
18
18
28.(2021八下·台州开学考)下列元素符号书写上都有错误,请改正。
(1)钙CA:________
(2)氯CL:________
(3)镁Ma:________
(4)钠Ne:________
(5)汞HG:________
(6)氦Hi:________
29.(2021八下·杭州开学考)根据所给的元素名称填写元素符号
①镁 ________ ②铝 ________ ③锂 ________ ④氧 ________ ⑤钙 ________
⑥氩 ________ ⑦氟 ________ ⑧碳 ________ ⑨氯 ________ ⑩磷 ________
30.核电荷数为1~18的元素的原子结构示意图等信息如下,请回答下列问题。(注圆圈表示原子核,圈内数字表示核内带电微粒数目,弧线上数字表示电子数)
(1)2017年5月9日,中国科学院等单位联合发布了115号元素的中文名为“镆”。此元素原子的核电荷数为________,核外电子数为________。
(2)在第三周期中,随着原子序数的递增,元素原子核外电子数目的变化规律是________。
(3)利用上表中给出的元素,写出含有氢元素的常见单质、化合物的化学式各一个:单质________;化合物________。
(4)钠和氯元素构成的化合物是由________构成的。
三、实验探究题
31.(2021·湖州) 20世纪30年代,美国科学家鲁宾和卡门利用18O分别标记H2O和CO2 , 将C18O2和CO2分别通入含小球藻的H2O和H218O中(如右图所示),迅速收集产生的氧气
(1)18O和16O互为________原子,H218O和H2O以及CO2和C18O2具有相同的化学性质,因此可以用来示踪物质变化情况。
(2)该实验是为了研究________。
(3)该实验必须在________条件下进行。
(4)制备含有较多小球藻的液体时,需在盛有小球藻的液体中加人________(选填“无机盐”或“无机盐和有机物”),并置于适宜环境下培养。
32.(2020八下·丽水期中)小林同学收集了一些微粒的资料,请你和他一起根据表格数据回答下列问题。
微粒名称
质子数
中子数
电子数
带电性
A
14
14
14
不带电
B
26
30
24
带2个单位正电荷
C
14
14
16
D
14
16
14
不带电
(1)表格中属于互为同位素的是________。
(2)根据表格信息写出微粒C的符号________。
(3)比较C与D两种微粒,其中质量较大的是________。
33.(2020八下·杭州期中)元素周期表是化学学习和研究的重要工具。如图所示为元素周期表的一部分:
(1)②所示元素与③所示元素的元素符号分别是________和________。它们在元素周期表里属于同一________(选填“周期”或“族”),写出②所示元素与氧元素组成的化合物的化学式________。
(2)③所示元素原子的核外电子数是________,它在发生化学反应时容易________(选填“得到”或“失去”)电子,形成的离子符号是________。
四、解答题
34.(2021·嘉兴)氕、氘、氚是氢的三种同位素原子,它们的原子结构模型如图所示,相关信息如下表。试回答:
名称
符号
相对原子质量
氕
H
1
氘
D
2
氚
T
3
(1)超重水有一定的放射性。一个超重水分子由两个氚原子和一个氧原子构成,其化学式可表示为T2O。T2O中T的化合价为________。
(2)重水是由氘和氧组成的化合物,化学式可表示为D2O,重水和普通水化学性质相似。在海水中重水的质量约占0.02%,则100吨海水中所含氘的质量是多少?
(3)原子结构模型中的“ ”表示的粒子是________。
35.(2021·奉化模拟)当前正是“水果之王”西瓜俏销的季节。西瓜味道甘甜多汁,清爽解渴,含有水、蛋白质、葡萄糖、维生素C、铁等多种营养成分,是最富有营养、最纯净、食用最安全的食品之一。
(1)人体需要七大营养素,上面没有涉及到的营养素是________。
(2)上面提到的“铁”指的是铁________(选填“原子”、“单质”或“元素”);
(3)维生素C也叫抗坏血酸,其化学式为:C6H8O6。则17.6克维生素C完全燃烧后放出的二氧化碳的质量为________克。
36.(2021八下·吴兴期中)在“宏观﹣微观﹣符号”之间建立联系,是学习化学的一种重要思维方式。如图是元素周期表中部分元素的原子结构模型图,根据所学知识回答下列问题.
(1)A属于________元素(填元素种类);
(2)D原子与钠发生化学反应时易________(填“得到”或“失去”)电子;
(3)由B元素和D元素组成的化合物的化学式为________;
(4)E粒子带1个单位正电荷,则该粒子的符号为________;
(5)F为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断正确的是 .
A.原子序数Z>Y
B.核外电子数:X=Y
C.Y和Z的化学性质相似
37.(2021八下·杭州期中)元素周期表中,核电荷数从 1 到 18 的元素的原子结构示意图如下图。根据已有的结 构理论回答下列问题:
(1)已知 M2-核外有 x 个电子,其中相对原子质量为 a,则该粒子含有的中子数为 ________;
(2)1-18 号元素中,A 原子的核电荷数为 m,已知 A2-和 B3+具有相同的电子层结构,则 B 原子核中 的质子数为 ________;
(3)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有一些相似的结构和性质。 下列各组粒子中属于等电子体的是 (填字母序号);
A.NO 和 O2
B.CO 和 N2
C.SO2 和 CO2
D.PO4和SO4
(4)某粒子的结构示意图 ,当 x-y=8 时,该粒子的符号为 ________。
答案解析部分
一、单选题
1.答案: B
考点:元素周期表
分析:在元素周期表中,中间的汉字为元素名称,左上角的数字为原子序数,右上角的字母为元素符号,正下方的数字为相对原子质量,据此分析判断。
解答:根据图片可知,该原子的相对原子质量为44.96,质子数=原子序数=21,则中子数:44.96-21=23.96,故A、C错误;
根据图片可知,该元素的符号为Sc,故B正确;
根据“常用来制耐高温合金”可知,该单质的熔点很高,不容易熔化,故D错误。
故选B。
2.答案: C
考点:同位素,元素的概念,相对原子质量
分析:(1)质子数相同为同种元素,质子数不同为不同种元素;
(2)具有相同质子数和不同中子数的原子,成为同位素原子;
(3)相对原子质量等于质子数和中子数的和;
(4)在原子中,质子数=核外电子数。
解答:A. He-3、He-4的质子数都是1,属于同种元素,故A正确不合题意;
B. He-3、He-4的质子数相同,而中子数不同,为同位素,故B正确不合题意;
C. He-3的相对原子质量为3,He-4的相对原子质量为4,故C错误符合题意;
D. He-3原子和He-4原子的电子数与质子数相同,都是2,故D正确不合题意。
故选C。
3.答案: A
考点:元素周期表
分析:在元素周期表中,中间的汉字为元素名称,左上角的数字为原子序数,右上角的字母为元素符号,正下方的数值为相对原子质量,据此分析判断即可。
解答:AD.锶原子的相对原子质量为87.62,没有单位g,故A错误符合题意,D正确不合题意;
B.锶原子的原子序数为38,根据核外电子数=质子数=核外电子数可知,核外电子数为38,故B正确不合题意;
C.锶原子的核内质子数=原子序数=38,故C正确不合题意。
故选A。
4.答案: D
考点:元素周期表
分析:根据对元素周期表的认识分析。
解答:A.根据元素周期表,我们可以知道它处于哪个周期和哪个族,故A正确不合题意;
在每个方格中,中间的汉字为元素名称,右上角的字母为元素符号,左上角的数字为质子数,正下方的数值为相对原子质量,故B、C正确不合题意;
元素周期表不能直接反映原子的中子数,故D错误符合题意。
故选D。
5.答案: B
考点:原子的构成与探索过程,同位素,元素的概念
分析:(1)具有相同的质子数和不同中子数的原子,称为同位素原子;
(2)判断是否为同种元素的关键:是否质子数相同;
(3)核电荷数=质子数;
(4)分析质子数和中子数是否相同即可。
解答:A.甲的质子数为1,乙的质子数为2,二者质子数不同,肯定不是同位素,故A错误;
B.乙和丁的质子数都是2,因此为同一种元素,故B正确;
C.甲和丙的质子数都是1,根据核电荷数=质子数可知,它们的核电荷数相等,故C错误;
D.丙和丁的质子数和中子数都不同,肯定不是同一种原子,故D错误。
故选B。
6.答案: B
考点:分子和原子的区别和联系,同位素
分析:(1)根据O2和O3化学式的含义进行分析;
(2)一个氧分子由2个氧原子构成,一个臭氧分子由3个氧原子构成,故3个氧分子和2个臭氧分子的质量相等;
(3)具有相同质子数和不同中子数的原子成为同位素;
(4)根据各种微粒中含有的电子数分析判断.
解答:A.设分子数为n,那么O2和O3的氧原子个数之比为:2n:3n=2:3;一个氧原子含有8个质子,那么它们质子数的比值为:(8×2):(8×3)=2:3,故A错误;
B.一个氧分子由2个氧原子构成,一个臭氧分子由3个氧原子构成,故3个氧分子和2个臭氧分子的质量相等,而3个氧气分子和2个臭氧分子都含6个氧原子,故所含原子数目相同,故B正确;
C.O2和O3中氧原子的质子数和中子数相等,不是同位素,故C错误;
D.H2O2、O2-、O22- 三种微粒中所含的电子数分别为18、10、18,所以三种微粒中所含的电子数多少排列为H2O2=O22->O2- , 故D错误。
故选B。
7.答案: D
考点:元素周期表
分析:在元素周期表中,中间的汉字为元素的名称,右上角的字母是元素的符号,左上角的数字为元素的原子序数,正下方的数值为相对原子质量,据此分析判断。
解答:A.硼中没有金字旁,则该元素为非金属元素,故A正确不合题意;
B.碳在硼和氮元素之间,那么它的质子数也在二者之间,则该元素原子的质子数为6 ,故B正确不合题意;
C.金刚石是由碳元素组成的单质,故C正确不合题意;
D.氮元素的相对原子质量为14.01,没有单位g,故D错误符合题意。
故选D。
8.答案: C
考点:元素周期表
分析:根据元素周期表左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量分析。
解答:A、该元素名称还“钅”,属于金属元素,不符合题意;
B、 铷原子质子数=原子序数=核外电子数=37 ,不符合题意;
C、 相对原子质量为85.47 ,单位是“1”不是“g”,符合题意;
D、该元素符号为 元素符号为Rb ,不符合题意;
故选C。
9.答案: D
考点:元素周期表
分析:在元素周期表中,中间的汉字为元素名称,右上角的字母为元素符号,左上角的数字表示质子数,正下方的数值表示相对原子质量,据此分析判断。
解答:A.左上角的数字为77,那么铱元素原子的原子核内有77个质子 ,故A正确不合题意;
B.铱中含有金字旁,则该元素是金属元素,故B正确不合题意;
C.原子的核外电子数=质子数,则铱元素原子的核外有77个电子,故C正确不合题意;
D.铱元素的相对原子质量为192.2,没有单位g,故D错误符合题意。
故选D。
10.答案: A
考点:元素的种类与分布
分析:根据元素分类的知识判断。
解答:A.金属元素:钙、镁、钡、铜、铁、汞,故A正确;
B.金是金属元素,不是非金属元素,故B错误;
C.氯气不是稀有气体,故C错误;
D.铅不是人体必需的元素,故D错误。
故选A。
11.答案: C
考点:元素的符号及其意义
分析:根据元素符号的含义分析。
解答:“K”可以表示钾元素,也可以表示一个钾原子,还能表示金属钾这种物质,即①④⑤正确,故C符合题意,而A、B、D不合题意。
故选C。
12.答案: D
考点:元素周期表
分析:(1)如果元素名称中含有金字旁,则为金属元素;
(2)(3)在元素周期表中,中间的汉字为元素的名称,右上角的字母为元素的符号,左上角的数字为原子序数,正下方的数是相对原子质量;
(4)在原子中,原子序数=质子数=核电荷数=核外电子数。
解答:A.金元素本身就是金属元素,故A错误;
B.根据图片可知,金原子的质子数为79,相对原子质量为197,那么中子数为:197-79=118,故B错误;
C.金原子的核外电子数=原子序数=79,故C错误;
D.金原子的质子数=原子序数=79,因此带有79个单位的正电荷,故D正确。
故选D。
13.答案: A
考点:元素周期表,常见金属与金属的物理性质及用途
分析:(1)在原子中,质子数=核外电子数;
(2)一般情况下,如果元素名称中含有金字旁,则为金属元素;
(3)(4)在元素周期表中,中间的汉字为元素名称,左上角的数字为质子数,右上角的字母为元素符号,正下方的数值为相对原子质量。
解答:A.根据质子数=核外电子数得到:35=2+8+18+n,则n=7,故A正确;
B.元素名称为溴,不含金字旁,不是金属元素,故B错误;
C.相对原子质量为79.9,中子数为:79.9-38=34.9,故C错误;
D.原子序数=质子数=核电荷数=35,故D错误。
故选A。
14.答案: B
考点:元素周期表,常见金属与金属的物理性质及用途
分析:(1)一般情况下,如果元素名称中有金字旁,那么它就是金属元素;
(2)在元素周期表中,中间的汉字为元素名称,左上角的数字为原子序数,正下方的数值是相对原子质量;
(3)元素是具有相同核电荷数的同一类原子的统称;
(4)相对原子质量没有单位。
解答:A.铟中带有金字旁,为金属元素,故A错误;
B.元素名称左上角的数字为49,那么该原子的核电荷数=质子数=原子序数=49,故B正确;
C.元素不同,本质是质子数不同,故C错误;
D.相对原子质量为114.8,而没有单位g,故D错误。
故选B。
15.答案: B
考点:元素的符号及其意义
分析:分析各个选项中符号的意义即可。
解答:A.N的意义:①氮元素;②一个氮原子,但是氮气用N2表示,故A错误;
B.Mg的意义:①镁元素;②一个镁原子;③单质镁,故B正确;
C.O2的意义:①一个氧分子;②氧气,但是不能表示氧原子,故C错误;
D.H的意义:①一个氢原子;②氢元素,但是不能表示氢气(H2),故D错误。
故选B。
16.答案: A
考点:元素的符号及其意义
分析:根据元素符号“一大二小”的书写原则分析。
解答: 镍的元素符号为 Ni,A正确。
故选A。
17.答案: A
考点:元素的符号及其意义
分析:根据元素符号“一大二小”的书写原则分析。
解答:A、锌的元素符号为Zn,符合题意;
B、硅的元素符号为Si,不符合题意;
C、氯的元素符号为Cl,不符合题意;
D、Hg为汞的元素符号,不符合题意;
故选A。
18.答案: C
考点:元素的种类与分布
分析:根据食品中各成分为元素的成分而与存在形态无关分析。
解答: 生活中常会见到“加碘盐”、“含氟牙膏”、“加铁酱油”中的“碘”、“氟”、“铁”指的是元素;
故选C。
19.答案: B
考点:元素的符号及其意义
分析:根据金属的元素符号解答。
解答:锂是一种金属元素,它的元素符号为Li,故B正确,而A、C、D错误。
故选B。
20.答案: C
考点:元素的种类与分布,元素周期表,元素化合价的规则与计算,空气的成分及探究
分析:(1)根据地壳的元素组成判断;
(2)根据元素周期表判断;
(3)根据空气中组成成分和体积分数解答;
(4)计算出各种物质中氮元素的化合价进行比较即可。
解答:A.地壳中的元素含量从高到低依次为:氧、硅、铝、铁、钙……,故A正确不合题意;
B.根据元素周期表可知,在第二周期,原子序数依次增大的元素为:钠、镁、铝、硅、磷、硫、氯、氩,故B正确不合题意;
C.空气中气体的体积分数从大到小依次为:氮气、氧气、稀有气体、二氧化碳、水蒸气和其它气体,故C错误符合题意;
D.NH3中氮元素的化合价为-3价,N2中氮元素的化合价为0价,NaNO2中氮元素的化合价为+3价,KNO3中氮元素的化合价为+5价,故D正确不合题意。
故选C。
二、填空题
21.答案: H2O;Al
考点:元素的符号及其意义
分析:根据题目的描述确定元素名称,进而写出对应的化学式。
解答:A是相对原子量最小的元素H;B元素组成的一种单质可供人体呼吸,即B是O;C元素是地壳中含量最多的金属元素,即C是Al。
A和B组成的化合物为水,化学式为H2O。C元素组成的单质为铝单质,化学式为Al。
22.答案: (1)弱
(2)-2
(3)中子
考点:同位素,元素化合价的规则与计算,金属活动性顺序及其应用
分析:(1)根据金的活动性比铜弱分析;
(2)根据化合物中元素化合价代数和为0分析;
(3)根据同种元素中不同种原子中子数不同分析。
解答:(1) 出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,说明铜的发生了缓慢氧化,而金没有,即金的活动性比铜弱;
(2) 二硫化亚铁铜 (CuFeS2),其中铁元素和铜元素均为+2价,根据化合物中元素化合价代数和为0可知,硫元素的化合价为-2价;
(3) 碳-12和碳-14是碳元素的两种同位素原子,它们的主要区别是原子核中的中子数不同;
故答案为:(1)弱;(2)-2;(3)中子。
23.答案: Mg;H2;MgO
考点:元素的概念
分析:根据图片确定元素名称,再确定单质或化合物的名称,进而写出对应的化学式。
解答:(1)1:00时,时针对准H,分针对准Mg,则形成的单质分别为氢气和镁,化学式为:H2和Mg。
(2)8:00时,时针对准O,分针对准Mg,则二者构成的化合物为氧化镁,化学式为MgO。
24.答案: (1)离子
(2)H、N、P
考点:元素周期表
分析:(1)根据元素周期表确定11和17元素的名称,然后确定二者组成的物质的名称,并确定它的构成情况。
(2)在原子中,原子序数=质子数,根据元素周期表确定原子序数为奇数的元素即可。
解答:(1)原子序数为11的元素为Na元素,而为17的是Cl元素,二者组成的调味品为NaCl,它是由离子构成的。
(2)①为H元素,质子数为1;②为C元素,质子数为6;③为N元素,质子数为7;④为O元素,质子数为8;⑤为P元素,质子数为15。
则能够产生NMR现象的是①③⑤,即H、N和P。
25.答案: (1)微量
(2)23∶24
(3)2.1
考点:元素的种类与分布,有关化学式的计算和推断
分析:(1)微量元素指的是在人体中含量低于人体质0.01%~0.005%的元素,包括铁、碘、锌、硒、氟、铜、钴、镉、汞、铅、铝、钨、钡、钛、铌、锆、铷、锗和稀土元素等。
(2)元素的质量之比等于相对原子质量和个数的乘积之比;
(3)首先用牙膏的净含量×氟含量计算出氟元素的质量,再根据氟元素的质量氟的质量分数计算出含Na2PO3F的质量。
解答:(1)人体中氟元素属于微量元素;
(2)Na2PO3F中金属元素与氧元素的质量比为:(23×2):(16×3)=23:24;
(3)由标签可知,Na2PO3F中氟元素的质量为200g×0.14%=0.28g,
则每支这种牙膏中Na2PO3F的质量为:0.28g19144≈2.1g。
26.答案: (1)氟元素;10
(2)BC
(3)Cl-
(4)Ar
(5)丙
考点:同位素,元素的概念,分子、原子、离子、元素与物质之间的关系,元素周期表
分析:(1)在元素周期表中,中间的汉字为元素的名称,左上角的数字为原子序数,右上角的字母是元素的符号,正下方的数值是相对原子质量。原子的原子序数=核电荷数=质子数,相对原子质量=质子数+中子数。
(2)元素是具有相同核电荷数(质子数)的同一类原子的统称;
(3)根据核电荷数确定元素种类,根据核外电子数和核电荷数比较,确定所带的电荷数,进而写出粒子符号;
(4)根据D中的核电荷数确定元素名称,进而写出单质的化学式;
(5)根据描述确定氚原子的中子数和质子数,根据所带电荷确定核外的电子数即可。
解答:(1)根据图①可知,原子序数为9,符号为F,那么该元素为氟元素。该元素的原子19F的质子数为9,相对原子质量为9,那么中子数为:19-9=10.
(2)同种元素的核电荷数肯定相同,则表示同种元素的粒子是BC。
(3)图C中,原子序数为17,则为氯元素;核外电子数为18,而质子数为17,则带一个单位的负电荷,该粒子的符号为: Cl- ;
(4)图D中,质子数为18,则该元素为氩,它为单原子分子,则单质化学式为Ar;
(5)氚原子含有1个质子和2个中子,且H+丢失一个电子,那么外层没有电子,因此表示氚离子的是丙。
27.答案: BCD;BC
考点:同位素,元素的概念
分析:具有相同的核电荷数(即核内质子数)的一类原子的总称叫元素;具有相同质子数和不同中子数的原子叫同位素原子。
解答:根据表格可知,B、C、D三种原子的质子数相同,因此为同种元素;而B、C两种原子的质子数相同而中子数不同,为同位素原子。
28.答案: (1)Ca
(2)Cl
(3)Mg
(4)Na
(5)Hg
(6)He
考点:元素的符号及其意义
分析:根据对元素名称和符号的认识分析解答。
解答:(1)钙的符号为Ca;
(2)氯的符号为Cl;
(3)镁的符号为Mg;
(4)钠的符号为Na;
(5)汞的符号为Hg;
(6)氦的符号为He;
29.答案: Mg;Al;Li;O;Ca;Ar;F;C;Cl;P
考点:元素的符号及其意义
分析:根据有关元素名称和符号的知识解答。
解答:①镁的符号为Mg;
②铝的符号为Al;
③锂的符号为Li;
④氧的符号为O;
⑤钙的符号为Ca;
⑥氩的符号为Ar;
⑦氟的符号为F;
⑧碳的符号为C;
⑨氯的符号为Cl;
⑩磷的符号为P。
30.答案: (1)115;115
(2)依次增多
(3)H2;H2O
(4)离子
考点:原子的构成与探索过程,元素周期表
分析:(1)在原子内部,原子序数=核电荷数=核外电子数=质子数;
(2)根据表格数据分析解答;
(3)只含有一种元素的纯净物叫单质;含有两种或多种元素的是化合物;
(4)分子、原子和离子是构成物质的基本微粒。
解答:(1)根据原子序数=核电荷数=核外电子数=质子数可知,115号元素的中文名为“镆”。此元素原子的核电荷数为115,核外电子数为115;
(2)根据表格可知,在第三周期中,随着原子序数的递增,元素原子核外电子数目的变化规律是:依次增多;
(3)由氢元素组成的单质只能是氢气,即H2;氢元素和氧元素组成化合物水,那么化学式为H2O;
(4)钠和氯元素构成的化合物氯化钠是由离子构成的。
三、实验探究题
31.答案: (1)同位素
(2)光合作用产生的氧气中的氧元素来源于二氧化碳还是水
(3)有光
(4)无机盐
考点:控制变量法,植物生长需要无机盐,光合作用的原料、条件和产物,光合作用的原理,同位素
分析:本题为实验探究题,分析题中信息,生成的O2中的氧元素与H2O中的氧元素一致,故得出“光合作用释放的氧气中的氧元素来自水”的结论。光合作用是指绿色植物通过叶绿体,利用光能,把二氧化碳和水转化为储存着能量的有机物,并释放氧气的过程。
解答:(1)18O和16O的质子数相同而中子数不同,互为同位素。
(2)光合作用我们可以用表示式来表示:CO2+H2O→叶绿体光能有机物(储存着能量)+O2
, 由于在第一组实验中向绿色植物提供H2O和C18O2, 如果光合作用释放的氧全部来自于H2O,那么表达式可以表示为:C18O2+H2O→叶绿体光能有机物(储存着能量)+O2, 从表达式中可看出O原子来自于H2O,而不来自于C18O2, 因为C18O2的氧原子已经做了标记18。由于在第二组实验中向同种植物提供H218O和CO2, 如果光合作用释放的氧全部来自于H2O,那么表达式为:
CO2+H218O→叶绿体光能有机物(储存着能量)+18O2 , 从表达式中就可很明显地看出18O原子是来自于H218O,而不是来自于CO2, 因为CO2的氧原子没有做标记,而第一组实验产生的物质为O2, 第二组实验产生的物质为18O2 , 因此该实验是为了研究光合作用产生的氧气中的氧元素来源于二氧化碳还是水。
(3)由于绿色植物需要光合作用,因此该实验必须在有光条件下进行。
(4)小球藻可以吸收无机盐,同时通过光合作用吸收其中的二氧化碳。
故答案为:(1)同位素(2)光合作用产生的氧气中的氧元素来源于二氧化碳和水(3)有光(4)无机盐
32.答案: (1)AD
(2)Si2-
(3)D
考点:同位素,离子的书写与意义,相对原子质量
分析:(1)具有相同的质子数和不同中子数的原子,称为同位素原子;
(2)根据表格可知,质子带正电,电子带负电,将二者的电荷数相减,哪个有剩余,那么该微粒就带几个单位的哪种电荷;
(3)相对原子质量等于质子数加中子数,相对原子质量越大,那么原子的实际质量越大。
解答:(1)A和D的原子的质子数都是14,但是中子数不同,所以它们互为同位素;
(2)微粒C质子数14,电子数为16,二者之差为2,由于电子数多,所以带2个单位的负电荷;
(3)C的相对原子质量:14+14=28,D的相对原子质量:14+16=30,则质量较大的是D。
33.答案: (1)Na;S;周期;Na2O
(2)16;得到;S2-
考点:元素周期表
分析:(1)根据②和③在元素周期表中的位置确定元素的名称和符号。元素周期表中,每行称为一个周期,每列称为一个族。有两种元素组成,其中一种是氧元素的纯净物叫氧化物。
(2)在原子中,一般情况下,核外电子数等于质子数等于原子序数。原子的最外层电子数少于4的容易失去电子带正电,而多于4的容易得到电子带负电。离子的写法:在元素符号的右上角写上数字和正负号,数字在前,正负号在后。
解答:(1)②所示元素与③所示元素的元素符号分别是Na和S。它们在元素周期表里属于同一行,即同一周期。写出②所示Na元素与氧元素组成的化合物的化学式Na2O.
(2)③的原子序数是16,该元素原子的核外电子数是16,它在发生化学反应时容易得到2个电子,带2个单位的负电荷,即形成的离子符号是 S2- 。
四、解答题
34.答案: (1)+1
(2)重水中氘的质量分数= 2×22×2+16×100%=20%
100t海水中所含氘的质量=100t×0.02%×20%=0.004t=4kg
答:100t海水中所含的质量为4kg。
(3)中子
考点:同位素,元素化合价的规则与计算,有关化学式的计算和推断
分析:(1)具有相同质子数和不同中子数的原子成为同位素原子,据此分析解答;
(2)在化学式中,正负化合价的代数和为零,据此分析计算;
(3)首先根据化学式计算出重水中氘的质量分数,在用海水的质量×重水的质量分数×氘的质量分数计算出海水中含有氘的质量。
解答:(1)根据图片可知,三种原子中 的个数不同,根据“同位素原子中子数不同”可知,它表示中子。
(2)在T2O中O元素的化合价为-2价,根据正负化合价代数和为零得到:2x+(-2)=0,解得:x=+1价。
(3)重水中氘的质量分数= 2×22×2+16×100%=20% ;
100t海水中所含氘的质量=100t×0.02%×20%=0.004t=4kg;
35.答案: (1)脂肪、粗纤维
(2)元素
(3)26.4
考点:食物与营养,元素的概念,有关化学式的计算和推断
分析:(1)人类所需要的营养物质主要有糖类、脂肪、蛋白质、水、无机盐、维生素等六大类,膳食纤维列为第七类营养元素。
(2)铁元素是人体所需的微量元素之一。
(3)根据质量守恒定律,反应前后元素种类、质量均不变,可计算出17.6克维生素C中碳元素的质量,结合化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
解答:(1)人类所需要的营养物质主要有糖类、脂肪、蛋白质、水、无机盐、维生素等六大类,现在把膳食纤维列为第七类营养元素,因此人体需要七大营养素,上面没有涉及到的营养素是脂肪、粗纤维。
(2)铁是合成血红蛋白的主要元素,缺乏会患贫血,因此上面提到的“铁”指的是铁元素。
(3)维生素C的相对分子质量为12×6+8×1+6×16=176,维生素C燃烧生成二氧化碳和水,17.6g克维生素C中碳元素的质量为
17.6g×12×6176×100%=7.2g;能产生二氧化碳的质量为7.2g÷(1212+16×2×100%)=26.4g。
故答案为:(1)脂肪;粗纤维(2)元素(3)26.4
36.答案: (1)非金属
(2)得到
(3)MgCl2
(4)Na+
(5)A
考点:元素周期表
分析:(1)根据原子序数确定元素名称,根据名称中是否有金字旁判断它是否属于金属元素;
(2)最外层电子数大于4的容易得到电子,小于4的容易失去电子;
(3)根据质子数确定元素种类,然后写出对应的化学式;
(4)失去电子带正电荷,据此确定E原子的电子数,进而确定质子数,从而确定元素种类,并写出离子符号;
(5)①在元素周期表中,在每一行中,右边的元素比左边元素的原子序数大;在每一列中,下边的元素比上边的元素原子序数大;
②核外电子数=原子序数=质子数;
③在每一列中,具有相同的最外层电子数,因此具有相同的化学性质。
解答:(1)A的质子数为14,那么它为硅元素,由于不含有金字旁,所以属于非金属元素;
(2)D原子的最外层电子数为7>4,因此与钠反应时容易得到电子;
(3)B的质子数为12,则为镁元素;D的质子数为17,则为氯元素,二者组成的化合物为氯化镁,化学式为MgCl2。
(4)E带1个单位的正电荷,那么E原子的核外电子数为:10+1=11,那么E为钠元素,则带一个单位正电荷的钠离子写作Na+。
(5)A.Y和Z在同一行,且Z在右边,因此原子序数Z>Y,故A正确;
B.X和Y在同一列,因此具有相同的最外层电子数,但是Y比X多一个电子层,因此二者的核外电子数肯定不同,故B错误;
C.Y和Z在同一行,最外层电子数不同,那么它们的化学性质不同,故C错误。
故选A。
37.答案: (1)a+2-x
(2)m+5
(3)B
(4)S2-
考点:元素周期表
分析:(1)原子失去电子带正电,得到电子带负电,据此计算出M原子的核外电子数,即质子数,再根据中子数=相对原子质量-质子数计算即可。
(2)原子失去电子带正电,得到电子带负电,据此计算出A2-核外电子数,再根据 B3+ 计算出B原子的核外电子数,也就是它的质子数。
(3)比较两种分子的原子数和电子数是否相等即可;
(4)在原子中,质子数=核外电子数,据此推算出最外层电子数,通过比较确定所带电荷的正负和数量,从而写出粒子的符号。
解答:(1)M2-核外有 x 个电子,那么M原子的核电荷数为:x-2。根据质子数=核电荷数可知,M的质子数为:x-2,则它的中子数为:a-(x-2)=a+2-x。
(2) A 原子的核电荷数为 m, 它得到2个电子形成A2- , 则A2-的核外电子数为:m+2,因此
B3+ 的核外电子数也是:m+2。B原子失去5个电子得到B3+ ,则B原子的核外电子数:m+2+3=m+5。根据质子数=核电荷数可知,B原子的质子数为:m+5。
(3)在B选项中,CO的原子个数为2,电子数为:12+16=18;N2的原子个数为2,电子数:14+14=28,因此二者为等离子体,故选B。
(4)因为原子的质子数=核外电子数,
所以x=2+8+y=10+y;
那么该原子的最外层电子数:y=x-10;
当x-y=8时,即y=x-8;
二者比较可知,后者最外层电子比前者多2个;
即它得到2个电子达到8个电子的稳定结构;
那么该原子的最外层电子数:8-2=6.
那么该原子的质子数=核电荷数=2+8+6=16;
因此该元素为硫元素,粒子符号为:S2-。
相关试卷
这是一份第60讲 构成物质的微粒(学生版) 备战2022 浙教版科学 中考高频考点 加强练,共32页。试卷主要包含了单选题,填空题,实验探究题,解答题,综合说理题等内容,欢迎下载使用。
这是一份第69讲 燃烧和灭火(学生版) 备战2022 浙教版科学 中考高频考点 加强练,共28页。试卷主要包含了单选题,填空题,解答题,实验探究题,综合说理题等内容,欢迎下载使用。
这是一份第66讲 空气(学生版) 备战2022 浙教版科学 中考高频考点 加强练,共32页。试卷主要包含了单选题,填空题,实验探究题,解答题,综合说理题等内容,欢迎下载使用。








