

化学选修4 化学反应原理专题二 化学反应与化学平衡第三单元 化学平衡的移动课后测评
展开1.化学平衡的特征是什么?
提示:化学平衡的特征可概括为“递、等、动、定、变”。
2.影响化学反应速率的因素有哪些?
提示:浓度、温度、压强、催化剂、反应物的接触面积、固体反应物的颗粒大小等因素。
3.影响化学平衡常数的因素是什么?
提示:影响化学平衡常数的因素只有温度。
4.写出合成氨反应的化学方程式,并分析该反应的特点。
提示:N2+3H22NH3,该反应ΔH<0、ΔS<0(正反应气体体积减小)该反应为可逆反应。
[新知探究]
探究 化学平衡的移动和移动方向
(1)化学平衡的移动:
当平衡体系条件改变时,原有平衡状态被破坏,一段时间后会达到新的平衡状态。化学平衡的移动,就是改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程。
(2)图示:
(3)平衡移动的方向:
①若v(正)>v(逆),则平衡向正反应方向移动。
②若v(正)=v(逆),则平衡不移动。
③若v(正)<v(逆),则平衡向逆反应方向移动。
[必记结论]
外界条件与平衡移动的辩证关系
(1)外界条件改变,平衡不一定发生移动。
①若条件改变,未引起化学反应速率的变化,则平衡一定不移动,如增加固体的用量。
②若条件改变,引起了化学反应速率的变化,但v(正)、v(逆)同等程度的改变,则平衡不发生移动。
③若条件改变,引起v(正)≠v(逆),则平衡一定发生移动。
(2)平衡发生移动,说明外界条件一定发生改变。
[成功体验]
1.在密闭容器中进行如下反应:CO2(g)+C(s) 2CO(g)。
(1)在单位时间内消耗了1 ml CO2(g),同时又消耗了2 ml CO(g),则v(正)__________v(逆),反应处于__________状态。
(2)若向该容器中再充入1 ml CO2(g),则v′(正)________v′(逆),化学平衡向____________移动;
(3)若向该容器中增加C(s),则v′(正)________v′(逆),化学平衡________移动。
解析:单位时间内消耗1 ml CO2(g),则生成2 ml CO(g),而今又同时消耗了2 ml CO(g),说明v(正)=v(逆),反应达到平衡状态。增大反应物浓度,则v′(正)>v′(逆),平衡向正反应方向移动。若向该容器中增加C(s),因为固体的浓度为常数,故改变其用量时,浓度不发生改变,v′(正)=v′(逆),化学平衡不发生移动。
答案:(1)= 化学平衡 (2)> 正反应方向
(3)= 不
[新知探究]
探究1 利用重铬酸根离子与铬酸根离子之间的转化实验探究浓度对化学平衡的影响,填写下列空格。
(1)实验原理:Cr2Oeq \\al(2-,7)+H2O2CrOeq \\al(2-,4)+2H+
橙色 黄色
(2)实验探究:
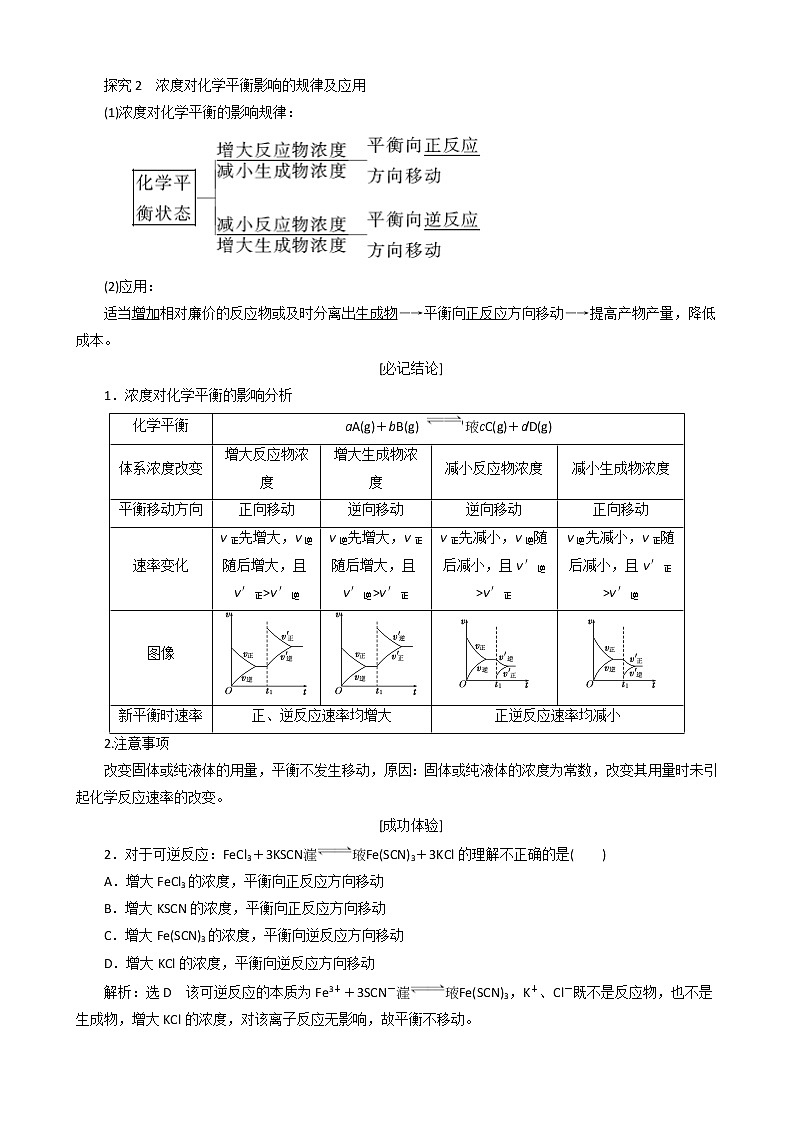
探究2 浓度对化学平衡影响的规律及应用
(1)浓度对化学平衡的影响规律:
(2)应用:
适当增加相对廉价的反应物或及时分离出生成物―→平衡向正反应方向移动―→提高产物产量,降低成本。
[必记结论]
1.浓度对化学平衡的影响分析
2.注意事项
改变固体或纯液体的用量,平衡不发生移动,原因:固体或纯液体的浓度为常数,改变其用量时未引起化学反应速率的改变。
[成功体验]
2.对于可逆反应:FeCl3+3KSCNFe(SCN)3+3KCl的理解不正确的是( )
A.增大FeCl3的浓度,平衡向正反应方向移动
B.增大KSCN的浓度,平衡向正反应方向移动
C.增大Fe(SCN)3的浓度,平衡向逆反应方向移动
D.增大KCl的浓度,平衡向逆反应方向移动
解析:选D 该可逆反应的本质为Fe3++3SCN-Fe(SCN)3,K+、Cl-既不是反应物,也不是生成物,增大KCl的浓度,对该离子反应无影响,故平衡不移动。
[新知探究]
探究1 根据(教材P52)图2-19数据,分析压强对合成氨的平衡有何影响?据此,完成下表。
探究2 其他条件不变时,压强改变对化学平衡影响的规律
(1)改变容器体积,增大压强―→化学平衡向着气态物质减少的方向移动;
(2)改变容器体积,减小压强―→化学平衡向着气态物质增多的方向移动。
[必记结论]
1.压强对化学平衡的影响分析
2.注意事项
(1)压强对反应速率、化学平衡移动的影响是通过改变体系中物质的浓度来实现的,故凡是改变了体系的压强但未引起浓度的变化的因素,化学反应速率不变化,化学平衡也不发生移动。
(2)在一定温度下,体积恒定的密闭容器中进行的反应N2(g)+3H2(g)2NH3(g),若充入一定体积的He,总压强增大,但反应速率不变化,平衡不发生移动。
以H2(g)+I2(g)2HI(g)为例的反应前后气体体积不变的反应,改变压强,v(正)、v(逆)同等程度的改变,平衡不移动。
[成功体验]
3.(好题共享·选自人教版教材P32·T7)已达化学平衡的下列反应2X(g)+Y(g)2Z(g)减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
解析:选C 有气体参加的反应,减压后,化学反应速率减小,而且v正和v逆同时减小,平衡向体积增大的方向移动。
4.可逆反应:4A(g)B(g)+xC(g),在一定条件下达到平衡时,增大容器内气体压强,平衡左移,则x的值是( )
A.1 B.2
C.3 D.4
解析:选D 增大压强,平衡向气体减少的方向移动,故4<1+x,x>3,选D。
[新知探究]
探究1 温度对化学平衡影响与反应热的关系
(1)实验探究:
(2)温度对化学平衡影响的规律:
其他条件不变化时,升高温度,化学平衡向吸热方向移动;降低温度,化学平衡向放热方向移动。
探究2 催化剂与化学平衡
催化剂能同等程度的增大正、逆反应的速率,对化学平衡移动无影响,但能缩短达到平衡所需要的时间。
探究3 平衡移动原理及应用
(1)平衡移动原理(又称为勒夏特列原理):
改变影响化学平衡的一个因素,平衡将向着能够减弱这种改变的方向移动。
(2)平衡移动原理的应用:
工业合成氨反应为N2(g)+3H2(g)2NH3(g) ΔH<0
[必记结论]
1.温度对化学平衡的影响分析
[以aA(g)+bB(g)cC(g)+dD(g) ΔH<0为例]
2.催化剂对化学平衡影响的图像
3.正确理解化学平衡移动原理
(1)对平衡移动原理中“减弱这种改变”的正确理解是:增大反应物的浓度时,平衡将向反应物浓度减小的方向移动;增大压强时,平衡将向气体体积缩小的方向移动;升高温度时,平衡将向吸热反应的方向移动。其中的“减弱”不等于“消除”,更不是“扭转”,即平衡移动不能将外界影响完全消除,而只能减弱。
(2)平衡移动原理只适用于判断“改变一个条件”时平衡移动的方向。若同时改变影响平衡移动的几个条件,不能简单地根据平衡移动原理来判断平衡移动的方向,只有在改变的条件对平衡移动的方向影响一致时,才能根据平衡移动原理进行判断。
(3)平衡移动原理仅适用于已达平衡的可逆反应体系。对不可逆过程或未达平衡的可逆过程均不能使用勒夏特列原理。此外,平衡移动原理对所有的动态平衡都适用。[成功体验]
5.(好题共享·选自鲁科版教材P52·T2)若反应aA(g)+bB(g)cC(g)+dD(g)在密闭容器内达到化学平衡以后,升高温度或增大压强都会使平衡混合物中C的质量分数降低,那么:
(1)正反应是________热反应;
(2)反应物与生成物之间的系数关系是(a+b)________(c+d);(填入>、=、<)
(3)为了提高A的利用率,可以采用什么方法?
解析:升高温度或增大压强都会使平衡混合物中C的质量分数降低,说明平衡逆向移动,即逆反应为吸热反应和气体体积减小的反应,则正反应为放热反应和气体体积增大的反应。提高A的利用率,应使平衡向正反应方向移动,采用的方法有增大B的浓度、降低温度或减小压强。
答案:(1)放 (2)< (3)增大B的浓度、降低温度或减小压强
6.工业生成SO3的反应为2SO2(g)+O2(g) 2SO3(g)
ΔH<0,下列能使平衡向正反应方向移动的是( )
A.加入催化剂 B.升温
C.减小压强 D.若入一定量的O2
解析:选D 催化剂仅能改变反应速率,不能引起平衡移动;升温或减小压强平衡向逆反应方向移动;增大O2的浓度,平衡向正反应方向移动。
———————————————[关键语句小结]————————————————
1.增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。
2.通过改变容器体积,增大压强,平衡向气态物质减少的方向移动;减小压强,平衡向气态物质增多的方向移动。
3.升高体系温度,平衡向吸热的反应方向移动;降低体系温度,平衡向放热的反应方向移动。
4.催化剂能够同等程度地增大正、逆反应速率,对化学平衡移动没有影响。
5.化学平衡移动原理(勒夏特列原理)是指:改变影响化学平衡的一个因素,平衡将向着能够减弱这种改变的方向移动。
[例1] 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:
CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增加压强 B.降低温度
C.增大CO的浓度 D.更换催化剂
解析:选B 特别注意:一般来说,有两种及两种以上反应物的可逆反应中,在其他条件不变时,增大其中一种反应物的浓度,能使其他反应物的转化率升高,但本身的转化率反而降低,故C项错误。A.因该反应为反应前后气体物质的量相等的反应,故增加压强只能缩短反应达到平衡的时间,并不能使该平衡发生移动,因而无法提高CO的转化率。B.因该反应为放热反应,降低温度能使平衡向右移动,从而提高CO的转化率。D.催化剂只能影响化学反应的速率,改变可逆反应达到平衡的时间,不能提高CO的转化率。
平衡移动方向与反应物转化率的关系
(1)温度和压强的影响:
温度或压强改变后,若能引起平衡向正反应方向移动,则反应物的转化率一定增大。
(2)反应物用量的影响:
①反应物只有一种,如aA(g)bB(g)+cC(g)
增加A的量,A的浓度增大,平衡正向移动,此种情况等效于加压,A的转化率与气态物质的化学计量数有关;
a=b+c,A的转化率不变;
a>b+c,A的转化率增大;
a
如aA(g)+bB(g)cC(g)+dD(g)
a.若只增加A的量,平衡向正反应方向移动,则A的转化率减小,B的转化率增大。
b.若反应物A、B的物质的量同倍数的增加,平衡向正反应方向移动,此种情况等效于加压,反应物的转化率与气态物质的化学计量数有关。
a+b=c+d,转化率不变;
a+b>c+d,转化率增大;
a+b
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25℃时,该反应的平衡常数K=2.2
解析:选D 由于固体物质的物质的量改变不会引起平衡的移动,A项错误;加入固体Sn(NO3)2后,溶液中c(Sn2+)增大,平衡向左移动,从而使c(Pb2+)增大,B项错误;升高温度时c(Pb2+)增大,表明平衡向左移动,逆反应吸热,正反应ΔH<0,C项错误;由图像中平衡时两种离子的浓度及平衡常数表达式知,25℃时该反应的平衡常数为2.2,D项正确。
(1)无论是反应速率图像还是平衡图像,都要清楚纵、横坐标的含义,都要与化学原理相联系,特别是与平衡移动原理相联系。
(2)
(3)
(4)先拐先平:可逆反应mA(g)+nB(g)pC(g)+qD(g),在转化率-时间曲线中,先出现拐点的曲线先达到平衡,这表示反应的温度高或压强大。
(5)定一议二:图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系。
[例2] (2015·安徽高考)汽车尾气中NO产生的反应为:N2(g)+O2(g)2NO(g)。一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
A.温度T下,该反应的平衡常数K=eq \f(4c0-c12,c\\al(2,1))
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的ΔH<0
解析:选A A项,由曲线a可知,达到平衡时c(N2)=c1 ml/L,则生成的c(NO)=2(c0-c1) ml/L,故K=eq \f(c2NO,cN2·cO2)=eq \f(4c0-c12,c\\al(2,1))。B项,反应物和产物都是气体,当容器保持恒容时,混合气体的密度始终保持不变。C项,催化剂的加入只能改变反应速率而不可能使平衡发生移动,故加入催化剂后达到平衡时,c(N2)仍为c1 ml/L。D项,若曲线b改变的是温度,根据达到平衡时曲线b对应的时间短,则对应温度高,升高温度时c(N2)减小,平衡正向移动,正反应为吸热反应,ΔH>0。
平衡图像题的解题思路
对于例2:(1)画出Cr2Oeq \\al(2-,7)的转化率与温度的函数图像。
(2)指出溶液的c(H+)随温度升高如何变化?
提示:(1)温度升高,平衡向逆反应方向移动,Cr2Oeq \\al(2-,7)的转化率减小,故该图像可为
(2)温度升高,平衡逆向移动,c(H+)减小。
[课堂双基落实]
1.下列事实中,不能用勒夏特列原理解释的是( )
A.打开啤酒瓶盖后产生大量的气泡
B.对2HI(g)H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深
C.反应CO+NO2CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
D.溴水中有下列平衡Br2+H2OHBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
解析:选B 勒夏特列原理是用来解释化学平衡移动问题的,①解释对象,所有的化学平衡;②化学平衡要发生移动。如果平衡不移动不能用勒夏特列原理来解释,如使用催化剂等。B项,对于2HI(g)H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深的原因在于,加压体积缩小,碘蒸气的浓度变大,颜色加深,和勒夏特列原理无关。
2.为了探索外界条件对反应:aX(g)+bY(g)cZ(g)的影响,将X和Y以物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
A.ΔH<0,a+b>c
B.ΔH>0,a+b
D.ΔH<0,a+b
3.某温度下,某容积恒定的密闭容器中发生如下可逆反应:CO(g)+H2O(g)H2(g)+CO2(g) ΔH>0当反应达平衡时,测得容器中各物质均为n ml,欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施可以采用的是( )
A.升高温度
B.加入催化剂
C.再加入n ml CO和n ml H2O
D.再加入2n ml CO2和2n ml H2
解析:选D 正反应是吸热反应,升高温度平衡向正反应方向移动,但可逆反应中反应物不能完全转化为生成物,A不正确。催化剂不能改变平衡状态,氢气浓度不变。反应是可逆反应,转化率不可能是100%,C不正确。D中氢气的浓度是原来的2倍,正确。
4.已知反应mX(g)+nY(g)qZ(g)+pW(s)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法一定正确的是( )
A.通入氦气使密闭容器中压强增大,平衡向正反应方向移动
B.增加X的物质的量,混合气体的密度减小
C.降低温度,混合气体的平均相对分子质量增大
D.X的正反应速率是Y的逆反应速率的m/n倍
解析:选D A项,通入氦气,压强增大,但不改变浓度,不影响平衡移动,错误;B项,增加X的物质的量,总质量增加,体积不变,密度增大,错误;C项,正反应放热,降低温度平衡正向移动,物质的量减小,但质量也减小,相对分子质量的变化不能判断,错误;D项,速率之比等于化学计量数之比,正确。
5.现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________反应(填“吸热”或“放热”),且m+n________p(填“>”、“=”或“<”)。
(2)减压使容器体积增大时,A的质量分数________(填“增大”“减小”或“不变”,下同)。
(3)若加入B(维持体积不变),则A的转化率________。
(4)若升高温度,则平衡时B、C的浓度之比将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________;而维持容器内压强不变,充入氖气后,再次建立平衡时与原平衡相比,气体混合物颜色__________(填“变深”“变浅”或“不变”)。
解析:现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大,正反应方向为吸热反应,逆向为放热反应;当减小压强时,混合体系中C的质量分数也减小,说明平衡逆向移动,得到m+n>p。
(3)若加入B(维持体积不变),则A的转化率增大,加入一种反应物,会提高另外一种反应物的转化率。
(4)若升高温度,平衡将正向移动,则平衡时B、C的浓度之比将减小。
(5)若加入催化剂,加快化学反应速率,但不改变平衡,平衡时气体混合物的总物质的量保持不变。
(6)若B是有色物质,A、C均无色,则加入C(体积不变),平衡逆向移动,混合物颜色加深;而维持容器内压强不变,充入氖气后,体积变大,颜色变浅,虽平衡逆向移动,以减弱这种改变,但再次建立平衡时与原平衡相比,气体混合物颜色仍然变浅。
答案:(1)放热 > (2)增大 (3)增大 (4)减小
(5)不变 (6)变深 变浅
化学平衡
aA(g)+bB(g) cC(g)+dD(g)
体系浓度改变
增大反应物浓度
增大生成物浓度
减小反应物浓度
减小生成物浓度
平衡移动方向
正向移动
逆向移动
逆向移动
正向移动
速率变化
v正先增大,v逆随后增大,且v′正>v′逆
v逆先增大,v正随后增大,且v′逆>v′正
v正先减小,v逆随后减小,且v′逆>v′正
v逆先减小,v正随后减小,且v′正>v′逆
图像
新平衡时速率
正、逆反应速率均增大
正逆反应速率均减小
可逆反应
平衡常数表达式
改变压强对平衡的影响
增大压强
减小压强
N2(g)+3H2(g) 2NH3(g)
K=eq \f(c2NH3,cN2·c3H2)
正向移动
逆向移动
N2O4(g)2NO2(g)
K=eq \f(c2NO2,cN2O4)
逆向移动
正向移动
FeO(s)+CO(g) Fe(s)+CO2(g)
K=eq \f(cCO2,cCO)
不移动
不移动
速率变化
图像
平衡移动方向
新平衡时速率
加压
v(正)、v(逆)同时增大,v′(正)>v′(逆)
正向移动
正、逆反应速率均增大
减压
v(正)、v(逆)同时减小,v′(正)
正、逆反应速率均减小
实验
原理
C2++4Cl-===CCleq \\al(2-,4) ΔH>0
(粉红色) (蓝色)
实验步骤
实验现象
溶液变为蓝色
溶液不变色
溶液变为粉红色
实验结论
升高温度,平衡向正反应方向移动;降低温度,平衡向逆反应方向移动
措施
原因
加入过量的N2
促进平衡正向移动,提高H2的转化率
采用适当的催化剂
加快反应速率
采用高压
有利于平衡向正反应方向移动
采用较高温
加快反应速率同时提高催化剂的活性
将氨液化并及时分离
有利于平衡向正反应方向移动
反应速率变化
图像
平衡移动方向
新平衡时速率
升温
v(正)、v(逆)同时增大,v′(正)
正、逆反应速率均增大
降温
v(正)、v(逆)同时减小,v′(正)>v′(逆)
正向移动
正、逆反应速率均减小
苏教版选修6 实验化学课题1 原电池达标测试: 这是一份苏教版选修6 实验化学课题1 原电池达标测试,共4页。
高中苏教版第一单元 卤代烃习题: 这是一份高中苏教版第一单元 卤代烃习题,共5页。试卷主要包含了在烃分子中引入卤素原子的方法,卤代烃的作用等内容,欢迎下载使用。
苏教版选修4 化学反应原理第一单元 化学反应速率第1课时课后作业题: 这是一份苏教版选修4 化学反应原理第一单元 化学反应速率第1课时课后作业题,共10页。试卷主要包含了3 ml·-1等内容,欢迎下载使用。













