





新教材2022届新高考化学人教版一轮课件:微专题·大素养 2 化学计算中的快捷解题方法
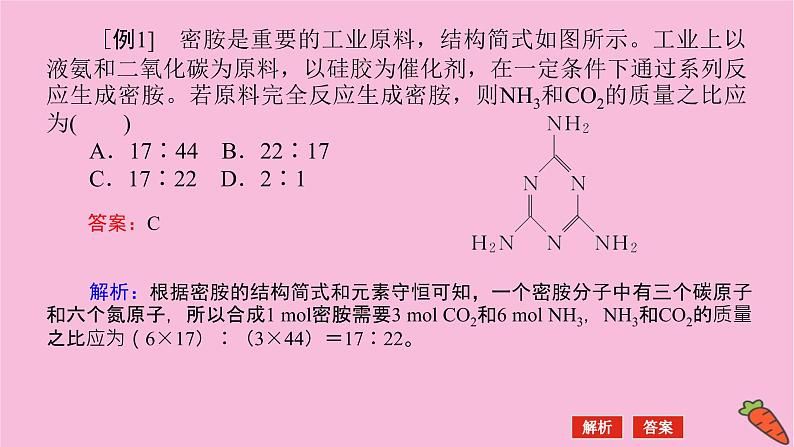
展开[例1] 密胺是重要的工业原料,结构简式如图所示。工业上以液氨和二氧化碳为原料,以硅胶为催化剂,在一定条件下通过系列反应生成密胺。若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )A.17∶44 B.22∶17C.17∶22 D.2∶1
解析:根据密胺的结构简式和元素守恒可知,一个密胺分子中有三个碳原子和六个氮原子,所以合成1 ml密胺需要3 ml CO2和6 ml NH3,NH3和CO2的质量之比应为(6×17)∶(3×44)=17∶22。
[练1] 碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解成氧化铜。溶解28.4 g上述混合物,消耗1 ml·L-1盐酸500 mL。煅烧等质量的上述混合物,得到氧化铜的质量是( )A.35 g B.30 gC.20 g D.15 g
解析:碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜,溶解28.4 g混合物,消耗1 ml·L-1盐酸500 mL,HCl的物质的量为0.5 ml,根据氯元素守恒则CuCl2的物质的量为0.25 ml。根据Cu元素守恒可知,原混合物中含有Cu元素的物质的量为0.25 ml,灼烧等质量的上述混合物,得到氧化铜的物质的量为0.25 ml,则m(CuO)=0.25 ml×80 g·ml-1=20 g。
[练3] 有14 g Na2O2、Na2O、NaOH的混合物与100 g质量分数为15%的盐酸恰好反应,蒸干溶液,最终得固体质量为( )A.20.40 g B.28.60 gC.24.04 g D.无法计算
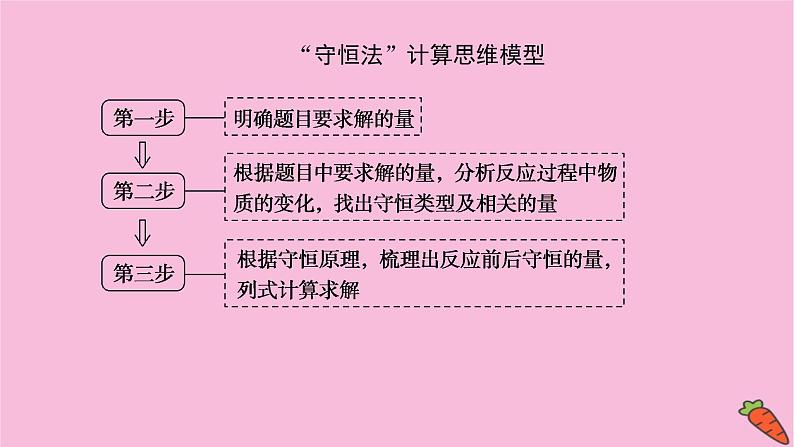
“守恒法”计算思维模型
二、差量法使用差量法的三点注意1.所选用差值要与有关物质的数值成正比例或反比例关系。2.有关物质的物理量及其单位都要正确地使用,即“上下一致,左右相当”。3.对于固体、液体,差量可以是质量差、微粒个数之差;对于气体,差量还可以是同温、同压下的体积差。
[例2] 3 g镁铝合金与100 mL稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4 g,则原硫酸的物质的量浓度为( )A.1 ml·L-1 B.1.5 ml·L-1C.2 ml·L-1 D.2.5 ml·L-1
[练5] 将11.5 g Na投入到过量的m1 g水中得到a溶液,将12 g Mg投入到过量的m2 g盐酸中得到b溶液。若m1=m2,则a、b溶液的质量关系是( )A.a>b B.a
0.024 ml·L-1
[练6] 金属锡的纯度可以通过下述方法分析:将试样溶于盐酸,反应的化学方程式为Sn+2HCl===SnCl2+H2↑,再加入过量的FeCl3溶液,发生如下反应:SnCl2+2FeCl3===SnCl4+2FeCl2,最后用已知浓度的K2Cr2O7溶液滴定生成的Fe2+,反应的化学方程式为6FeCl2+K2Cr2O7+14HCl===6FeCl3+2KCl+2CrCl3+7H2O。现有金属锡试样0.613 g,经上述反应后,共用去0.100 ml·L-1 K2Cr2O7溶液16.0 mL。求试样中锡的百分含量(假定杂质不参加反应)。
[练7] 取KI溶液25 mL,向其中滴加0.4 ml·L-1的FeCl3溶液135 mL,I-完全反应生成I2:2I-+2Fe3+===I2+2Fe2+。将反应后的溶液用CCl4萃取后分液,向分出的水溶液中通入Cl2至0.025 ml时,Fe2+恰好完全反应。求KI溶液的物质的量浓度。
“关系式法”解题思维模型
四、极限假设法极限假设法的思维模式极值法是采用极限思维方式解决一些模糊问题的解题技巧。它是将题设构造成为问题的两个极端,然后依据有关化学知识确定所需反应物或生成物的量值,进行判断分析,求得结果,也称为极端假设法。
[例4] 16 mL由NO与NH3组成的混合气体在催化剂作用下于400 ℃左右可发生反应:6NO+4NH3⇌5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5 mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5∶3 ②3∶2 ③4∶3 ④9∶7。其中正确的是( )A.①② B.①④C.②③ D.③④
解析:根据反应前后气体的总体积,可用差量法直接求解。6NO+4NH3⇌5N2+6H2O(g) ΔV(气体的体积差)6 mL 4 mL 5mL 6 mL (5+6)-(4+6) =1 mL(理论差量)9 mL 6 mL 17.5-16 =1.5 mL(实际差量)由此可知共消耗15 mL气体,还剩余1 mL气体,假设剩余的气体全部是NO,则V(NO)∶V(NH3)=(9 mL+1 mL)∶6 mL=5∶3,假设剩余的气体全部是NH3,则V(NO)∶V(NH3)=9 mL∶(6 mL+1 mL)=9∶7,但因该反应是可逆反应,剩余气体实际上是NO、NH3的混合气体,故V(NO)∶V(NH3)介于5∶3与9∶7之间,对照所给的数据知3∶2与4∶3在此区间内。
[练8] 将总物质的量为n ml的钠和铝的混合物(其中钠的物质的量分数为x)投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V L。下列关系式中正确的是( )A.x=V/(11.2n) B.0
在这几种计算方法中,充分体现了物质的量在化学计算中的核心作用和纽带作用,依据化学方程式的计算又是各种计算方法的基础,其解题步骤如下:①根据题意写出并配平化学方程式。②依据题中所给信息及化学方程式判断过量物质,用完全反应物质的量进行计算。③把已知的和需要求解的量分别写在化学方程式有关化学式的下面,两个量及单位“上下一致,左右相当”。④选择有关量(如物质的量、气体体积、质量等)的关系作为计算依据,列比例式,求未知量。
2024版新教材高考化学全程一轮总复习第二章物质的量微专题大素养3化学计算技能和方法课件: 这是一份2024版新教材高考化学全程一轮总复习第二章物质的量微专题大素养3化学计算技能和方法课件,共29页。PPT课件主要包含了答案D,g·mol-1,50%,CoC2O4,06mol,56g,Fe2O3等内容,欢迎下载使用。
2023高考化学总复习微专题大素养化学计算中的快捷解题方法02课件: 这是一份2023高考化学总复习微专题大素养化学计算中的快捷解题方法02课件,共25页。PPT课件主要包含了答案C,答案B,答案A,“差量法”的解题模型,答案D等内容,欢迎下载使用。
人教版高考化学一轮复习微专题大素养19有机合成的方法和路线课件: 这是一份人教版高考化学一轮复习微专题大素养19有机合成的方法和路线课件












